
Электронные конфигурации атомов
Схематическое изображение орбиталей с учетом их энергии называется энергетическая диаграммой атома. Она отражает взаимное расположение уровней и подуровней энергии.
На
схеме орбитали обозначают в виде
ячеек: ![]() ,
а электроны - в виде стрелок:
,
а электроны - в виде стрелок: ![]() или
или ![]()
Электрон может занять любую свободную орбиталь, но, согласно принципу минимума энергии, всегда предпочитает ту орбиталь, у которой энергия ниже. Принцип запрета Паули ограничивает число электронов на каждой орбитали. Поэтому в одной ячейке (на атомной орбитали) может быть только один или два электрона. На каждом s-подуровне (одна орбиталь) могут находиться два электрона, на каждом p-подуровне (три орбитали) - шесть электронов, на каждом d-подуровне (пять орбиталей) - десять электронов. Правило Гунда определяет порядок заселения орбиталей с одинаковой энергией.
Таким образом, можно получить последовательность заселения атомных орбиталей электронами:
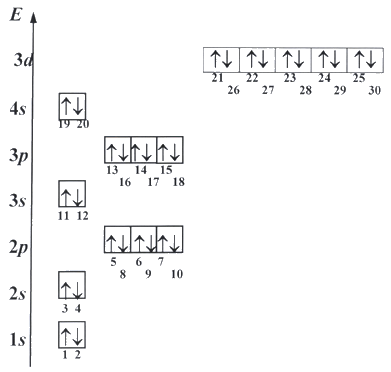
Действуя с помощью принципа минимума энергии, принципа Паули и правила Гунда, можно определить порядок заселения орбиталей электронами и построить электронную формулу любого элемента.
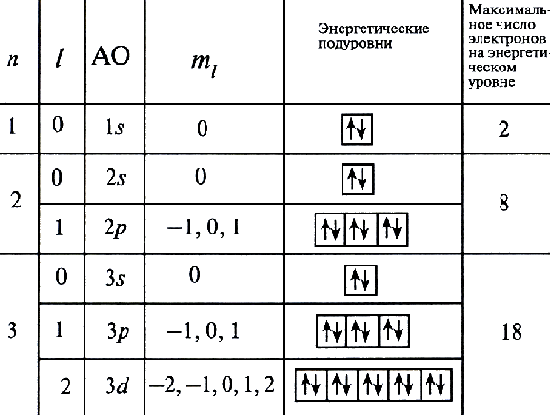
Электронная конфигурация (формула) атома - распределение электронов по орбиталям в основном (невозбужденном) состоянии этого атома и его ионов: 1s22s22p63s23p6... Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы, например 3d5 - это 5 электронов на 3d-подуровне.
Для краткости записи электронной конфигурации атома вместо орбиталей, полностью заселенных электронами, иногда записывают символ благородного газа, имеющего соответствующую электронную формулу:
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar]
Например, электронная формула атома хлора 1s22s22p63s23p5, или [Ne]3s23p5. За скобки вынесены валентные электроны, принимающие участие в образовании химических связей.
Для больших периодов (особенно шестого и седьмого) построение электронных конфигураций атомов имеет более сложных характер. Например, 4f-электрон появляется не в атоме лантана, а в атоме следующего за ним церия. Последовательное заполнение 4f-подуровня прерывается в атоме гадолиния, где имеется 5d-электрон.
40.
В 1916 г. Коссель предложил теорию, в которой связал распределение элементов по периодам с появлением новых электронных оболочек в структуре атома. Каждая оболочка содержит определенное максимальное число электронов. На основе некоторых, преимущественно электрохимических фактов, щелочным металлам был приписан один электрон на внешней оболочке, щелочноземельным металлам - 2 и т.д. Для благородных газов внешняя оболочка состояла из 2 (для гелия) и из S электронов (для других), обнаруживавшая, как показали свойства этих веществ. особую устойчивость.
Таким образом причина электроположительного и электроотрицательного характера элементов заключалась в их тенденции стремиться к состоянию атома благородного газа. Атом натрия, например, отдает электрон, превращаясь в катион с конфигурацией атома неона. Атом хлора принимает электрон, приобретая конфигурацию аргона, становясь анионом. Обе заряженные частицы дополняют друг друга и электростатически притягиваются. Сера, приняв 2 электрона, приобретает строение аргона, а отдав 6 - строение неона. Так было показано, что электростатическому соединению предшествует обмен электронами, который приводит не к электрической нейтрализации. а к электростатической стабилизации.
ТЕОРИЯ ЛЬЮИСА
В 1916 г. появилась статья Льюиса "Атом и молекула", в которой была последовательно развита идея о гомеополярной (ковалентной) связи Согласно Льюису, ковалентная связь образуется за счет пары обобществленных электронов, при этом каждый из партнеров достраивает свою электронную оболочку до наиболее устойчивой восьмиэлектронной конфигурации благородного газа. (Следует отметить, что ни Льюису, ни Косселю не было известно, почему восьмиэлектронная оболочка имеет особо устойчивую конфигурацию. Это была просто констатация экспериментального факта, который ждал своего объяснения).
Льюис в своей работе выдвинул следующие основные постулаты:
1. В каждом атоме есть некоторое ядро, которое остается неизменным при обычных химических процессах и обладает некоторым избытком зарядов, число которых отвечает номеру той группы, периодической таблицы, к которой относится элемент.
Атом состоит из ядра и внешней части, или оболочки, содержащей электроны, число которых в случае нейтрального атома равно избытку положительного заряда ядра: число электронов в оболочке может изменятся от 0 до 8 при изменении химической природы атома.
Атом имеет тенденцию содержать четное число электронов в оболочке; восемь электронов располагаются симметрично в восьми углах куба
Две атомные оболочки взаимно проницаемы
Электроны могут с легкостью переходить из одного положения в наружной оболочке к другому, тем не менее, они удерживаются в своем положении более или менее напряженными связями, и эти положения, а также прочность связей определяются природой данного атома и тех в, которые соединены с ним. "
Химическая символика связей у Льюиса в электронных формулах химических соединений совпадала с символикой Морозова.
Понятие о ковалентной химической связи раскрыто физическую сущность межуглеродных связей в молекулах веществ. Итак, по Льюису и Косселю. существует два типа связи: ковалентная (гомеополярная) и ионная (гетерополярная). Один тип связи может переходить в другой постепенно, сдвиг связевых электронов в сторону образования той или иной связи зависит от природы взаимодействующих атомов
