
- •Билет 1
- •Технический элементарный кремний: методы получения, основные свойства и применение. Получение и применение монокристаллов кремния высокой чистоты.
- •Билет 2
- •Кремнегалогены: классификация кремнегалогенов, методы синтеза простых и комплексных кремнегалогенов, их свойства и применение.
- •Билет 3
- •Билет 4
- •Соединения в системах кремний – азот и кремний – бор: состав, методы синтеза, свойства и применение.
- •Билет 5
- •Билет 6
- •Билет 7
- •Билет 8
- •Билет 9
- •Билет 10
- •Билет 11
- •Билет 12
- •Термодинамическая характеристика твердофазовых реакций: изменение энергии Гиббса и условия, при которых в процессе твердофазовой реакции возможно установление термодинамического равновесия.
- •Билет 13
- •2. Правило фаз Гиббса. Вид уравнения правила фаз для тугоплавких силикатных систем. Понятия: фаза, независимый компонент, степени свободы, вариантность системы, равновесное состояние.
- •Билет 14
- •Билет 15
- •Билет №18
- •Билет №19
- •Вопрос№2
- •Билет № 21
- •Последовательность химических превращений при твердофазовом взаимодействии
- •Билет №22
- •Спекание за счёт процесса испарение- конденсация.
- •Cпекание за счет пластической деформации под давлением/
- •Реакционное спекание
- •Правила определения характера этих точек, процессов, происходящих в них, и дальнейшего пути кристаллизации из точки двойного опускания.
- •Определение характера процесса, происходящего в точке двойного подъема:
- •Определение дальнейшего пути кристаллизации из точки двойного опускания.
- •Билет №23
- •Главный внутр. Фактор – характер и энергия кристалл. Решетки: с увеличением энергии решетки Тпл возрастает у однотипных в-в.
- •Билет №27
- •Диаграмма состояния по Бредигу. Схема превращений.
Определение дальнейшего пути кристаллизации из точки двойного опускания.
Если кристаллизация в точке двойного опускания не заканчивается, то в общем случае дальнейший путь кристаллизации при охлаждении системы может продолжиться по одной из двух пограничных кривых с падающей от точки температурой (соответствен но этому полностью исчезает одна из реагирующих с жидкостью твердых фаз). Дальнейший путь кристаллизации определяется следующим образом.
Сначала находят две соединительные прямые, соответствующие двум пограничным кривым с падающей от точки двойного опускания температурой. Затем соединяют прямой линией точку двойного опускания и точку состава исходного расплава и определяют, какую из двух указанных соединительных прямых пересекает продолжение этой прямой. Дальнейший путь кристаллизации пойдет по той пограничной кривой, которой соответствует именно эта соединительная прямая, т. е. по тон пограничной кривой, вдоль которой в равновесии находятся соединения, точки составов которых соединяет эта прямая.
Определите вариантность системы в этих точках и объясните, что это означает. Эти точки инвариантны, число фаз равно нулю. Это означает, что нельзя изменить ни один параметр в системе, чтобы не нарушить равновесия и числа фаз.
Билет №23
1). Кремневодороды. Силаны и силоксаны: способы получения, свойства и применение. Краткая характеристика моно- и дисилана.
Силаны: SinH2n+2
Например моносилан Si4H4, дисилан Si2H6.
В их структуре присутствуют всязь Si-Si.
Получение : силициды Si+кислота: Mg2Si+4 HCl= SiH4 +2MgCl2.
В зависимоти конц. И условий получают и дисиланы и др.
Моно и дисиланы-газы, остальные –жидкости.
Свойства:
- ядовиты
-с кислотами не взаимодействуют с кислотами, щелочи разлагают.
-очень чувствительны к воздуху, могут самовоспламеняться и взрываться.
Применение:
-в качестве восстановит.
-исходный продукт для получения кремнеорганики
2) Силоксаны
Присутствует связь H3-Si-O-Si-H3 Дисилоксан .
Получение: при взаимодействии частично замещённого силанов с водой.
2 SiH3Br+ H2O=( SiH3)2O+2HBr.
Дисилоксан – газ без запаха, не воспламеняется, но горит с образованием белого дыма.( SiO2)/
Применение: как и силаны.
2). Диаграмма состояния системы Si О2. Последовательность и скорость фазовых превращений при нагревании и охлаждении кремнезема в равновесных и неравновесных условиях. Характерные отклонения от равновесного состояния в системе SiО2 , их причина и использование для получения технических продуктов.
Кремнезем образует много полиморфных модификаций, из которых на диаграмме Феннера представлены только основные формы Si02встречающиеся в обычных условиях в природных и технических продуктах. Как видно из диаграммы, Si02 образует три главные модификации: кварц, тридимит и кристоба-лит, каждая из которых в свою очередь имеет несколько разновидностей— модификаций второго порядка; а- и β -кварц, α-, β - и γ-тридимит, а- и β-кристобалит .
Как видно из представленной схемы, все указанные на ней превращения являются энантиотропными. Превращения в преде лах каждой главной формы, т. е. β-кварц и а-кварц, у- тридимит мит = В-тридимит =а-тридимит и β-кристобалит = а-кристобалит (превращения в вертикальных рядах на схеме), относятся к поли морфным переходам со смещением во вторичной координационной сфере и происходят очень быстро. Это объясняется незначительны ми структурными изменениями при этих переходах ввиду сходства структур модификаций второго порядка (структуры модификаций второго порядка представляют собой несколько искаженные про изводные структур основных форм Si02). В противоположность этому превращения между .главными модификациями, т. е. α -кварц α -тридимит α-кристобалит (превращения в горизонтальном ряду на схеме) относятся к реконструктивным превращениям во вторичной координационной сфере и протекают при изменении температуры очень медленно, поскольку они связаны со значительной перестройкой структуры (превращения между главными модификациями значительно ускоряются в присутствии добавок— минерализаторов, например CaO, FeO и т. д.).
Последовательность фазовых изменений, осуществляемая в соответствии с диаграммой Феннера, относится только к равновесным условиям. Однако в реальных условиях в этой системе, как и во многих других силикатных системах, наблюдаются существенные отклонения от равновесных состояний. Можно указать на следующие характерные для системы Si02 отклонения.
1. Поскольку фазовые превращения между главными модификациями происходят очень медленно, при достаточно быстром нагревании более низкотемпературные, чем а-кристобалит, формы Si02 (кварц, тридимит) могут непосредственно перейти в расплав, минуя фазу кристобалита. Например, кварц можно расплавить, минуя фазы тридимита и кристобалита. Температура такого мета-стабильного плавления будет значительно ниже равновесной температуры плавления кристобалита. Указанная медленность превращений обусловливает также то, что а-кристобалит при ох лаждении превращается в метастабильный (3-кристобалит, а не в равновесную форму а-тридимита, а последний — в метастабильные β- и γ-тридимит, а не в σ-кварц.
2. Расплав Si02 очень легко переохлаждается, образуя кремнеземистое (кварцевое)* стекло, которое при температуре <1000°С практически не способно кристаллизоваться и может находиться в метастабильном состоянии неопределенно долгое время. Это отклонение от равновесного состояния объясняется высокой вязкостью расплава Si02 и кремнеземистого стекла, затрудняющей их переход в кристаллическое состояние. (
3. Из кварца при нагревании или из кварцевого стекла при охлаждении в качестве первичной фазы в широком интервале температур стремится выделиться кристобалит. Этот первично возникающий кристобалит называется метакристобалитом. Данный характер превращений соответствует правилу ступеней Оствальда, поскольку из всех кристаллических форм Si02 кристобалит в широком температурном интервале является наименее устойчивой формой Si02 (обладающей большей упругостью пара).
№24.1 Силициды. Состав, способы получения, св-ва и примен. силицидов Mg, Ca, Fe, Mo. Характеристика силицидов как фаз переменного состава.
Силицидами наз. бинарные соединения кремния в основном с более электроположительными элементами (металлами).
Способы получения:
1) Сплавление Si с металлом или взаимодействие паров Si с металлом
Me+Si=MeSi;
2) По р-ям восстановления: 2MeO+3Si=2MeSi+SiO2, MeO+SiO2+3C=MeSi+3CO;
3) По обменным р-ям: Me+SiCl4+2H2=MeSi+4HCl
Указанные р-ии обычно начинаются при высоких тем-рах (от 600 до 800ºС в зависимости от вида металла). В ряде случаев силициды получают методом горячего прессования при повышенных Т и Р.
Свойства силицидов. Большинство С.-высоко тугоплавкие соединения: Тпл (MoSi2)=2020ºС, Тпл (WSi2)=2160ºС, Тпл (TaSi2)=2200ºС (тантала). Силициды щелочных и щ/з металлов разлагаются водой и кислотами. Силициды других металлов стойки не только к воде, но и к большинству кислот (кроме плавиковой). Расплавы едких щелочей на воздухе довольно энергично разлагают силициды, образую силикаты.
Силициды Mg. Mg образует с Si единственное устойчивое при обычной Т соединение – дисилицид магния Mg2Si. Имеются данные, что при высокой Т устойчив силицид Mg – MgSi. Mg2Si используют для получения силанов; в технологии сплавов Mg и Al (он входит в состав дюралюминия, повышая его твердость).
Силициды Са. С кальцием Si образует силициды состава Са2Si, СаSi и СаSi2. Силициды Са применяют в качестве раскислителей в сталелитейной промышленности (прежде всего при произв. нержавеющей стали) и удаления из стали серы и фосфора.
Силициды Fe. Известны силициды состава: Fe 3Si, Fe 5Si3, Fe Si, Fe 2Si. Сплавы Si с Fe, носящие общее название ферросилиций, могут содержать различные кол-ва Si и Fe, не обязательно отвечающие приведенным формулам. Ферросилиций с содержанием Si=10-15 масс% получают в доменных печах, а с содержанием Si>40 масс% - в электропечах из железной стружки, кокса и кварца. Ферросилиций применяют в основном в произв. железа и стали. Он понижает способность железа растворять углерод и т. образом увеличивает выделение углерода в виде графита, что иногда необходимо при выработке чугуна. При бессемеровском процессе ферросилиций применяют как раскислитель для восстановления образующегося при горении оксида железа. Богатые кремнием сплавы железа находят широко применение благодаря их исключительно высокой кислотостойкости.
Силициды Mo. Si с Mo образует силициды состава MoSi3, Mo 5Si3, MoSi2. Наибольший интерес представляет MoSi2, получаемый горячим прессованием. Для него характерна стойкость к окислению не только на воздухе, но и в кислороде при высоких Т. Поэтому его используют как защитное покрытие против окисления по молибдену. Стержни из него используют в качестве нагревательных элементов в электропечах (позволяют получать в печи Т до 1700 ºС при работе в обычной атмосфере).
Хар-ка силицидов…Силициды многих металлов представляют собой фазы переменного состава, в которых валентности Si и металла не соответствуют тем, которые проявляются в обычных стехиометрических соединениях, что сближает их с твердыми растворами и сплавами металлов. Во многих силицидах большую роль играет непосредственная связь между атомами металлов и поэтому силициды являются наиболее металлическими соединениями среди металлоподобных тугоплавких соединений типа карбидов и нитридов. Исключение составляют некоторые силициды, проявляющие полупроводниковые св-ва. В большинстве случаев силициды имеют явно выраженный металлический характер.
№24.2.Динамический и статический методы построения ДС. Последовательность операций при реализации этих методов. Особенности экспериментального построения ДС силикатов.
Сущность динамического метода построения ДС состоит в построении методом термического анализа кривых охлаждения (или нагревания) образцов в координатах температура- время. Если фазовое превращение сопровождается тепловым эффектом (а практически все фазовые превращения сопровождаются изменением энтальпии системы), то это будет фиксироваться на указанных кривых в зависимости от характера равновесия (числа степеней свободы системы) в виде точки перегиба, отвечающей изменению скорости падения или увеличения температуры (моно-или дивариантное равновесие), или в виде горизонтальных площадок, отвечающих сохранению постоянной температуры образца (инвариантное равновесие).
Практически этот метод осуществляется следующим образом (рис.). Для построения, например, диаграммы состояния двухкомпонентной системы А—В термическому анализу подвергаются чистые компоненты А и В и смеси с различным их содержанием (например, составы 1, 2, 3 и т. д.). Для получения кривых охлаждения исследуемые образцы нагревают в печи до полного расплавления, выдерживают при этой температуре для гомогенизации расплава и затем охлаждают, фиксируя температуру образцов. На кривых (А и В) охлаждения чистых компонентов при температурах ТА и Тв появятся горизонтальные площадки, т. е. зафиксируется остановка в падении температуры, соответствующая температуре кристаллизации соответствующего компонента, которая для индивидуальных химических соединений происходит при постоянной температуре (постоянная температура образца при охлаждении поддерживается за счет выделения скрытой теплоты кристаллизации). Такая же остановка на всех кривых охлаждения смесей компонентов А и В появится при эвтектической температуре Те, которой также соответствует инвариантное состояние системы (кривая 2 точно соответствует эвтектическому составу, на кривой охлаждения которого кроме горизонтальной площадки при эвтектической температуре никаких других остановок или перегибов не будет). На кривых охлаждения смесей 1 и 3 при температурах t1 и t3 появится перегиб, т. е. зафиксируется изменение скорости падения температуры, что обусловлено началом кристаллизации компонентов А или В, в ходе которой выделяется теплота кристаллизации. Пересечение горизонталей найденных температур фазовых превращений с вертикалями составов даст точки, принадлежащие кривым ликвидуса. В более сложных системах на кривых охлаждения могут появиться не один, а несколько перегибов или площадок, отвечающих кристаллизации различных твердых фаз или каким-либо другим процессам в системе, кроме плавления или кристаллизации. Эвтектическому составу (2 на рис.) будет соответствовать максимальная по времени остановка температуры, т. е. максимальная длина горизонтальной площадки на кривой охлаждения при эвтектической Т. Откладывая на ДС длины указанных площадок для различных составов в виде перпендикуляров, проведенных к горизонтали эвтектической температуры, можно построить треугольник (cde), высота которого (Ее) определит эвтектический состав.
Этот метод дает искаженные результаты для систем с высокой вязкостью из-за их склонности к переохлаждению. Построение по кривым нагревания дает более достоверные результаты.
Статический метод построения ДС. Принцип метода заключается в фиксации равновесных при данной температуре фаз в системе и последующего определения их состава и содержания в системе. Метод состоит из следующих операций.
Сначала изготовляют смеси компонентов исследуемой системы различного состава. Для лучшей гомогенизации каждую смесь многократно сплавляют или спекают с промежуточным и конечным измельчением в тонкий порошок. Описанная операция называется отжигом. Вторая операция называется закалкой. Образец после выдержки при заданной температуре резко охлаждается. Это достигается сбрасыванием образца из печи в холодную инертную жидкость с хорошей теплопроводностью (например, в воду, ртуть). При резком охлаждении происходит фиксация того состояния, в котором образец находился при температуре выдержки, т. е. кристаллические фазы, если они есть, фиксируются («замораживаются») в таком виде и количестве, в каком они находились при температуре выдержки, а жидкая фаза застывает в стеклообразном состоянии. Третьей операцией является определение состава и содержания фаз в закаленном образце с помощью методов микроскопического, рентгенографического анализов или другими методами.
Каждая смесь подвергается закалке от различных температур. Если, например, в смеси состава 1 (рис.), закаленной от температур t1 и t2, обнаружена только стекловидная фаза, то это означает, что кристаллизация расплава при температуре выдержки еще не началась и эта температура лежит выше температуры ликвидуса. Тогда выдерживают эту же смесь при более низкой температуре, например t4. Если в закаленном при этой температуре образце обнаружено большое содержание кристаллической фазы, значит указанная температура лежит ниже температуры ликвидуса. Повторяя аналогичные определения несколько раз и постепенно сужая интервал между температурами t2 и t4, находят ту температуру (t3), которой соответствует появление в образце первых кристаллов твердой фазы. Эта температура будет соответствовать точке а
Метод закалки является чрезвычайно трудоемким. Дело осложняется, если в системе при изменении ее параметров имеют место не только процессы плавления и кристаллизации, но и другие процессы, например полиморфные превращения, образование твердых растворов, образование или распад химических соединений и т. д.
Несмотря на это, статический метод является основным и наиболее точным экспериментальным методом построения ДС силикатных систем. Уменьшить трудоемкость метода позволяет использование высокотемпературной микроскопии и высокотемпературного рентгеновского анализа, позволяющих определять состав и содержание фаз в образце непосредственно при высокой температуре.
Особенности эксперим. построения. Построение реальных ДС сводится к определению опытным путем температур фазовых превращений, характера и состава фаз, находящихся в данной системе в равновесии при различных температурах. Эти исследования производятся различными методами химического и физико-химического анализа — термическим, микроскопическим, электронно-микроскопическим, рентгенографическим, электронографическим, локальным рентгеноспектральным и другими методами анализа. Иногда используют также дилатометрические исследования, изучение электросопротивления, твердости и других свойств материалов. Правильность построения ДС на основе экспериментальных данных контролируется правилом фаз и так называемыми принципами непрерывности и соответствия, сформулированными Н. С. Курнаковым, которым диаграмма не должна противоречить. Принцип непрерывности заключается в том, что при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз и системы в целом изменяются также непрерывно, но при условии, что не изменяется фазовый состав системы, т. е. не возникают новые и не исчезают старые фазы. Принцип соответствия заключается в том, что каждой фазе или совокупности фаз системы, находящейся в равновесии, соответствует на диаграмме определенный геометрический образ — точка, линия, область. Наиболее распространенные экспериментальные методы – динамический и статический.
№25.1.Кремнийорганические соединения. Классификация. Алкилсиланы, алкоксисиланы и силиконы: состав, способы получения, св-ва и применение.
Кремнийорганическими соединениями наз. такие соед, кот. содержат в своем составе одновременно Si и органические радикалы и группы (могут входить и другие элементы). Si-орг. соединения можно разделить на 2 группы: низкомолекулярные и высокомолекулярные.
Низкомолек. Si-орг. соединения- могут быть представлены как производные силанов SinH2n+2, образующиеся путем замещения атомов водорода органическими радикалами и группами(СН3-, С2Н5-, С6Н5-, СН3О-, С2Н5О-). Название строится по след. принципу: если один атом Si в соединении, то указывается число и название радикалов и групп, замещающих атомы водорода, затем – название исходного силана. (С2Н5 )2 SiН2 – диэтилсилан, (С6Н5)3 SiН- трифенилсилан. Если соединение содержит > одного атома Si, то эти атомы нумеруются слева направо и в названии цифрами по порядковой нумерации указывается место атомов Si, в которых произошло замещение водорода. В остальном название строится также как с одним атомом Si.
Алкилсиланы.(органозамещенные силаны).представляют собой соединения, в кот. с Si связаны органические (алкильные) радикалы R. Синтезированы одно-, двух-, трех- и четырехзамещенные силаны - H3SiR, H2SiR2, HSiR3 , SiR4 (известны некоторые соединения типа Si2R6). Органические радикалы R могут быть алифатические и ароматические. Атом Si может быть связан с радикалами того и другого рода одновременно.
Алкилсиланы
обычно получают
при взаимодействии кремнегалогенов с
металлоорганическими соединениями
магния, цинка и др. металлов:
![]() (
R=
СН3,
С2Н5
и тд). По аналогичным р-ям могут быть
также получены алкилгалогенсиланы –
соединения типа RSiН2
Cl,
RSiCl3
и
тд., содержащие в своем составе органическую
группу, Si
и галоген.
(
R=
СН3,
С2Н5
и тд). По аналогичным р-ям могут быть
также получены алкилгалогенсиланы –
соединения типа RSiН2
Cl,
RSiCl3
и
тд., содержащие в своем составе органическую
группу, Si
и галоген.
Св-ва. В отличие от кремневодородов алкилсиланы относительно устойчивы: они не воспламеняются на воздухе, не разлагаются водой и не растворяются в ней. В парообразном состоянии в присутствии кислорода и при воздействии пламени они взрываются, образуя SiО2. Чисто алифатические соединения Si представляют собой легко растворимые в органических растворителях жидкости, а чисто ароматические соединения при обычной Т явл. твердыми в-ми и в большинстве случаев хорошо кристаллизуются. Алкоксисиланы (эфиры ортокремниевой кислоты). Эти соединения типа Si(ОR)4 можно рассматривать как производные силана, в котором атомы водорода замещены на оксигруппы (ОR)- , или как производные ортокремниевой к-ты Н4SiО4 , в которой атомы атомы водорода замещены на органические радикалы R. Эфиры ортокремниевой к-ты получают при взаимодействии спиртов и фенолов с кремнегалогенами, например этиловый эфир ортокремниевой к-ты: SiCl4+4C2H5OH=Si(OC2H5)4+4HCl
Характерной особенностью эфиров явл. их способность к гидролизу в воде, а продуктов гидролиза – к конденсации. Эфиры ортокремниевой и поликремниевой к-т применяют в качестве связующих веществ в керам. пром., при изготовлении специальных лаков, для получения особо дисперсного силикагеля. Некоторые аминопроизводные Силанов вследствие их водоотталкивающего действия применяют для пропитки тканей, бумаги, керамических изделий и асфальта, при строительстве дорог.
Наибольшее техническое значение имеют высокомолекулярные Si-орг. соединения – силиконы.Их важнейшими представителями явл. полиоргансилоксаны (силиконы). Силиконы представляют собой Si-орг. соединения, которые содержат различное число групп -Si- , связанных между собой через атомы кислорода. Их можно рассматривать как производные полимерных кремневодородов типа (SiН2 )х, которые образуются путем замещения атомов водорода на органические группы и замешения связей -Si-Si- на связи -Si-О-Si- (силоксанная связь).Названия силиконов с небольшим числом атомов кремния строятся также как и низкомолекулярные, но завершаются обозначением числа атомов Si, связанных через кислород (ди-, три-, тетра- и тд) и словом силоксан.
Силиконы
получают
при гидролизе мономеров, в частности,
алкилгалогенсиланов, эфиров ортокремниевой
к-ты и тд. Простейший силикон-
гексаметилдисилоксан- можно получить:
![]()
Если исходить из соединения типа SiR2Х2 (R=алкил, Х=галоген), то образуются в-ва, содержащие большее число атомов Si. Реакции гидролиза при получении силиконов обычно протекают в несколько стадий. При этом промежуточной стадией явл. образование силиколей – производных галогенсиланов, в которых атомы галогена замешены на гр. ОН. Гидролиз алкилгалогенов протекает довольно быстро и сопровождается конденсацией образующихся продуктов, что приводит к образованию высокомолекулярных полимеров, содержащих различное кол-во атомов Si. Конденсация происходит при избытке воды, нагревании или при введении спец. катализаторов конденсации. На практике при получении силиконов сначала синтезируют алкилгалогенсиланы из SiСl4, тетраэтилового эфира ортокремниевой к-ты или из элементарного Si. Затем эти соедиения гидролизуют для получения силиколей. При соответствующей обработке (н-р,при нагревании) силиколи конденсируются с образованием силиконов. При этом можно регулировать длину цепей в получаемом силиконе.
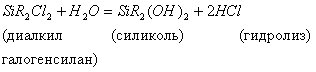
![]()
Св-ва. В зависимости от степени полимеризации силиконы могут иметь различное агрегатное состояние. Силиконы с небольшим количеством атомов Si в цепи(или чаще в кольце) явл прозрачными легко подвижными жидкостями. Силиконы с большим кол-вом атомов Si содержат длинные разветвленные или не разветвленные (в завис от способа получения) цепи. В зав. от длины цепей силиконы могут быть маслянистыми жидкостями или пастообразными в-ми, или представлять собой каучукоподобные материалы. некоторые силиконы имеют высокую эластичность (силиконовые каучуки), причем они сохраняют это св-во даже при относительно низких Т(до -65ºС). При некоторых условиях в структуре силиконов вместо цепей могут образовываться пространственные сетки, аналогичные тем, которые имеются в силикатах с пространственной структурой. Такие трехмерные сетки существуют в искусственных силиконовых смолах. В химическом и термическом отношении силиконы представляют собой довольно устойчивые соединения и поэтому многие из них применяют в качестве химически и термически стойких материалов (силиконовая резина). Особенно широкое применение силиконы находят в качестве электроизоляционных материалов. Применение силиконовых смол для электроизоляции электрических машин позволяет длительно эксплуатировать их при нагреве до 200 ºС. Силиконы также применяют для получения прозрачных влагозащитных покрытий. Некоторые силиконы явл превосходным смазочным материалом, вязкость которого мало изменяется при изменении Т(смазочные масла работают от -50до +200 ºС). Из силиконовых смол изготавливают стеклотекстолит – слоистый пластик, армированный стеклотканью; их также используют для пропитки строительных р-ров и бетонов на основе цемента, что существенно повышает атмосферостойкость и долговечность этих материалов.
№25.2. Диаграмма состояния CaO-SiO2 .Хар-ка бинарных соединений в этой системе – мета- и ортосиликат Са, трехкальциевый силикат.
В системе СаО—SiO2 существуют следующие бинарные соединения: однокальциевый силикат (метасиликат кальция) CaO-SiО2 или CaSiO3; трехкальциевый дисиликат 3CaO-2SiO2 или Ca3Si2О7; двухкальциевый силикат (ортосиликат кальция) 2CaO-SiO2 или Ca2Si04; трехкальциевый силикат 3CaO-SiO2 или Ca3Si05.
Метасиликат кальция CaO-SiO2 имеет две полиморфные модификации: низкотемпературную форму β-CaO-SiO2 (волластонит), устойчивую до температуры 1125°С, выше которой она переходит в высокотемпературную форму α-CaO-SiO2 (псевдоволластонит), плавящуюся конгруэнтно при 1544°С.
Трехкальциевый дисиликат 3CaO-2SiO2 плавится инконгруэнтно при 1464°С, разлагаясь на жидкость и кристаллы α -2CaO-SiO2. Имеются данные о существовании двух полиморфных модификаций 3CaO-2SiO2 - ранкинита и низкотемпературной разновидности - килхоанита (на диаграмме не отмечены).
Трехкальциевый силикат 3CaO-SiO2. Это соединение имеет область стабильного существования от 1250 до 2070°С. Ниже температуры 1250°С оно не стабильно и разлагается в твердом состоянии на a'-2CaO-SiO2 и СаО, а при 2070°С плавится инконгруэнтно на жидкость состава: 73,6% (мас.) СаО и 26,4% (мас.) SiO2 и кристаллы СаО. Трехкальциевый силикат имеет шесть мало отличающихся друг от друга по своей структуре полиморфных разновидностей, переходы между которыми относятся к полиморфным превращениям со смещением, связанным с изменениями во вторичной координационной сфере.
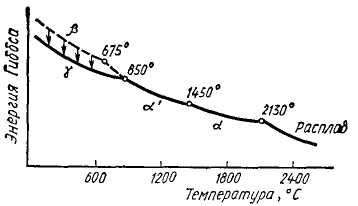
![]() Двухкальциевый
силикат 2CaO-SiO2
-
конгруэнтно плавящееся при 2130 °С
соединение, обладающее сложным и до
конца не изученным полиморфизмом.
Диаграмма
состояния
однокомпонентной системы 2CaO-SiO2
по
Бредигу,
в соответствии с которой ортосиликат
кальция существует в четырех полиморфных
формах: α , α/,
β
и γ.
Три
из них энантиотропные, т. е. имеют
температурные области стабильного
существования: низкотемпературная
γ -форма (до 850°С), α '-форма (850-1450°С) и
высокотемпературная α -форма
(1450-213О°С). Четвертая β
-форма при обычном давлении не имеет
температурной области стабильного
существования, т. е. является метастабильной
(ниже 675 °С) и монотропной по отношению
к γ -форме. Характер полиморфных
превращений в чистых препаратах 2CaO-SiO2
см на схеме:
при охлаждении α '-форма сначала переходит
в метастабильную β-форму,
а последняя в устойчивую при низкой
температуре
γ
-форму. Переход β→
γ сопровождается значительным уменьшением
плотности и увеличением удельного
объема (на ~13%), что приводит к саморассыпанию
спеченных препаратов 2CaO-SiO2
.
Предотвратить переход можно за счет:
1)термической стабилизации (заключ. в
резком охлаждении образцов, при котором
β
не успевает перейти в γ) Малоэффективно;2)
физическая стаб.(смысл в образовании
стекловидной оболочки вокруг С2S
при охлаждении системы, содержащей
жидкую фазу. Прочная оболочка не позволяет
расшириться материалу, капсулируя
β-форму;
3)кристаллохимическая (введение добавок
(В2О3,оксиды
щелочных, переходных металлов), которые
в структуре С2S
образуют тв. р-ры и не дают структуре
изменяться. Самая эффективная стабилизация.
Двухкальциевый
силикат 2CaO-SiO2
-
конгруэнтно плавящееся при 2130 °С
соединение, обладающее сложным и до
конца не изученным полиморфизмом.
Диаграмма
состояния
однокомпонентной системы 2CaO-SiO2
по
Бредигу,
в соответствии с которой ортосиликат
кальция существует в четырех полиморфных
формах: α , α/,
β
и γ.
Три
из них энантиотропные, т. е. имеют
температурные области стабильного
существования: низкотемпературная
γ -форма (до 850°С), α '-форма (850-1450°С) и
высокотемпературная α -форма
(1450-213О°С). Четвертая β
-форма при обычном давлении не имеет
температурной области стабильного
существования, т. е. является метастабильной
(ниже 675 °С) и монотропной по отношению
к γ -форме. Характер полиморфных
превращений в чистых препаратах 2CaO-SiO2
см на схеме:
при охлаждении α '-форма сначала переходит
в метастабильную β-форму,
а последняя в устойчивую при низкой
температуре
γ
-форму. Переход β→
γ сопровождается значительным уменьшением
плотности и увеличением удельного
объема (на ~13%), что приводит к саморассыпанию
спеченных препаратов 2CaO-SiO2
.
Предотвратить переход можно за счет:
1)термической стабилизации (заключ. в
резком охлаждении образцов, при котором
β
не успевает перейти в γ) Малоэффективно;2)
физическая стаб.(смысл в образовании
стекловидной оболочки вокруг С2S
при охлаждении системы, содержащей
жидкую фазу. Прочная оболочка не позволяет
расшириться материалу, капсулируя
β-форму;
3)кристаллохимическая (введение добавок
(В2О3,оксиды
щелочных, переходных металлов), которые
в структуре С2S
образуют тв. р-ры и не дают структуре
изменяться. Самая эффективная стабилизация.
Применение и св-ва. Значение системы CaO—SiO2 определяется тем, что существующие в ней соединения являются важной составной частью многих технических продуктов — цементов, доломитовых и других огнеупоров, некоторых видов керамики, шлаков черной металлургии и т. д. 3CaO-SiO2 в виде минерала алита представляет собой главный минерал портландцемента, обеспечивает все глвные св-ва цемента; в состав портландцемента входит также β-форма 2CaO-SiO2 в виде минерала белита; β-CaO-SiO2 – основа волластонитовой керамики (высокая стойкость, хор. диэлектрич. св-ва); 3CaO-2SiO2 большого значения не имеет.
№26.1. Процесс плавления. Структурные изменения в процессе плавления крист. в-в.. Т плавления и факторы, влияющие на нее. Зависимость между Т пл, структурой и энергией крист. решетки. Конгруэнтное и инконгруэнтное плавление. Тугоплавкие в-ва. Плавление стекол, отличие от плавления кристаллов.
Плавление - процесс перехода вещества из твердого состояния в жидкое, совершающийся под действием температуры. Плавление кристаллических веществ является фазовым превращением, обусловленным скачкообразным изменением их внутреннего строения и связанных с ним физико-химических свойств.
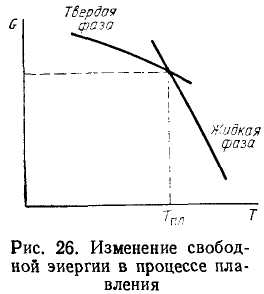 Условием
равновесия между твердой и жидкой фазами
должно быть равенство GTB=Gж.
Графически
такое состояние иллюстрирует рис.
26, из которого видно, что при температуре
плавления кривые свободной энергии
твердой и жидкой фаз пересекаются. Выше
температуры плавления устойчиво жидкое
состояние, ниже ее — твердое.
Условием
равновесия между твердой и жидкой фазами
должно быть равенство GTB=Gж.
Графически
такое состояние иллюстрирует рис.
26, из которого видно, что при температуре
плавления кривые свободной энергии
твердой и жидкой фаз пересекаются. Выше
температуры плавления устойчиво жидкое
состояние, ниже ее — твердое.
Плавление — эндотермический процесс, его характеризуют скрытой теплотой плавления, т. е. количеством теплоты, которое необходимо сообщить веществу, нагретому до температуры плавления, чтобы его расплавить. Эта теплота расходуется на преодоление сил взаимодействия атомов кристаллической решетки и характеризует разницу в энергии взаимодействия между частицами в твердом и жидком состояниях.
Температура плавления – равновесная Т, при которой энергии Гиббса твердого тела и жидкости совпадают.
Структурные изменения.
Плавлению в-ва предшествует период структурной подготовки – предплавление. Оно связано с процессом накопления вакансий в материале.
Появление вакансии приводит к необходимости перераспределения сил химической связи между оставшимися ионами, что является причиной возникновения сил отталкивания между катионами и анионами в соответствующих координационных сферах. Это вызывает дополнительное увеличение термического расширения кристалла вблизи температуры плавления, благодаря чему число слабых связей в решетке возрастает и кристалл становится все менее и менее твердым. Из-за склонности вакансий к флуктуационному слиянию при их скоплении образуются поверхности разрыва, отделяющие друг от друга отдельные атомные группировки — микроблоки. Это приводит к тому, что в момент плавления кристалла в расплав переходят не отдельные атомы, а их группировки. Этот процесс разделения структуры на микроблоки с последующим их переходом в расплав наз. процессом кооперативного позиционного разупорядочивания.
Факторы, влияющие на Тпл- внутренние и внешние.
