
Лекция 4
Антитела.
Антитела – это иммунные белки, образующиеся в организме в ответ на поступление антигена и обладающие способностью специфически взаимодействовать с ним. В физико-химическом отношении антитела представляют собой гаммаглобулины (гликопротеиновые молекулы.
Суммарное содержание иммуноглобулинов в сыворотке крови составляет около 2,5% сухого остатка, т.е. более 1/3 всех белков крови.
Антитела (иммуноглобулины) вырабатываются В-лимфо-цитами (плазмоцитами) в лимфоидных органах и местах скопления лимфоидной ткани, циркулируют в крови и жидкостях организма (лимфе, тканевой жидкости), а также содержатся в различных секретах организма (материнском молоке, слезе, слюне и др.).
Строение иммуноглобулинов.
Все иммуноглобулины человека построены однотипно и состоят из двух идентичных тяжелых полипептидных цепей (Н-цепей, Heavy chains) и двух идентичных легких полипептидных цепей (L-цепей, Light chains), которые связаны между собой посредством ковалентных дисульфидных мостиков (-S-S-) (Рис. 5-1.).
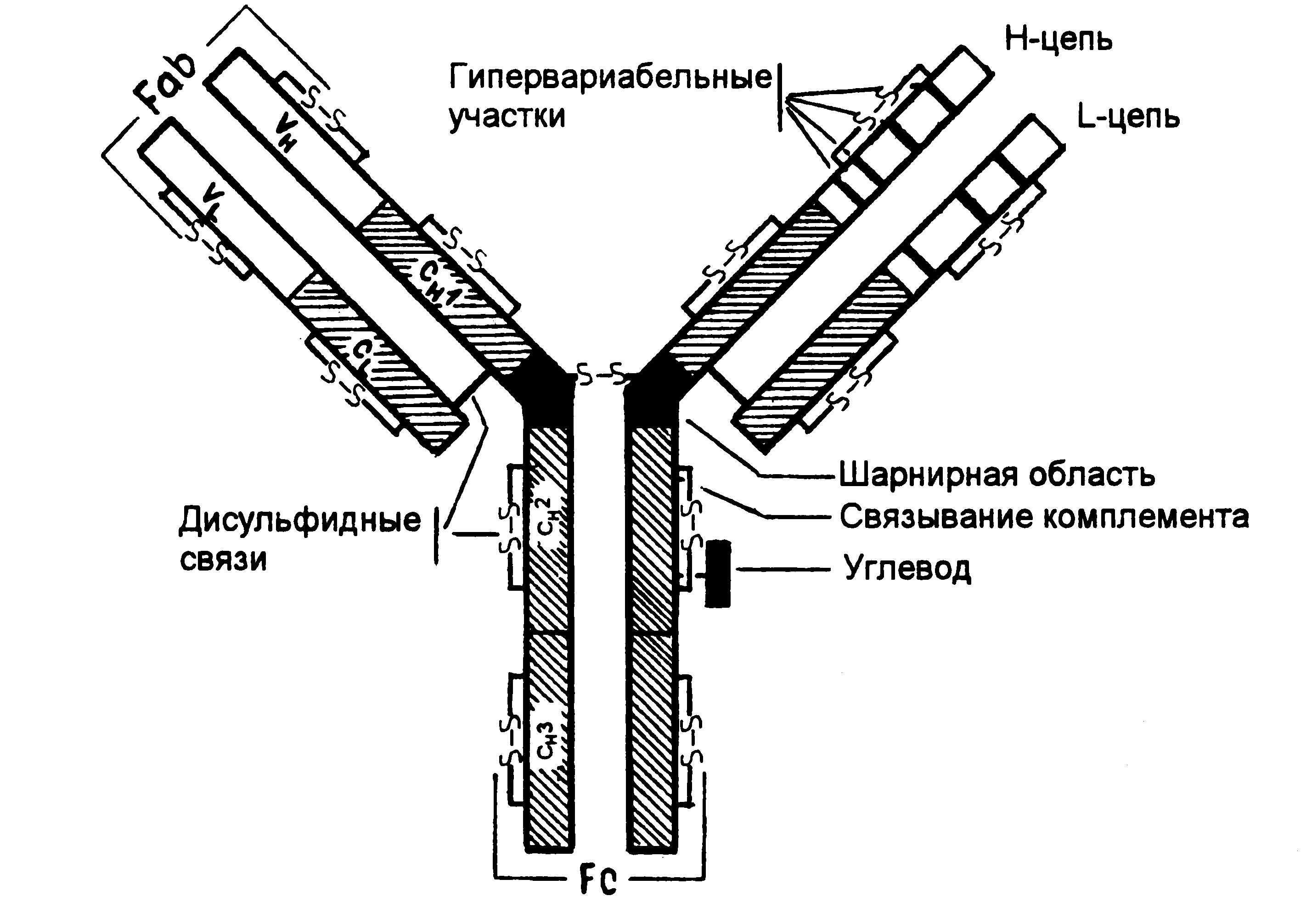
Р и с. 5-1. Структура IgG.
Молекулярная масса Н-цепи – 50 000 - 70 000, L-цепи – 20000-25000.
Существует 5 типов Н-цепей, которые получили название (гамма), (альфа), (мю), (эпсилон), (дельта) и два типа L-цепей (каппа) и (лямбда).
Н-цепи, независимо от класса иммуноглобулинов, могут быть связаны либо с каппа-, либо с лямбда-типом L-цепи. В соответствии с типом Н-цепи (, , , , ), существует пять классов иммуноглобулинов: Ig G, Ig M, Ig A, Ig D, Ig E. Каждый класс иммуноглобулинов обладает особыми свойствами и биологической активностью.
Каждая полипептидная L- и Н-цепь состоит из вариабельной области (V-области, VL и VH) и константной области (С-области, CL и СH) (Рис. 5-1).У каждой легкой цепи имеется одна V-область и одна С-область. У каждой тяжелой цепи имеется одна V-область и 3 или 4 гомологичные константные области. IgG, IgD, IgA имеют три константные области, Ig М, Ig E – 4 константные области.
Легкая цепь иммуноглобулинов образована 214 аминокислотными остатками. Первые 107 аминокислотных остатков формируют V-область, вторые 107 аминокислотных остатков (108-214) формируют С-область легкой цепи.
Тяжелая цепь IgG, IgD, IgA состоит из 450 аминокислотных остатков. V-область этих иммуноглобулинов образована 116 аминокислотными остатками, С-область включает около 334 аминокислотных остатков, ее гомологичные участки СН1, СН2, СНЗ состоят примерно из 100-110 аминокислотных остатков.
Работы Портера, Ниссонова (1959-1963) выявили в молекуле иммуноглобулина несколько функционально активных сегментов (Рис. 5-3.). Так, обработка IgG папаином выявила, что антитело состоит из трех функциональных фрагментов: двух Fab-фрагментов (Fragment antigen binding) и одного Fc-фрагмента (Fragment crystalline). Fab-фрагмент имеет молекулярную массу 50 000, структурно и функционально моновалентен, способен связывать антиген. Fc-фрагмент имеет мол. массу 60 000, состоит из двух Н-цепей (С2, СЗ доменов), связанных между собой дисульфидными связями. Fc-фрагмент обладает способностью связывать комплемент, а также взаимодействовать с иммунокомпетентными клетками, связывая с ними антитела. При расщеплении молекулы иммуноглобулина пепсином образуется 2 функциональных фрагмента: F(ab)2-фрагмент и pFc1-фрагмент. F(аb)2-фрагмент состоит из двух Fab-фрагментов связанных между собой дисульфидными мостиками. F(аb)2-фрагмент имеет молекулярную массу 100 000, двухвалентен, обладает во многом свойствами антитела (способен взаимодействовать с антигеном и преципитировать его); pFc1-фрагмент представляет собой С-концевую область Fc-фрагмента, состоит из С-концевых областей двух Н-цепей, которые соединены между собой нековалентными связями.
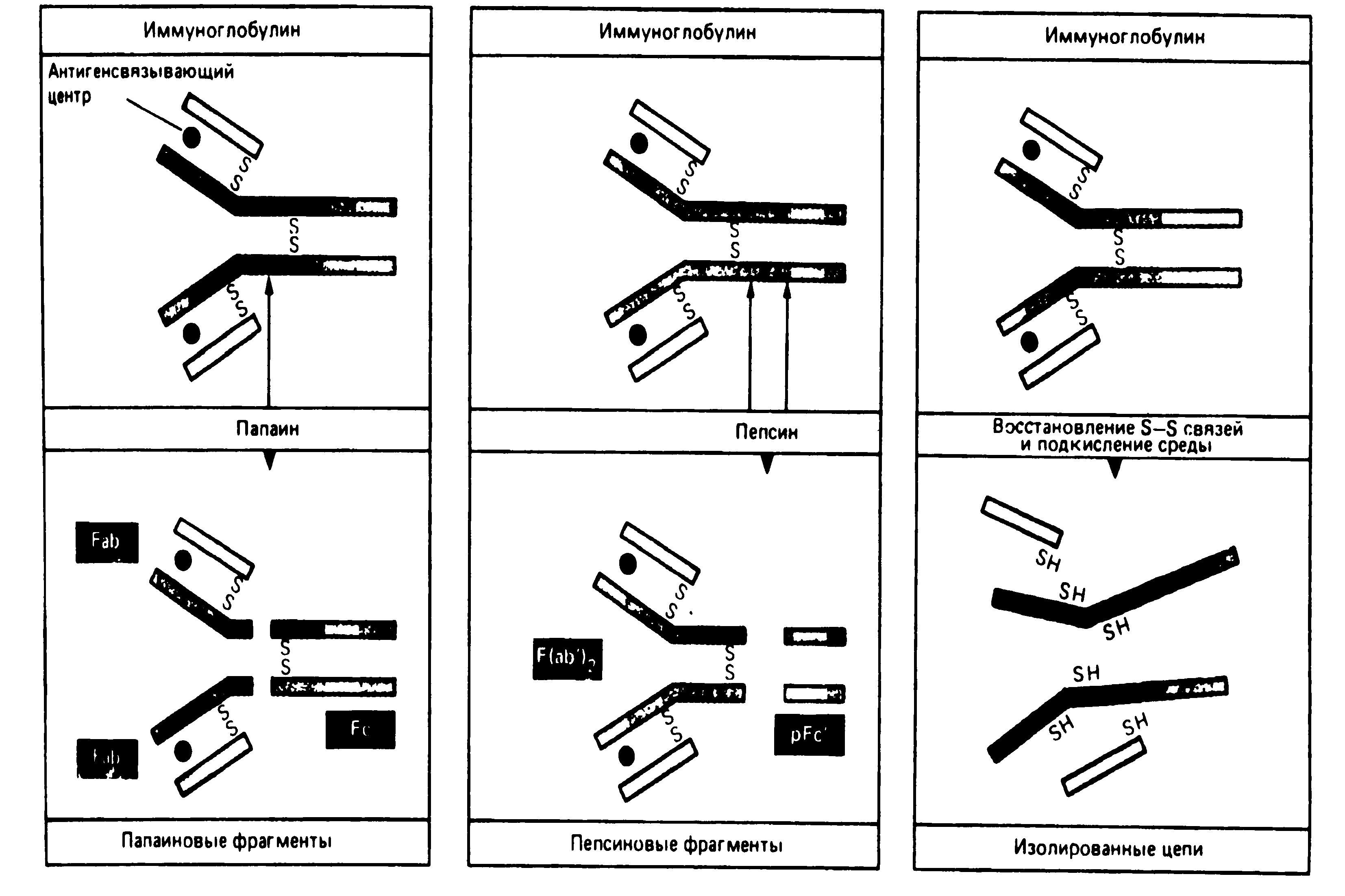
Р и с. 5-3. Расщепление молекулы иммуноглобулина на отдельные пептидные цепи и протеолитические фрагменты.
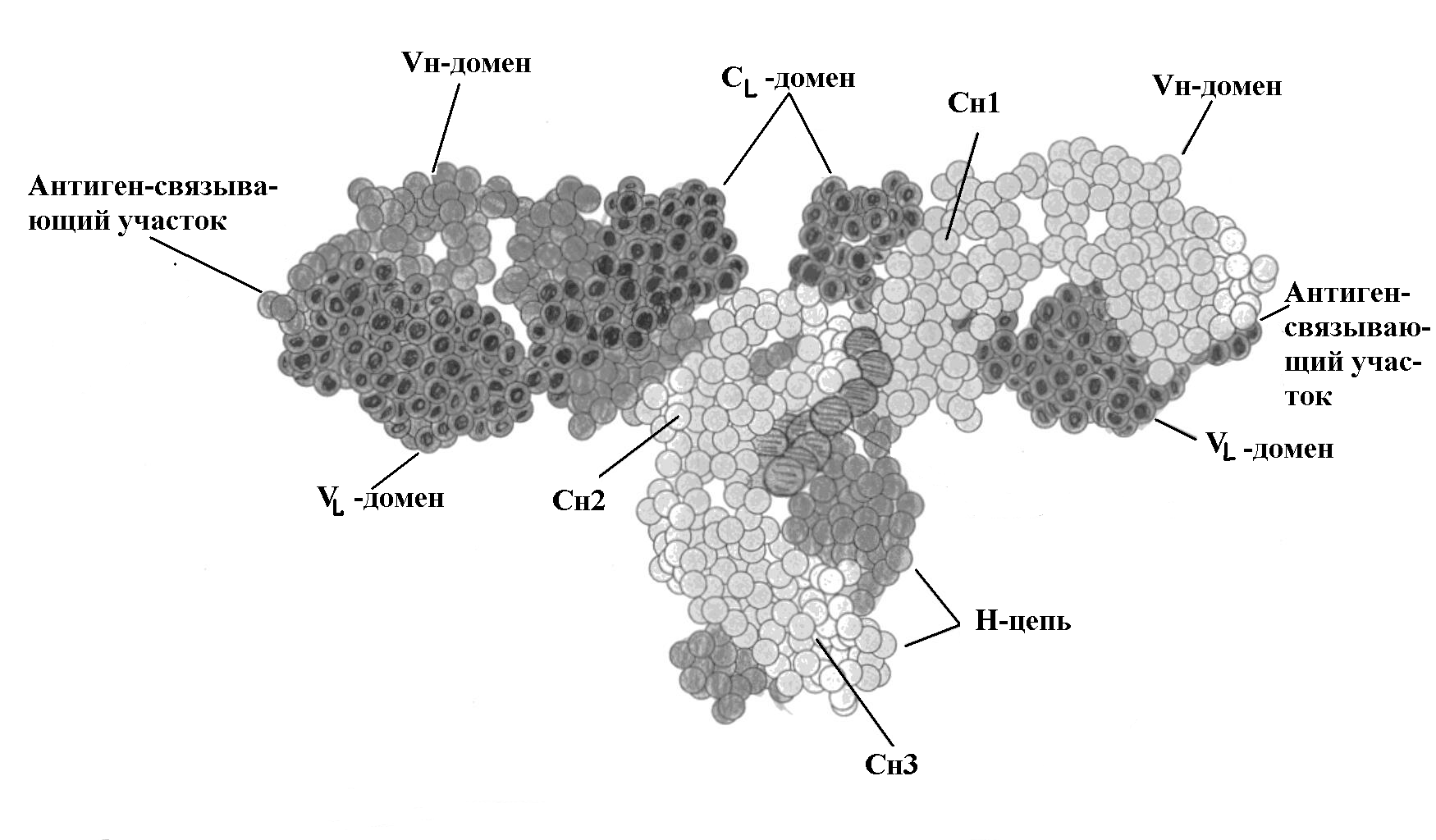
Р и с. 5-4. Трехмерная структура IgG человека.
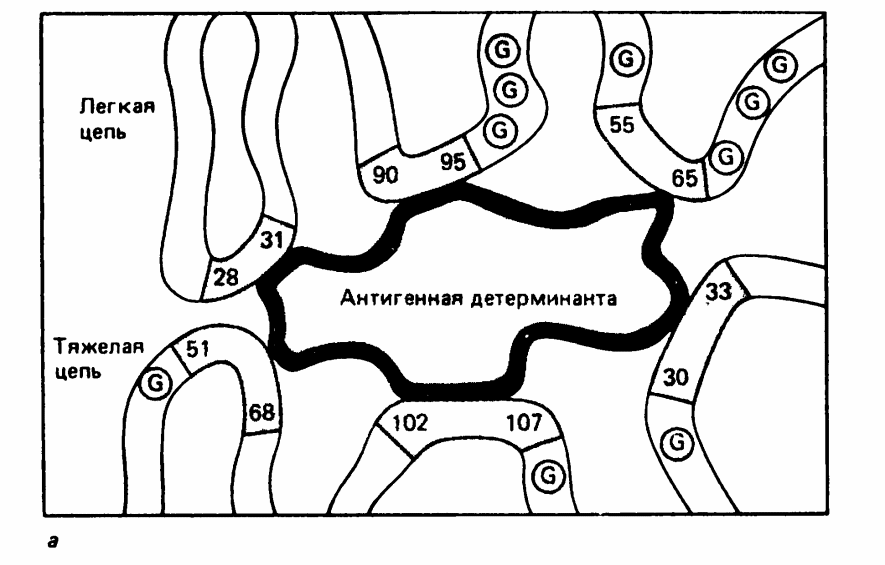
Р и с. 5-5. Упрощенное двухмерное изображение антигенсвязывающего центра.
Активный центр антитела. Важным свойством антитела является способность распознавать и специфически взаимодействовать с антигеном. Активный центр антитела образован V-доменами Н- и L-цепей. (Рис. 5-3; 5-5). Изучение активного центра антитела показало, что он может быть образован 4-8 аминокислотными остатками гипервариабельных областей V-доменов Н- и L-цепей (Рис. 5-5.).
Большинство антител имеет два и более активных центра. Такие антитела называются полными.
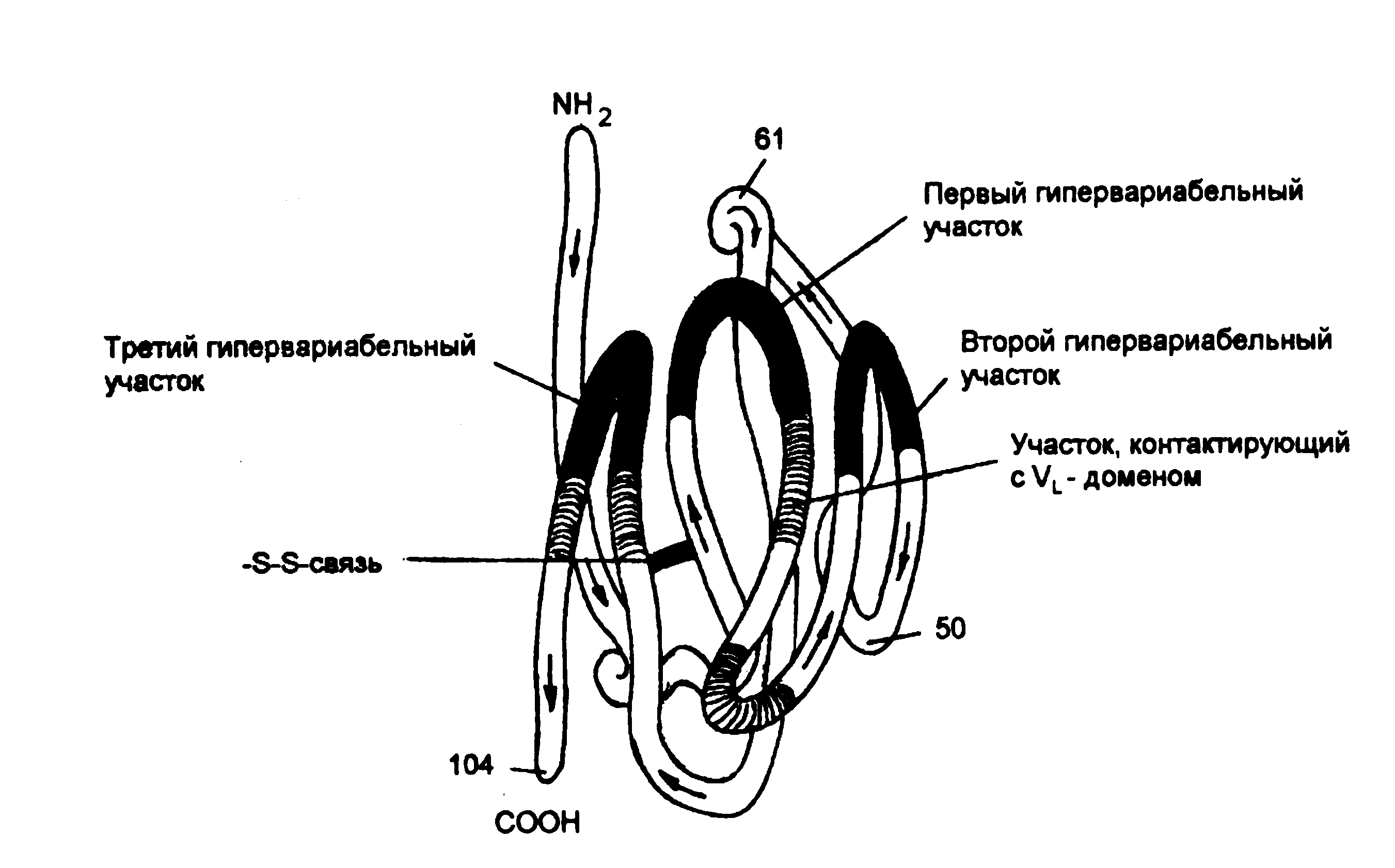
Р и с. 5-6. Пространственное объединение гипервариабелъных участков V-доменов тяжелой цепи IgG человека
Способность антитела связывать определенное количество антигенных детерминант определяется понятием валентность. Валентность антитела, как правило соответствует числу активных центров AT. Молекула иммуноглобулина, связывающая две антигенные детерминанты – двухвалентна, молекула иммуноглобулина, связывающая 5 антигенных детерминант – пятивалентна. Часть иммуноглобулинов имеют один активный центр и способны связывать одну антигенную детерминанту. Такие моновалентные антитела называются неполными антителами
Р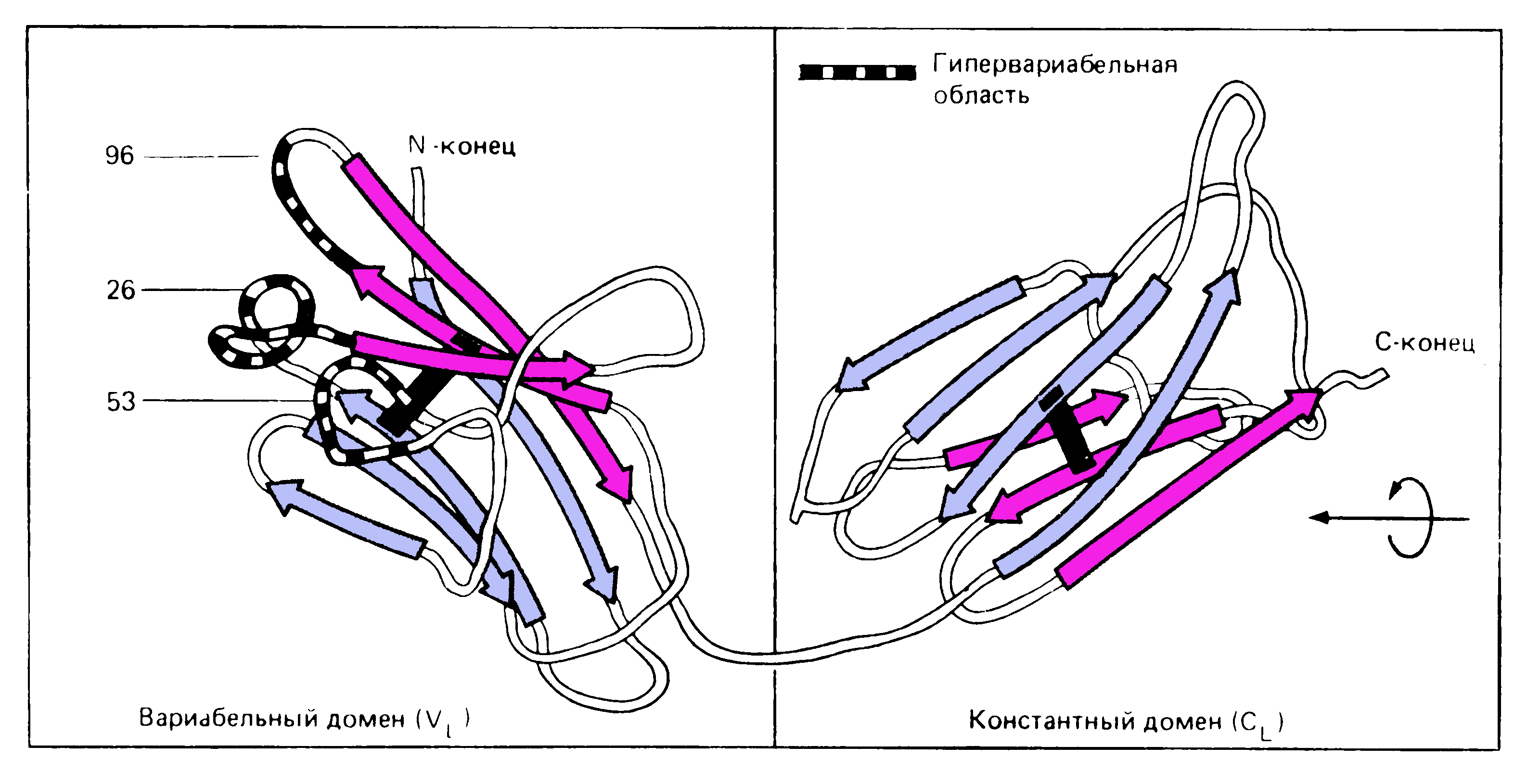 и
с. 5-7. Структура глобулярных доменов
легкой цепи по данным рентген-структурного
анализа.
и
с. 5-7. Структура глобулярных доменов
легкой цепи по данным рентген-структурного
анализа.
