
З адание 2_11
Понятие фазы. Сколько фаз и сколько компонентов содержит система, состоящая из
насыщенного раствора хлористого калия в соляной кислоте в равновесии с паром?
При перегонке бромбензола с водяным паром кипение начинается при температуре 368,3 К (р=1атм). Бромбензол практически нерастворим в воде при этой температуре, а упругость пара над чистой водой и бромбензолом при этой температуре составляет 639 и 121 мм рт. ст. соответственно. Какое количество бромбензола переходит в дистиллят с 1 кг водяного пара. Постройте примерную диаграмму кипения этой системы.
1-ый закон Коновалова. Соотношение составов пара и жидкости для идеальных
растворов. Диаграммы р-состав и Т- состав. Использование 1-го
закона Коновалова для разделения веществ.
Укажите стехиометрическую формулу соединения, образующегося в системе CuCl-KCl. Каков тип плавкости этого соединения? Охарактеризуйте все области равновесия.
Задание 2_12
1

2. Диаграмма плавкости системы Au-Sb при атмосферном давлении имеет вид:
1) Какие выводы можете Вы сделать на основе анализа этой диаграммы. Обозначьте наборы фаз, соответствующие всем полям диаграммы, и определите число степеней свободы для них.
Начертите кривые охлаждения для смесей, содержащих 40, 55 и 70% сурьмы. Какие твердые фазы начинают кристаллизоваться из этих расплавов?
Азеотропные смеси. Законы Коновалова и их использование для разделения смесей методом ректификации
4. Эбулиоскопия. Формула для эбулиоскопического эффекта.
З
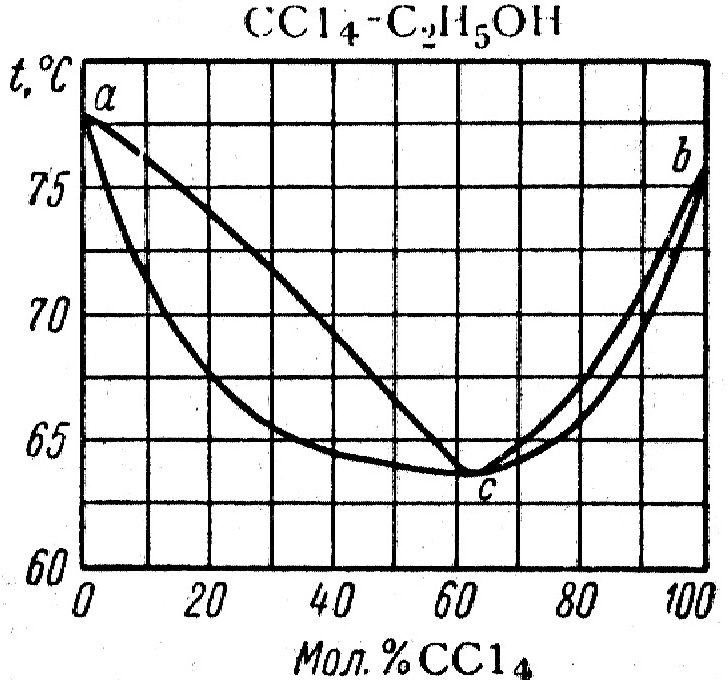
1. Парциальные мольные величины и их использование в термодинамике растворов. Химический потенциал компонента в растворе - парциальная мольная энергия Гиббса.
2. Сколько компонентов, фаз и степеней свободы имеет система состоящая из насыщенного раствора ацетата натрия в равновесии с паром с учетом гидролиза соли ?
3. На рис. представлена диаграмма бинарной жидкой смеси в равновесии с паром. А) Укажите, что будет получаться в конденсате после многократной ступенчатой фракционной перегонки из смеси с 10% CCl4. Б) Можно ли из жидкой смеси, содержащей 50% CCl4, пытаться выделить его в чистом виде на основе фракционной перегонки? Что для этого необходимо дополнительно?
4. Диаграмма состояния однокомпонентной системы р-Т. Смысл областей, линий и точек на диаграмме. Может ли диаграмма однокомпонентной системы иметь несколько тройных точек?
З
1. Физико-химический анализ. Построение диаграмм плавкости по кривым охлаждения-нагревания. Показать это на примере диаграммы плавкости с простой эвтектикой.
Закон Рауля, вывод на основании модели идеального раствора, его графическая интерпретация (диаграмма равновесия давление - состав).
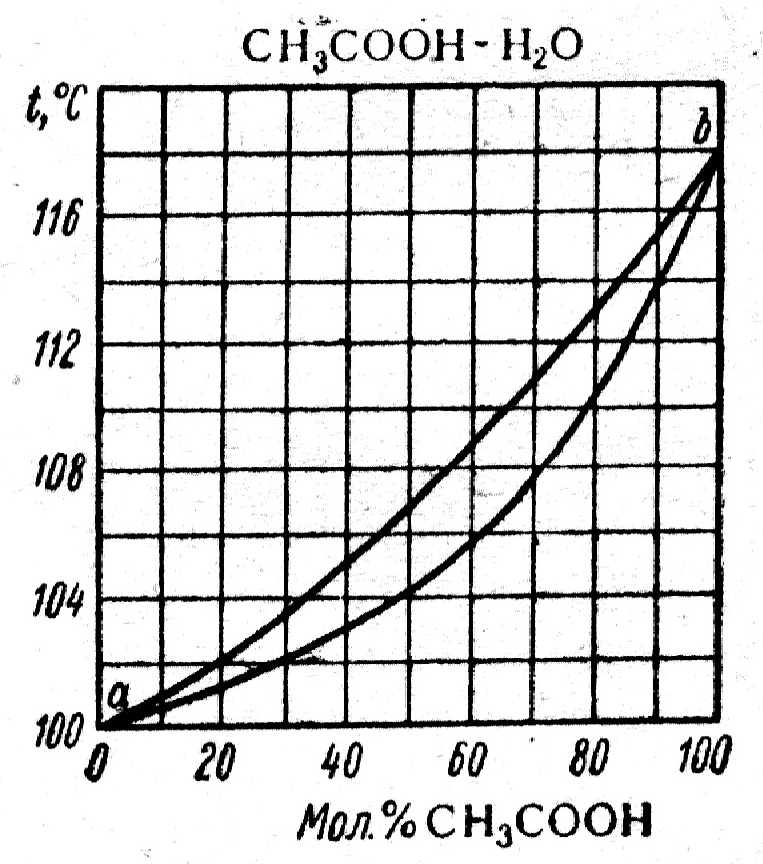
Опишите поля и линии равновесия фаз на диаграмме состояния предложенной Вам системы CH3COOH - H2O.
Диаграмма состояния воды. Что такое тройная и критическая точки? Наклон кривых равновесия двух фаз.
Задание 2_15
1. Применение правила фаз к анализу двухкомпонентных систем. Каково максимальное количество фаз, находящихся в равновесии? Сколько координат необходимо для полного описания состояния таких систем? В каких координатах можно построить плоские диаграммы их состояния?
Растворы твердых веществ в жидкости. Понижение температуры замерзания растворов. Холодильные смеси ( диаграмма состояния). Криогидратная точка.
Т
емпературы кипения чистых веществ при 760 мм рт. ст. для тетрахлорида олова равна 114°С, а четыреххлористого углерода - 77° С. Смеси SnCl4 (А) и CCl4 (В) образуют идеальные растворы. При 90°С давление насыщенного пара компонента А = 362 мм рт.ст., а компонента В = 1112 мм рт.ст. Определите состав жидкости, кипящей при этой температуре и давлении 1 атм, и состав равновесного с ней пара. Постройте диаграмму Т-состав для этой системы.Реальные газы, их отличия от идеальных. Уравнения состояния реальных газов. Изобарный и химический потенциалы реального газа. Понятие фугитивности и коэффициент фугитивности (активности).
Задание 2_16
Р
еальные газы. Уравнения состояния реального газа. Химический потенциал реального газа, понятие летучести. Стандартное состояние реального газа.Число степеней свободы системы. Сколько фаз, компонентов и степеней свободы имеет система, состоящая из бензола, воды и уксусной кислоты в равновесии с паром? Напишите уравнения фазового равновесия для уксусной кислоты.
Физико-химический анализ. Построение диаграмм плавкости по кривым охлаждения-нагревания на примере диаграммы плавкости с простой эвтектикой бинарной системы AgCl- KCl.
Вычислите теплоту испарения фреона при 300 К, если уравнение зависимости давления насыщенного пара над жидким фреоном от температуры имеет вид:
lg р = 34,8 - 2406,1/Т - 9,26 lgТ+ 0,0037Т
Задание 2_6
1
2. Диаграмма состояния воды. Её особые точки.
3. Число степеней свободы системы. Сколько координат необходимо для полного описания двухкомпонентной системы? При каких условиях состояния этой системы можно изобразить на плоскости? Поясните на любом примере.
4. Распределение вещества между несмешивающимися жидкостями и его применение для измерения активности и коэффициента активности растворённого вещества в растворе.
З
1. Химический потенциал компонента в растворе - парциальная мольная энергия Гиббса и его применение для описании равновесий между фазами.
2. Сколько компонентов, фаз и степеней свободы имеет система состоящая из насыщенного раствора ацетата натрия в равновесии с паром с учетом гидролиза соли ?
3. На рис. представлена диаграмма бинарной жидкой смеси в равновесии с паром. А) Укажите, что будет получаться в конденсате после многократной ступенчатой фракционной перегонки из смеси с 10% CCl4. Б) Можно ли из жидкой смеси, содержащей 50% CCl4, пытаться выделить его в чистом виде на основе фракционной перегонки? Что для этого необходимо дополнительно ?
4. Диаграмма состояния однокомпонентной системы р-Т. Смысл областей, линий и точек на диаграмме. Может ли диаграмма однокомпонентной системы иметь несколько тройных точек?
Задание 2_6
1
2. Диаграмма состояния воды. Её особые точки.
3. Число степеней свободы системы. Сколько координат необходимо для полного описания двухкомпонентной системы? При каких условиях состояния этой системы можно изобразить на плоскости? Поясните на любом примере.
4. Распределение вещества между несмешивающимися жидкостями и его применение для измерения активности и коэффициента активности растворённого вещества в растворе.
Задание 2_19
Диаграмма состояния системы, способной образовать жидкие расплавы в равновесии с чистыми компонентами. Простая эвтектика. Поля и линии диаграммы состояний и степени свободы состояний системы, отображаемых разными геометрическими образами.
Неидеальные растворы. Отклонения от закона Рауля в бинарной системе жидкость - пар. Законы Коновалова.
Выведите уравнение, определяющее температуру кристаллизации растворителя в зависимости от состава раствора (уравнение Шредера).
Метод определения коэффициента фугитивности- летучести способом объёмных поправок.
