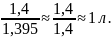МГАВиБ им. Скрябина
Лабораторная работа №1
Приготовление растворов
по курсу общая неорганическая химия
Студент: |
Попков С.В. |
Группа: |
3 группа 1 курс очно-заочное отделение ФВМ |
Дата проведения: |
12.10.2011 г. |
Цель работы:
Освоить правила расчетов при приготовлении растворов.
Получить навыки приготовления растворов.
Теоретическое введение
Способы выражения состава раствора
Концентрация - это величина, выражающая относительное количество (относительную массу) компонента в растворе. В зависимости от предназначения концентрацию раствора можно выразить различными способами. Например, отношение массы компонента к объему раствора называют массовой концентрацией и выражают в кг/м3 или г/л. Отношение количества вещества к объему раствора называют молярной концентрацией и выражают в моль/м3 или моль/л. Количество вещества в 1 кг растворителя называют моляльной концентрацией и выражают в моль/кг, или моль/1000 г.
Отношение массы компонента к массе смеси, в том числе и к массе раствора, называют массовой долей (а не концентрацией). Массовую долю выражают в долях единицы, в процентах, в промилле. Например, если массовая доля компонента в растворе равна 0,1, это значит, что в 100 г раствора содержится 10 г данного вещества. Та же массовая доля, выраженная в процентах, равна 10%, т. е. масса компонента в 100 г раствора численно равна его процентному содержанию. В промилле эта же массовая доля будет равна 100 ‰, т. к. 1‰ = 0,1% (1% = 10‰).
Правила расчетов при приготовлении растворов с заданной массовой долей
1.2.1. Приготовление растворов по навеске
Для проведения расчетов необходимо знать массовую долю компонента и общую массу или объем раствора. Например, требуется приготовить 1 л 10%-ного раствора хлорида калия, плотность которого равна 1,063 г/мл.
Находим массу 1 л раствора: 1,063 • 1000= 1063 г. Определяем требуемую массу хлорида калия. Как указано выше, процентное содержание компонента численно равно его массе в 100 г раствора. Следовательно, можно составить пропорцию:
10 г ––––––––––––––– 100 г
х г ––––––––––––––– 1063 г
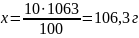
Находим требуемую массу воды: 1063 – 106,3 = 956,7 г. Согласно расчету, для приготовления заданного раствора необходимо взять 106,3 г хлорида калия и 956,7 г воды.
1.2.2. Приготовление растворов разбавлением
Данный
способ применим в тех случаях, когда
имеется раствор с большей массовой
долей, чем требуемый. Для расчетов
необходимо знать массовую долю исходною
раствора и массовую долю и объем
требуемого. Например, требуется
приготовить 15 л 2%-ного раствора из
10%-ного раствора гидроксида натрия.
Находим разбавление, т. е. величину,
показывающую, во сколько раз необходимо
разбавить исходный раствор:
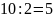 .
Следовательно, чтобы получить требуемый
раствор, необходимо разбавить исходный
в пять раз, т.е. взять один объем раствора
и добавить четыре объема воды.
.
Следовательно, чтобы получить требуемый
раствор, необходимо разбавить исходный
в пять раз, т.е. взять один объем раствора
и добавить четыре объема воды.
Находим
объем исходного раствора, необходимый
для получения 15 л 2%-ного раствора. Объем
требуемого раствора равен 15 л, разбавление
равно 5, т.е. необходимо взять
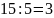 л исходного раствора и добавить к нему
л исходного раствора и добавить к нему
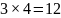 л воды.
л воды.
1.2.3. Приготовление растворов смешиванием
Этот способ используют для приготовления растворов, содержащих два компонента, из двух разных исходных растворов. Так готовят, например, раствор, содержащий азотную и серную кислоты (нитрующую смесь). Способ применим и для приготовления раствора, содержащего один компонент, из двух исходных растворов разной концентрации. Наконец, им можно пользоваться и при разбавлении исходного раствора. В этом случае в роли второго исходного раствора выступает растворитель, например, вода.
Для расчетов необходимо знать массовые доли исходных растворов и массовую долю и объем требуемого. Существует простой графический способ, т.н. правило креста Две прямые линии располагают «косым» крестом. В центре пишут величину массовой доли (%) раствора, который необходимо получить, слева – величины массовых долей (%) исходных растворов: большую (максимальную) – вверху, меньшую (минимальную) – внизу. Справа пишут цифры, которые являются абсолютной разностью между массовой долей исходных растворов и заданной.
Пример. В лаборатории имеются 95%-ный ( = 1,834) и 25%-ный ( = 1,180) растворы серной кислоты. В каком соотношении необходимо смешать эти растворы, чтобы получить 1 л 50%-ного ( =1,395) раствора.
Решение.
95% |
|
25 м.ч. |
\ |
|
/ |
|
50% |
|
/ |
|
\ |
25% |
|
45 м.ч. |
Следовательно,
необходимо взять 25 массовых частей
(м.ч.) 95%-ного раствора и 45 частей 25%-ного
раствора. Масса требуемого раствора
равна 1,395 кг
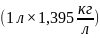 .
.
Масса одной части:
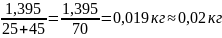
Таким
образом, 95%-ного раствора надо взять
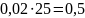 кг, а 25%-ного раствора –
кг, а 25%-ного раствора –
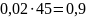 кг. Всего получаем
кг. Всего получаем
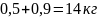 50%-ного раствора кислоты (
= 1,395), или по объему:
50%-ного раствора кислоты (
= 1,395), или по объему: