
Учебник Органическая химия Щеголев 2016
.pdf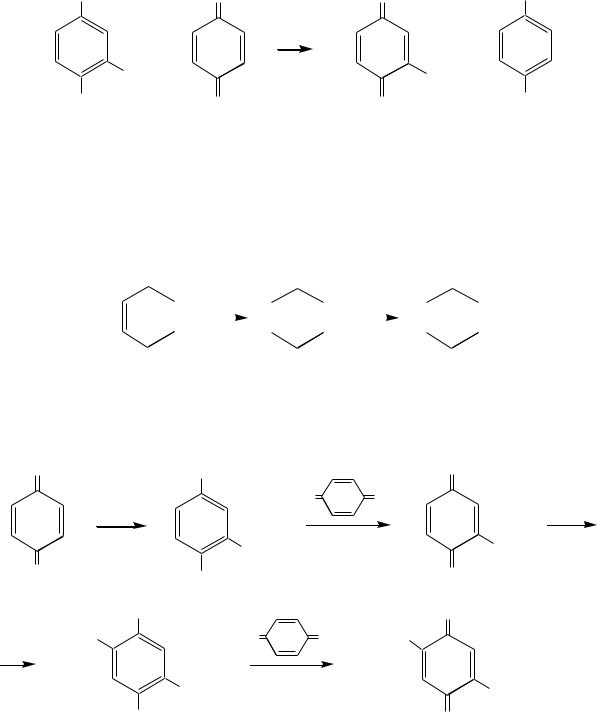
2-Хлоргидрохинон окисляется исходным хиноном до 2-хлор-1,4-бензо- хинона:
OH |
O |
O |
OH |
|
+ |
|
+ |
|
Cl |
|
Cl |
OH |
O |
O |
OH , |
который может дальше присоединять хлороводород. В результате образуются ди-, три- и тетрахлорбензохиноны.
Однако 1,4-бензохиноны могут вступать в типичные реакции 1,2- присоединения по карбонильной группе. С гидроксиламином они дают, например, моно- и диоксимы (гл. 6.1.4.1):
O |
|
N-OH |
|
|
|
|
|
|
N-OH |
||||||||||||||
|
|
|
NH2OH |
|
|
|
|
|
NH2OH |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
- H O |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
O |
|
|
|
|
|
|
N-OH |
||||||||||||||
Но при взаимодействии с ароматическими аминами реакция протекает как 1,4-присоединение (см. выше):
O |
OH |
O |
|
O |
O |
NH2-Ar |
|
NH2-Ar |
|
NH-Ar |
NH-Ar |
O |
OH |
O |
OH |
|
O |
Ar-HN |
O |
O Ar-HN |
|
NH-Ar |
NH-Ar |
OH |
|
O |
2,5-бис-(ариламино)-1,4-бензохинон
Хиноны участвуют в реакциях диенового синтеза в качестве диенофилов. Например:
541
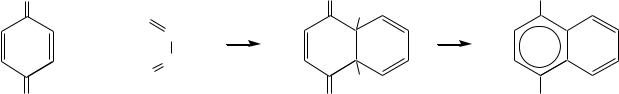
O |
O |
OH |
H2C |
|
H |
CH |
|
|
|
|
|
+ |
CH |
|
H2C |
|
|
|
H |
|
O |
O |
OH |
10.5.8.ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ И ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Кклассу фенолов относится большая группа лекарственных веществ, обладающих антисептическими свойствами. Антисептические свойства фенолов основаны на их способности свѐртывать белки. При введении в молекулу фенола таких заместителей, как алкил, алкоксил, галоген, усиливается бактерицидная активность. Увеличение длины алкильной цепи или разветвление еѐ приводит к усилению антисептического действия. В отличие от алифатических спиртов при увеличении числа гидроксильных групп в ароматическом кольце увеличивается токсичность соединения.
Смесь о-, п- и м-крезолов также используется в качестве антисептика. Раздражающее и токсическое действие крезолов на организм выражено слабее, что связано с их меньшей растворимостью.
Двухатомный фенол, резорцин, по токсичности близок фенолу, но антисептические свойства у него выражены сильнее. Резорцин находит применение при лечении кожных заболеваний.
Фенол — кристаллическое вещество с температурой плавления 41 С и своеобразным запахом. При комнатной температуре малорастворим в воде, но при 70 С смешивается с водой в любых соотношениях. При попадании на кожу фенол вызывает ожоги. Проявляет антисептические свойства.
В промышленности фенол получают главным образом синтетически — кумольным методом.
Основное количество фенола используется для получения фенолоформальдегидных смол, применяемых в производстве пластмасс, и для получения циклогексанола, используемого в производстве синтетического волокна.
Ионол (2,6-ди-трет-бутил-4-метилфенол) — бесцветное кристалличе-
ское вещество с температурой плавления 70 С.
Получают ионол алкилированием п-крезола. Широко применяется в качестве антиоксиданта для стабилизации полимерных материалов, парфю- мерно-косметических изделий.
Пирокатехин (1,2-дигидроксибензол) — бесцветное кристаллическое вещество с температурой плавления 104 С, хорошо растворимое в воде.
542
В промышленности пирокатехин получают прямым гидроксилированием фенола пероксидом водорода или пероксокислотами. Используется в качестве восстановителя в фотографии и как аналитический реагент для определения некоторых металлов.
Резорцин (1,3-дигидроксибензол) — бесцветное кристаллическое вещество со слабым запахом и температурой плавления 111 С, хорошо растворимое в воде.
Резорцин получают щелочным плавлением м-бензолдисульфокислоты. Используется для получения красителей, антисептиков, антиоксидантов, взрывчатых веществ.
Гидрохинон (1,4-дигидроксибензол) — бесцветное кристаллическое вещество с температурой плавления 170 С. Растворим в воде.
Гидрохинон получают щелочным плавлением п-бензолдисульфо- кислоты, гидролизом п-хлорфенола и прямым гидроксилированием фенола пероксокислотами. Широко используют в производстве красителей, в качестве восстановителя в фотографии, а также антиоксиданта и ингибитора полимеризации.
Бензиловый спирт — бесцветная жидкость с приятным запахом и температурой кипения 206 С. Содержится в эфирных маслах некоторых растений.
Синтетически получают из бензилхлорида. Используют в парфюмерии и лакокрасочной промышленности.
2-Фенилэтан-1-ол — бесцветная жидкость с запахом роз и температурой кипения 221 С. Содержится в розовом масле.
Синтетически получают из бензола и эпоксиэтана. Применяют в парфюмерии.
Анизол — бесцветная жидкость с приятным запахом, нерастворимая в воде; температура кипения 155 С. Используют в органическом синтезе и в качестве растворителя в парфюмерной промышленности.
Гваякол — бесцветное кристаллическое вещество; температура плавления 98 С. Используют для синтеза душистых и лекарственных веществ.
Вератрол (диметиловый эфир пирокатехина, 1,2-диметоксибензол) — бесцветное вещество; температура плавления 23 С; температура кипения 207 С. Используют в органическом синтезе для получения душистых веществ.
п-Бензохинон — жѐлтое кристаллическое вещество со своеобразным запахом, напоминающим запах хлора; температура плавления 116 С; легко возгоняется. Получают окислением анилина и используют его для получения гидрохинона и в качестве исходного вещества для дальнейших синтезов.
Хлоранил — жѐлтое кристаллическое вещество со слабым своеобразным запахом; температура плавления 290 С; легко возгоняется. Получают
543
хлорированием анилина или фенола и используют его в качестве окислителя и для получения синтеза красителей.
10.6. АРОМАТИЧЕСКИЕ АМИНЫ И ПРОДУКТЫ НЕПОЛНОГО ВОССТАНОВЛЕНИЯ НИТРОСОЕДИНЕНИЙ
Ароматические амины по аналогии с алифатическими — это производные аммиака, в молекулах которых один, два или три атома водорода замещены ароматическими радикалами.
10.6.1.КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ АРОМАТИЧЕСКИХ АМИНОВ
Как и алифатические амины, ароматические амины в зависимости от числа углеводородных радикалов у атома азота тоже можно разделить на первичные, вторичные и третичные. При этом вторичные и третичные амины, содержащие у азота ароматические и алифатические радикалы, обычно называют жирно-ароматическими, например:
|
CH |
3 |
CH3 |
|
|
|
|
NH-CH3 |
N-CH3 |
N |
|
В номенклатуре простейших ароматических аминов широко применимы тривиальные названия:
|
NH2 |
|
NH2 |
|
NH2 |
|
NH2 |
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
OCH3 |
|
|
OC2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
анилин |
о-, м-, п-толуидины |
о-, м-, п-анизидины |
о-, м-, п-фенетидины |
|||||||||||
Для систематического названия аминов применяются как радикалофункциональная, так и заместительная номенклатуры ИЮПАК. Принцип названия ароматических аминов по радикало-функциональной номенклатуре такой же, что и для алифатических аминов (гл. 1.5.2, 3.7.1).
По заместительной номенклатуре наличие аминогруппы в ароматическом кольце обозначается приставкой амино- даже в отсутствие старших функциональных групп. Поэтому ароматические амины рассматриваются как аминопроизводные бензола. Так, сам анилин, родоначальник ряда, должен иметь строгое название аминобензол. Однако во многих случаях произ-
544

водные бензола, содержащие аминогруппу в кольце, рассматриваются как производные анилина, что и отражается в названии. Например:
|
|
|
|
Br |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||
C2H5 |
|
|
|
|
|
NH2 |
|
|
|
N |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||
1-амино-2-бром-4-этилбензол, |
N,N-диметиламинобензол, |
|||||||||
или 2-бром-4-этиланилин |
или N,N-диметиланилин |
|||||||||
Особое место занимают амины с аминогруппой в алифатической цепи. Их названия по заместительной номенклатуре строятся так же, как и для алифатических аминов. Например:
|
|
|
|
|
|
|
|
CH3 |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
CH2-NH2 |
|
|
|
CH-CH2-NH |
|
CH3 |
|
|
|
|
|
|
|
|
|||
фенилметанамин |
N-метил-2-фенилпропан-1-амин |
|||||||||
Для ароматических аминов, с одной стороны, характерны те же виды изомерии, что и для других производных бензола, с другой стороны, так же, как и алифатические амины, третичные амины изомерны, например, вторичным и первичным с таким же числом атомов углерода. И так же солям третичного и четвертичного аммония присуща и оптическая изомерия (гл. 1.7.1, 3.7.1), когда хиральным центром является тетраэдрический атом азота.
10.6.2. СТРОЕНИЕ АНИЛИНА
Строение анилина во многом похоже на строение фенола. Атом азота аминогруппы взаимодействует с бензольным кольцом посредством –I- и
+М-эффектов. В молекуле анилина, так же как и в моле- |
|
|
|
|
|
|
|
|
|
куле фенола, +М-эффект больше –I-эффекта (по моду- |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
||
лю). Аналогично значительный положительный мезо- |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||
-I |
|
|
|
|
|
|
|||
мерный эффект объясняется соответствием геометриче- |
|
|
|
|
H |
|
|||
|
|
|
|
|
|||||
ской конфигурации внешних (взаимодействующих) |
|
|
|
|
|
|
|||
+M |
|
|
|
|
|||||
р-орбиталей углерода и азота, оба этих атома — это атомы II периода Периодической таблицы химических элементов. В результате суммарный электронный эффект, которым обладает аминогруппа по отношению к бензольному кольцу, – это донорный эффект. Это подтверждается и направлением дипольного момента связи C–N. В связи с этим гибридизация атомных орбиталей азота spx (2<x<3) в отличие от алифатических аминов, в молекулах которых гибридизация азота близка к sp3. Плоскость H–N–H отклонена от плоскости бензольного кольца на 37.5°.
545
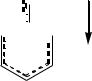
Длина связи C–N в анилине (0.143 нм) меньше, чем в алифатических аминах (0.145–0.147 нм). Кроме того, вследствие р- -сопряжения на атоме азота появляется дефицит электронной плотности (частичный положительный заряд), за счѐт которого понижаются оснóвные свойства анилина по сравнению с алифатическими аминами.
Положительный мезомерный эффект аминогруппы приводит к значительному увеличению электронной плотности на бензольном кольце и главным образом в о- и п-положениях (гл. 10.1.1). В результате сопряжения образуется единая -молекулярная орбиталь. Этому состоянию отвечает мезоформула
'+
NH2
- 
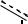 - +M
- +M
-
10.6.3.ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ АМИНОВ
Ароматические амины — бесцветные жидкости или кристаллические вещества со специфическим запахом, темнеющие на воздухе. Низшие амины плохо растворимы в воде, высшие — в воде нерастворимы. Плотности большинства соединений близки к 1 г/мл.
Химические свойства ароматических аминов определяются наличием аминогруппы и бензольного кольца, причѐм высокая эффективность взаимодействия этих структурных составляющих приводит к значительному изменению активности аминов в реакциях как с участием аминогруппы, так и ароматического кольца.
10.6.3.1. Электрофильное замещение
Как и многие ароматические соединения, ароматические амины могут вступать в реакции электрофильного замещения (SE) по бензольному кольцу. Аминогруппа является одним из самых сильных электронодоноров в ароматическом кольце за счѐт большого +М-эффекта. В результате реакции ароматических аминов с электрофилами протекают значительно легче, чем для бензола и аренов. Электрофил вступает в о- и п-положения, как это следует из строения (гл. 10.6.2). Механизм взаимодействия анилина с электрофильной частицей можно представить следующим образом:
546
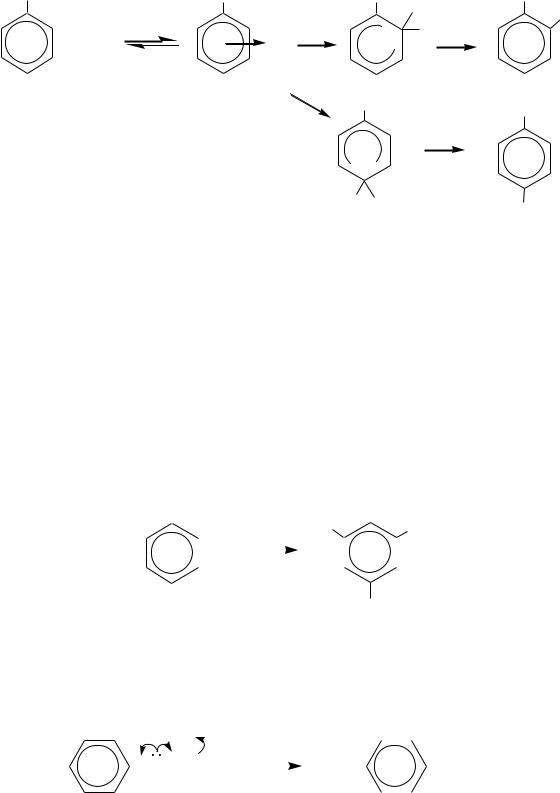
NH2 |
|
NH |
2 |
|
NH |
2 H |
NH |
2 |
|
|
|
|
|
|
|
|
E |
+ E |
+ |
|
E |
+ |
+ |
|
E |
|
|
|
|
|
- H + |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
NH2 |
|
|
|
|
|
|
+ |
|
- H + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
E |
|
E |
|
|
|
|
|
|
|
|
|
|
Вступление электрофила в о- и п-положения бензольного кольца может быть объяснено также резонансными структурами.
Однако помимо высокой реакционной способности ароматических аминов по отношению к электрофилам замещение в бензольном кольце аминов имеет ряд существенных особенностей. Эти особенности связаны прежде всего с тем, что большинство электрофильных реакций протекает в кислой среде.
Галогенирование протекает легко. При этом наиболее гладко протекает бромирование. Так, обработка анилина бромной водой сразу приводит к образованию 2,4,6-триброманилина:
NH2 |
|
NH2 |
|||||
|
|
+3Br2/H2O |
Br |
|
|
Br |
|
|
|
|
|
||||
|
|
|
|
|
|
||
|
|
|
- 3HBr |
|
|
|
|
Br
Электрофильной частицей здесь является бромоний-катион Br+, который образуется при диспропорционировании молекулы брома в водной среде. Для получения монобромпроизводных ароматические амины предварительно ацилируют и затем бромированию подвергают N-ацильное производное:
|
O |
+Br2 |
|
|
|
|
|
|
O |
|||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
NH-C-R |
|
Br |
|
|
|
|
|
NH-C-R |
|||||||
|
|
|
|
|
|
|
|
|
||||||||
- HBr |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ацильная группа за счѐт сопряжения уменьшает электронодонорную активность аминогруппы, и реакционная способность ароматического кольца уменьшается. После проведения бромирования ацильную защиту снимают, проводя гидролиз в кислой среде.
547
Хлорирование в водной среде сопровождается образованием продуктов окисления, например образованием хлоранила — см. гл. 10.5.7.
При нитровании ароматических аминов нитрующей смесью в качестве основного продукта образуется м-нитроанилин, так как в кислой среде амины превращаются в соли замещѐнного аммония, а аммонийная группа в кольце является сильным акцептором. Поэтому требуются жѐсткие условия, и преимущественная ориентация замещения — в мета-положение:
|
+ |
+ |
|
|
NH2 |
NH3 |
NH3 |
|
NH2 |
+H+ |
+HNO3/H2SO4 |
|
+OH - |
|
|
- H2O |
|
- H O |
|
|
|
NO2 |
2 |
NO2 |
|
|
|
Такое направление замещения в катионе замещѐнного аммония объясняется сравнением устойчивости -комплексов:
+ |
+ |
|
+ |
|
+ |
|
|
NH3 |
NH3 |
|
NH3 |
|
NH |
|
|
|
|
H |
|
H |
3 |
H |
|
|
|
|
|
||||
+ |
|
E |
|
E |
+ |
|
E |
+ E |
|
|
|
|
|||
|
+ |
|
+ |
|
|
|
|
|
+ |
|
+ |
|
+ |
|
|
|
NH3 |
|
NH3 |
|
NH3 |
|
|
|
|
|
+ |
|
+ |
|
|
|
+ |
H |
|
H |
|
|
H |
|
|
E |
|
E |
|
|
E |
|
+ |
|
+ |
|
+ |
|
|
|
NH3 |
|
NH3 |
|
NH3 |
|
|
|
|
|
|
|
+ |
|
|
|
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
H |
E |
|
H E |
|
H E |
|
|
Несмотря на то, что число граничных структур -комплексов при вступлении электрофила в орто-, мета- и пара-положения одинаково, - комплексы с электрофильной частицей в орто- и пара-положениях по отношению к аммонийной группе менее устойчивы, так как одна из трѐх граничных структур в этих случаях сильно дестабилизирована за счѐт локализации положительного заряда на атоме углерода, связанном с аммонийным атомом
548
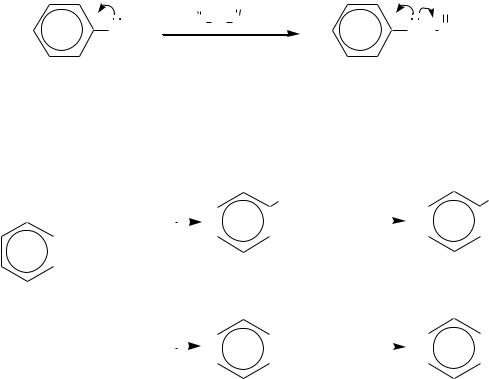
азота. Эти граничные структуры изображены последними в соответствующих рядах.
Нитрование ароматических аминов нельзя проводить чистой концентрированной азотной кислотой, так как это потребует нагревания (в отличие от нитрования нитрующей смесью), а при повышенных температурах усиливаются окислительные свойства азотной кислоты, и будет происходить окисление амина. Использование других нитрующих агентов, например тетрафторобората нитрония [NO2]+BF4 при низких температурах, может привести к продуктам нитрования по атому азота (N-нитроариламинам).
Для получения продуктов нитрования в орто- и пара-положения ароматического кольца необходимо предварительно ввести ацильную защиту, которая заключается в предварительном ацилировании аминогруппы (см. также гл. 10.6.3.3). Продукты ацилирования, N-ацилариламины, не обладают оснóвными свойствами, и поэтому в кислой среде электронодонорная активность атома азота сохраняется, хотя величина +М-эффекта будет значительно меньше, чем у исходного амина, так как ацильная группа также вступает в сопряжение с аминогруппой. В связи с этим уменьшается реакционная способность ароматического кольца.
|
O O |
O |
|
NH2 |
CH3-C O C-CH3 |
NH C-CH3 |
|
- CH3COOH |
|||
|
|
При нитровании нитрующей смесью N-ацилариламинов получается смесь о- и п-изомеров. После проведения нитрования ацильную защиту снимают с помощью гидролиза.
|
|
|
|
|
|
|
NH-CO-R |
|
|
NH2 |
|||||
NH-CO-R |
|
|
NO2 |
+H2O/H |
+ |
|
|
NO2 |
|||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HNO3/H2SO4 |
|
|
|
|
|
|
- RCOOH |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
NH-CO-R |
|
|
NH2 |
|||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
+H2O/H + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- RCOOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
NO2 |
|||||
549

Сульфирование. Взаимодействие анилина с концентрированной серной кислотой при нагревании до 180 190 С приводит к образованию сульфаниловой кислоты (метод «запекания»):
|
|
+ |
|
|
|
NH2 |
|
NH3 |
|
HN SO3H |
NH2 |
|
+H2SO4 |
- |
t |
o |
H2SO4 |
|
HSO4 |
|
|||
|
|
- H2O |
|
||
|
|
|
|
||
|
|
|
|
|
SO3H |
Образование исключительно п-изомера объясняется уменьшением электронодонорной активности аминогруппы в промежуточной N-сульфокислоте (аналогично применению ацильной защиты при бромировании и нитровании) и большим пространственным эффектом заместителя в этом соединении.
Взаимодействие со слабыми электрофилами. Повышение активности бензольного кольца ароматических аминов делает возможным взаимодействие с такими слабыми электрофилами, как альдегиды, соли диазония и некоторыми другими. Реакция с формальдегидом может рассматриваться как типичная реакция SE по отношению к амину или как реакция AN по отношению к альдегиду:
|
|
|
|
|
|
|
|
|
O |
|
|
(H3C)2N |
|
= |
(H3C)2N |
CH2OH |
|
|
H-C |
|
|||
|
|
|
H |
|
|
|
|
|
|
|
|
Образующийся продукт присоединения, являющийся ароматическим спиртом, также может проявлять электрофильные свойства и вступать во взаимодействие со следующей молекулой амина. По отношению к ароматическому спирту это уже будет нуклеофильное замещение (механизм реакции, скорее всего, SN1):
|
N(CH3)2 |
N(CH3)2 |
(H3C)2N |
N(CH3)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
C |
|
|
|
CH2 |
OH |
|
H |
п,п -бис-(диметиламино)-дифенилметан
550
