Учебник Органическая химия Щеголев 2016
.pdf
OH |
OH |
|
OH |
OH |
CH2OH |
CH2OH |
OH |
CH2 |
|
CH2=O |
|
|
|
|
|
CH2OH |
|
CH2OH |
|
OH |
|
|
|
|
OH |
OH |
HO |
CH2 |
|
|
CH2 |
HOH2C |
|
|
|
|
|
|
|
OH |
|
|
OH |
|
|
|
|
|
|
CH2 |
|
|
|
|
 OH
OH
В целом схему образования линейного полимера можно представить следующим образом:
OH |
|
OH |
OH |
OH |
CH2OH H |
CH2OH |
CH2 |
CH2OH |
|
+ |
n |
|
-nH2O |
|
|
|
|
||
|
|
|
|
n |
Карбоксилирование с образованием фенолкарбоновых кислот можно условно считать частным случаем реакции ацилирования, в которой в качестве ацилирующей частицы выступает молекула CО2. В частности, реакцию получения салициловой кислоты из фенолята натрия
ONa |
OH |
|
COONa |
+ |
CO2 |
|
салицилат натрия |
называют реакцией Кольбе–Шмитта*. По методу Кольбе (1860 г.) фенолят натрия нагревают с диоксидом углерода под давлением при 180 200 С. В 1885 г. Шмитт улучшил метод Кольбе, предложив проводить реакцию при менее высокой температуре (130 С) в течение более длительного времени. Механизм реакции можно представить так:
531
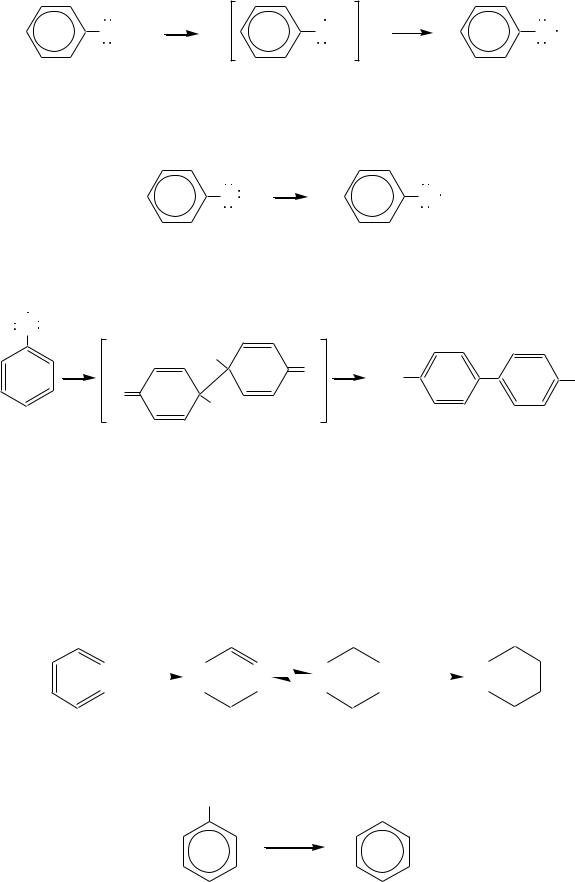
|
|
|
+ |
|
|
O-H |
- e - |
O-H |
|
+ |
O |
|
|
-H |
|
||
|
|
|
|
, |
|
|
|
|
|
|
в котором неспаренный электрон делокализован за счѐт р- -сопряжения с бензольным кольцом. Особенно легко происходит окисление в щелочной среде, при этом окисляется фенолят-ион:
|
- |
|
O |
- e- |
O |
|
|
Дальнейшие превращения феноксильного радикала приводят обычно к продуктам димеризации и олигомеризации, например:
|
O |
|
|
|
|
H |
|
|
|
2 |
O |
HO |
OH |
|
O |
||||
|
|
|
||
|
H |
|
|
|
|
|
п,п -дигидроксидифенил |
|
Реакции восстановления фенолов сводятся либо к гидрированию бензольного кольца, приводящему к образованию циклических спиртов и кетонов, либо к восстановлению самой гидроксогруппы с сохранением бензольного кольца. При гидрировании фенола на никелевом катализаторе (1 МПа, 130 140 С) получается циклогексанол, в качестве промежуточного продукта можно получить циклогексанон:
OH |
|
|
|
OH |
|
|
|
|
|
O |
|
|
|
OH |
|||||||
|
|
|
|
2H2/Ni |
|
|
|
|
|
|
|
|
|
|
|
|
H2/Ni |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Восстановление до бензола протекает в более жѐстких условиях, например, при обработке цинковой пылью или MoS (р, Т):
OH
[H]
533
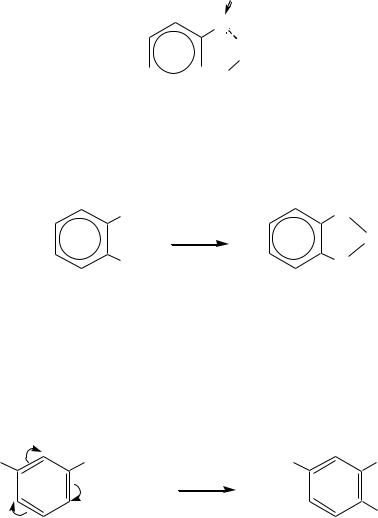
10.5.4.ОСОБЕННОСТИ СВОЙСТВ ДВУХАТОМНЫХ ФЕНОЛОВ
Кдвухатомным фенолам относят как родоначальные соединения: пирокатехин, резорцин и гидрохинон (гл. 10.5.1), так и их гомологи и производные. Двухатомные фенолы дают те же реакции, что и фенол. Это кислот- но-оснόвные свойства, реакции алкилирования, ацилирования как по атому кислорода, так и в ароматическое кольцо, другие реакции электрофильного замещения.
Кислотные свойства пирокатехина, резорцина и гидрохинона по первой ступени диссоциации близки к кислотным свойствам фенола. Но наи-
большими кислотными свойствами среди них обладают резорцин (рКа = 9.20) из-за отсутствия мезомерного взаимодействия двух гидроксогрупп ме-
жду собой и пирокатехин (рКа = 9.25) из-за возможности образования внутримолекулярной водородной связи между гидроксогруппами:
H
O
 H
H
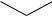
 O
O
пирокатехин
Реакции алкилирования по атому кислорода для двухатомных фенолов протекают легко, причѐм пирокатехин при взаимодействии с дигалогеналканами может образовывать циклические эфиры:
OH |
|
O |
|
CH2I2 |
CH2 |
|
|
|
OH |
|
O |
Электрофильное замещение по ароматическому кольцу для двухатомных фенолов также протекает легко, и особенно легко для резорцина, в бензольном кольце которого гидроксильные группы согласованно повышают электронную плотность на 2, 4 и 6-м атомах углерода. Поэтому резорцин может, например, вступать в реакцию карбоксилирования в обычных условиях в среде водного раствора гидрокарбоната калия:
HO |
|
OH |
HO |
OH |
|
||||
|
|
+ CO2 |
KHCO3 |
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
||
|
|
|
|
|
резорцин |
|
резорциловая кислота |
||
534
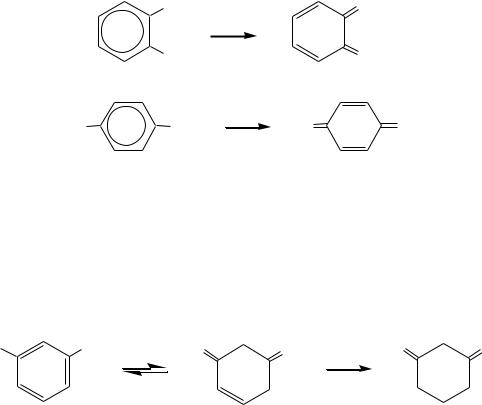
Реакции окисления пирокатехина и гидрохинона протекают легче, чем фенола; в результате образуются хиноны:
|
OH |
|
O |
|
|
|
[O] |
|
|
|
OH |
|
O |
|
|
|
|
о-бензохинон |
|
HO |
OH |
[O] |
O |
O |
|
п-бензохинон
Так, гидрохинон легко окисляется, например, хлоридом железа (III) или солями арендиазония (гл. 10.7), поэтому реакция азосочетания, характерная для фенолов (гл. 10.7.4.3), для него не протекает.
Резорцин устойчивее к окислению, для него невозможно образование хинона. Но он легче подвергается восстановлению, это обусловлено способностью к кето-енольной таутомерии:
HO |
OH |
O |
O |
O |
O |
|
|
|
|
[H] |
|
Восстановление может проводиться амальгамой натрия или каталитически в щелочной среде.
Как и сам фенол, двухатомные фенолы дают цветные реакции с FeCl3: для фенола она красно-фиолетовая, для пирокатехина — зелѐная, для резорцина — ярко-фиолетовая, для гидрохинона — синяя. Окраска связана с образованием комплексных фенолятов с участием иона Fe3+.
10.5.5.ОСОБЕННОСТИ СВОЙСТВ АРОМАТИЧЕСКИХ СПИРТОВ
Как следует из строения, химические свойства фенолов и ароматических спиртов должны сильно различаться. Так, свойства фенолов должны определяться, с одной стороны, возможностью протекания реакций по ароматическому кольцу (как для любых замещѐнных бензолов), а с другой стороны — способностью к взаимодействиям с участием гидроксильной группы. Аналогично и для ароматических спиртов. Их свойства определяются наличием как бензольного кольца, так и фрагмента алифатического спирта.
Ароматические спирты по своим кислотно-основным свойствам близки к алифатическим спиртам, однако для бензилового спирта и его производных характерны высокие оснóвные свойства, обусловленные образовани-
535

ем устойчивого карбокатиона при диссоциации молекулы спирта по связи
С–О.
CH -OH + H + |
|
|
|
|
+ |
|
|
+ |
|
|||
|
|
CH |
|
|
OH |
|
|
CH |
2 |
|||
|
|
|
|
|
|
|||||||
|
|
2 |
|
2 |
|
|
|
2 |
- H2O |
|
||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
бензиловый спирт
По той же причине, то есть за счѐт образования устойчивого карбокатиона, бензиловый спирт и его производные легко вступают в реакции нуклеофильного замещения гидроксогруппы, протекающие по механизму SN1.
10.5.6.СПОСОБЫ ПОЛУЧЕНИЯ ФЕНОЛОВ И АРОМАТИЧЕСКИХ СПИРТОВ
Фенол и его ближайшие гомологи получают из продуктов коксования каменного угля и синтетически.
Среди синтетических способов получения фенолов и ароматических спиртов наибольшее значение имеют следующие.
1. Щелочной гидролиз хлорбензола, протекающий в жѐстких условиях (гл. 10.2.4.2). В промышленности осуществляют парофазный каталитический гидролиз хлорбензола при 400 С и атмосферном давлении:
Cl |
|
|
OH |
|||||
|
|
+ H2O |
|
Ca3(PO4)2 |
|
|
|
+ HCl |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Гидролизом п-дихлорбензола получают так же гидрохинон, и можно получать любые ароматические спирты аналогично алифатическим спиртам,
вчастности таким способом получают бензиловый спирт.
2.Кумольный метод получения фенола является наиболее экономичным. Он был разработан Р.Ю. Удрисом и П.Г. Сергеевым для получения фенола из изопропилбензола (кумола).
|
|
|
|
|
|
O-O-H |
|
|
|
|
|
|
|
|
|
|
CH3-CH-CH3 |
|
|
CH3-C-CH3 |
|
|
|
OH |
|
||||||||
|
|
+ |
O2 |
|
|
|
|
H2SO4 |
|
|
|
O |
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
+ CH -C-CH |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
536
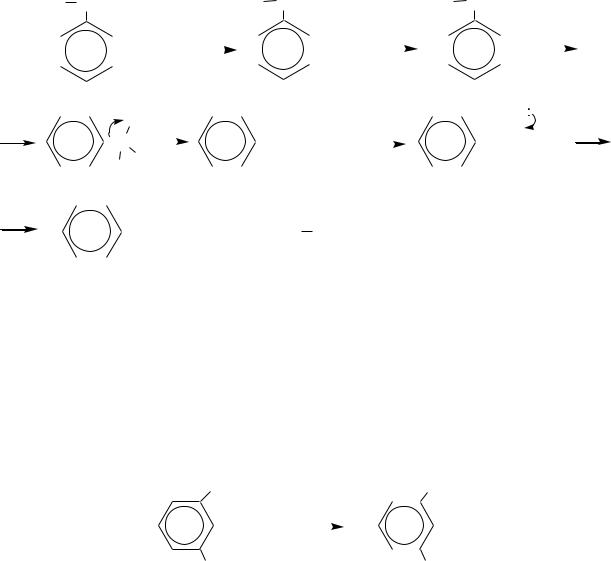
Механизм реакции:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
O-OH |
|
|
|
|
|
|
O-OH2 |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
H3C C |
|
CH3 |
|
|
H3C C |
|
|
CH3 |
|
|
|
H3C C |
|
|
CH3 |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
||||
|
|
|
|
|
|
|
|
|
|
|
O2 / OH, 400 K |
|
|
|
|
|
|
|
|
|
|
|
H / 338 K |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
H O |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
O |
|
C-CH3 |
|
|
|
|
|
|
|
O |
|
|
|
C-CH3 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
+ |
|
|
|
H3C C |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Этот метод может применяться и для получения гомологов и производных фенолов:
О ,кат. Н
Ar-CH(CH3)2 2 Ar-C(CH3)2-OOH Ar-OH +CH3-CO-CH3
3. Щелочное плавление солей ароматических сульфокислот может применяться для получения одноатомных фенолов, но широкое применение этот способ нашѐл для получения резорцина:
SO3H |
|
|
|
OH |
|
|
|
4NaOH |
|
|
|
|
|
- 2Na2SO3 |
|
|
|
SO3H |
- 2H2O |
|
OH |
||
|
|
|
|||
4. Фенолы могут быть получены при замене первичной аминогруппы в ароматическом кольце (через образование диазосоединения и последующий его гидролиз):
HNO2 HCl |
+ |
|
H2О |
Ar-NH2 |
[Ar-N2] Cl |
|
Ar-OH + HCl + N2 |
5. Окислительное декарбоксилирование бензойной кислоты при температуре 250 С может применяться для получения фенола, так как способ экономически выгодный (сама бензойная кислота получается при окислении толуола). Схема процесса:
537
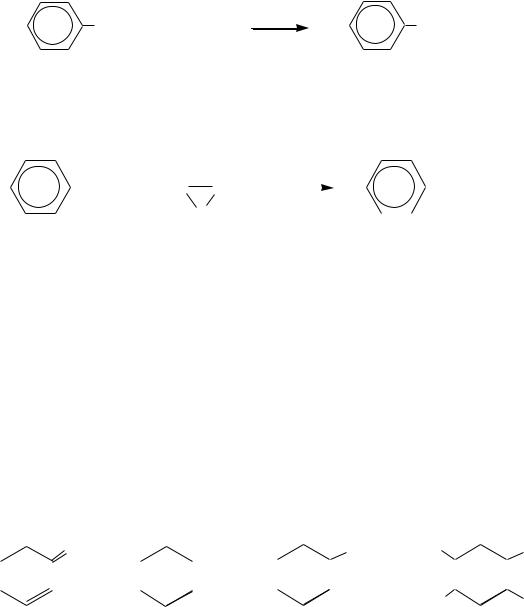
COOH + O2 |
Cu2+ |
OH + CO2 |
6.Для получения ароматических спиртов, содержащих гидроксогруппу
у-углеродного атома (например, 2-фенилэтан-1-ол), используется алкилирование бензольного кольца с помощью эпоксиэтана:
+ H2C CH2 |
|
AlCl3 |
|
|
|
CH2CH2OH |
|
|
|
|
|
|
|
||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ароматические спирты можно также получать и обычными методами, характерными для алифатических спиртов. Кроме гидролиза галогенопроизводных углеводородов, применяются металлорганический синтез, восстановление карбонильных соединений и другие способы (гл. 3.3.4).
10.5.7.ХИНОНЫ
Хиноны можно рассматривать как циклические непредельные дикетоны с сопряжѐнными связями. Моноциклическими являются бензохиноны: 1,2-бензохинон (о-бензохинон), 1,4-бензохинон (п-бензохинон) и их производные, например: толухинон, хлоранил.
|
|
O |
|
|
O |
|
|
O |
|
|
O |
|
||||||||||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
CH3 |
Cl |
|
|
|
|
|
|
|
Cl |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
Cl |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
O |
|
|
O |
|
|
O |
|
||||||||||||||||
о-бензохинон |
п-бензохинон |
|
|
толухинон |
хлоранил |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
(метил-1,4-бензохинон) |
(2,3,5,6-тетрахлор- |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,4-бензохинон) |
||||||||||||
Орто- и пара-бензохиноны обычно получаются при окислении соответствующих двухатомных фенолов — пирокатехина и гидрохинона (гл. 10.5.4). В качестве окислителей могут быть использованы хромовая смесь (K2Cr2O7 + H2SO4), оксид серебра, хлорид железа (III). А хлоранил, например, получается при энергичном хлорировании анилина:
538
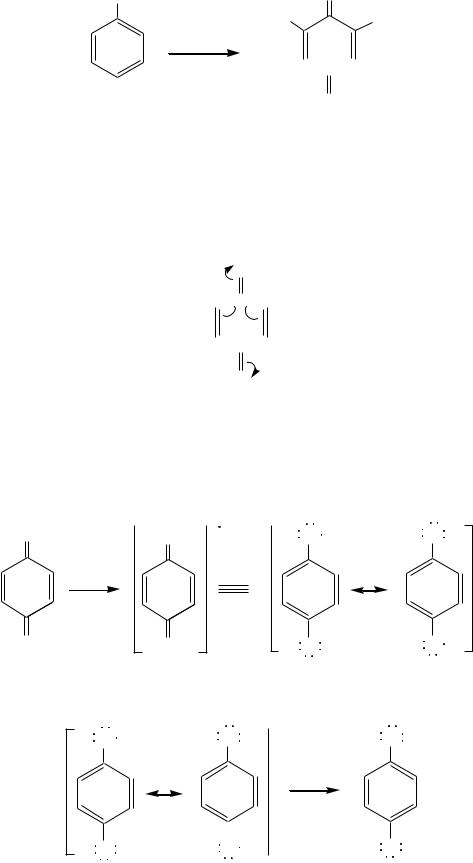
NH2 |
O |
Cl |
Cl |
Cl2 / H2O
Cl 
 Cl
Cl
O
Хиноны являются окрашенными кристаллическими веществами: о-бензохинон окрашен в красный цвет, п-бензохинон — в жѐлтый цвет.
В молекулах хинонов карбонильные группы оказывают значительный электроноакцепторный эффект. Поэтому на атомах углерода наблюдается существенный дефицит электронной плотности:
O''


O''
Таким образом, хиноны — соединения с выраженными электроноакцепторными свойствами и обладающие окислительной способностью.
При присоединении электрона (на катоде или при действии восстановителей) образуется семихинон:
O |
|
O |
|
- |
|
O |
O - |
|
|
|
e-
O |
O |
O - |
O |
, |
|
|
|
|
а при присоединении ещѐ одного электрона образуется анион гидрохинона:
O |
O - |
|
O - |
|
e-
O - |
|
|
|
O - |
|
O |
|||||
|
|||||
Хинон и гидрохинон образуют окислительно-восстановительную систему:
539
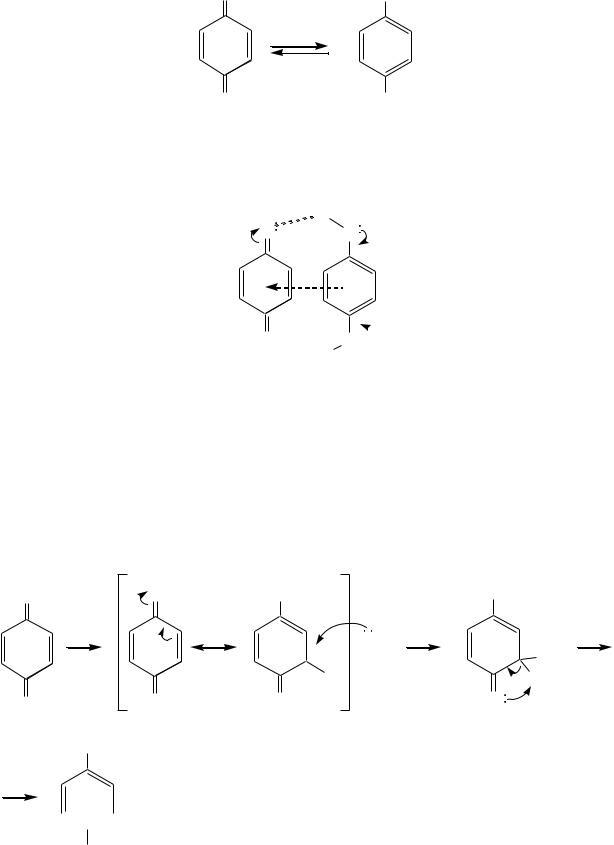
O |
OH |
2e-, 2H+
-2e-,-2H+
O |
OH , |
причѐм эквимолярная смесь хинона и гидрохинона представляет собой комплекс, называемый хингидроном, являющийся основой используемого в электрохимии хингидронного электрода.
O |
H |
O |
|
|
' |
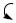 O
O




 H O
H O
хингидрон
Такой комплекс является комплексом с переносом заряда. (Аналогичные комплексы с переносом заряда образуют нитросоединения — гл. 10.4.3.4).
Бензохиноны в условиях кислотного катализа способны присоединять различные нуклеофильные реагенты, такие как спирты, тиоспирты, амины, галогеноводороды. При этом образуются соответствующие замещѐнные двухатомные фенолы. Например:
|
+ |
|
|
OH |
O |
OH |
OH |
|
|
|
HCl |
|
- |
|
|
|
|
Cl |
Cl |
|
|
+ |
|
|
|
|
H |
|
H |
O |
O |
O |
|
O |
OH
 Cl
Cl
OH
540

 Cl
Cl O-P-O
O-P-O