
Учебник Органическая химия Щеголев 2016
.pdf
уменьшают кислотные свойства, так как в этом случае их электронный эффект препятствует делокализации заряда аниона:

 O
O 

 O A
O A
 D
D
По тем же причинам (из-за р- -сопряжения, в котором участвует неподелѐнная электронная пара электронов кислорода) основность фенолов значительно понижена по сравнению со спиртами.
10.5.3.2. Нуклеофильные свойства
За счѐт +М-эффекта гидроксильной группы в молекуле фенола понижены как основные, так и нуклеофильные свойства. Поэтому реакции, в которых фенол играет роль нуклеофила, протекают с трудом. Повышению реакционной способности фенола способствует щелочная среда, при этом молекула фенола переходит в фенолят-ион. Такими реакциями являются алкилирование и ацилирование.
Алкилирование (образование простых эфиров). В общем случае ще-
лочная среда способствует протеканию реакции по SN2-механизму, поэтому легче должны алкилироваться субстраты, имеющие доступный электрофильный реакционный центр с высоким эффективным положительным зарядом. Такими субстратами могут быть первичные алкилгалогениды и прежде всего
— производные метана.
OH |
O |
|
O-CH2-R |
|
|
|
|
|
+ OH |
R-CH2 Br |
|
|
- H2O |
- NaBr |
|
В ряде случаев в качестве метилирующего средства используется диметилсульфат, в частности, при синтезе метиловых эфиров гидрохинона, м-крезола, 4-метил-2-нитрофенола и др. Например:
|
|
OH |
|
|
|
|
OCH3 |
||
|
|
|
|
|
|||||
|
|
|
NO2 |
(CH3)2SO4 / OH- |
|
|
|
NO2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
|||||
4-метил-2-нитрофенол |
4-метил-1-метокси-2-нитробензол |
||||||||
Этим же способом можно получать о- и п-нитроанизолы из о- и п-нитро- фенолов.
521
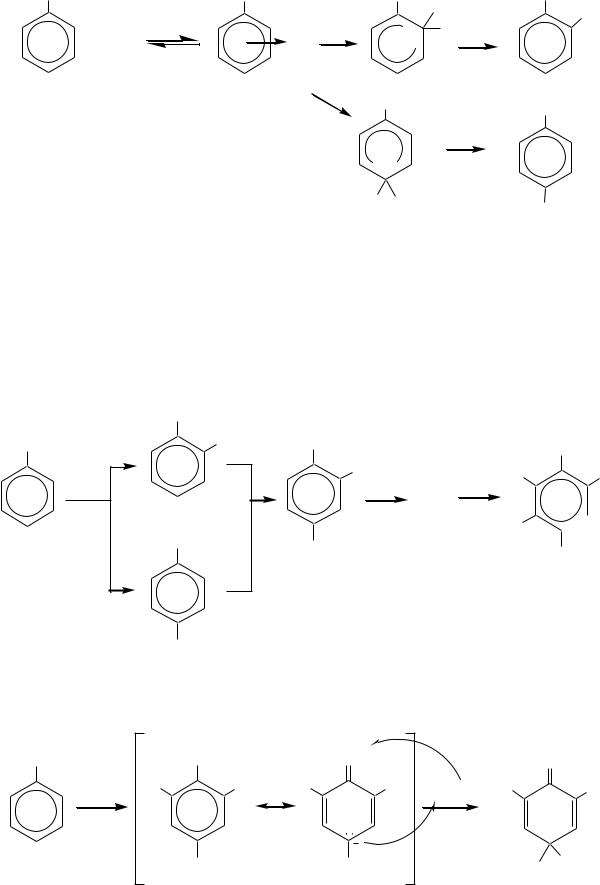
Нитрование может проводиться как концентрированной, так и разбавленной азотной кислотой. Концентрированная азотная кислота нитрует фенол сразу до ди- и тринитропроизводных, например:
|
O2N |
|
HO |
NO2+ |
NO2 |
HO |
||
|
O2N |
, |
при этом протекает сильное осмоление фенола.
В молекулах фенолов и их эфиров может происходить не только замещение атома водорода, но и пространственно доступных алкильных групп:
H3C CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
H3C CH |
|
CH3 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
H3CO |
|
|
|
|
|
NO2+ |
|
|
|
|
|
|
|
|
|
H3CO |
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
-H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2+ |
H3C |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
H3C CH |
|
|
|
CH3 |
|
|
|
|
|
O2N |
CH CH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3CO |
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
NO2 |
||||||||||||||
|
|
|
|
+ |
|
|
|
|
|
|
|
H3CO |
+ |
|
|
|||||||||||||||||
|
|
|
|
O2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-H+ |
|
|
|
|
|
|
|
|
|
-CH(CH3)2+ |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
H3C CH |
|
|
CH3 |
|
|
|
|
|
|
O2N |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
H3CO |
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
H3CO |
|
|
|
|
NO2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||||
|
|
|
|
O2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
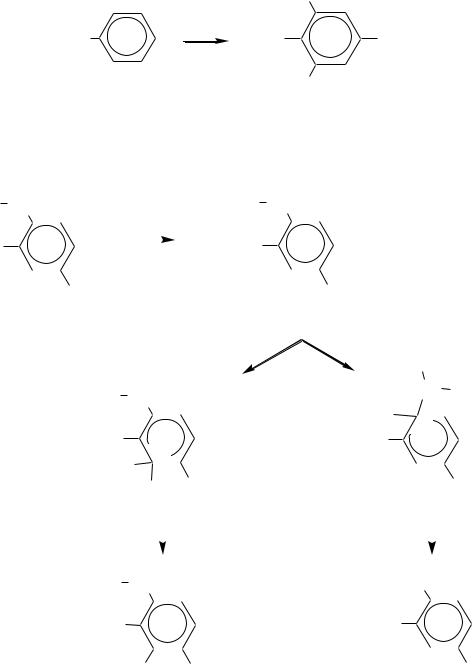
Действие разбавленной азотной кислоты на фенолы при комнатной температуре приводит к орто- и пара-замещѐнным мононитрофенолам:
524
OH
OH |
NO2 |
HNO3+H2O
OH
NO2
Учитывая, что в разбавленной кислоте нитроний-катион не образуется и потому нитрование по электрофильному механизму невозможно, реакция в данном случае представляет окислительное нитрозирование (за счѐт диоксида азота, содержащегося в азотной кислоте):
|
|
|
|
2 NO2 |
|
NO+ |
+ NO3 |
||||||||||||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
OH |
||||||
OH |
|
|
NO |
+HNO3 |
|
|
|
|
|
NO2 |
|||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
-HNO2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
+ NO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
- H + |
OH |
|
|
|
|
OH |
||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
+HNO3
-HNO2
|
|
|
|
NO |
NO2 |
||
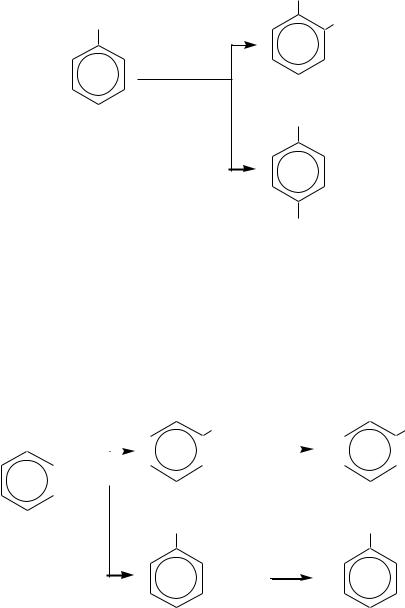
Поэтому для проведения мононитрования вместо разбавленной азотной кислоты может быть использована смесь азотной и азотистой кислот.
Кроме этого, нитрозирование используется и для определения фенолов (реакция Либермана). Фенол обрабатывают концентрированной серной кислотой и добавляют несколько капель водного раствора нитрита натрия. При разбавлении раствор приобретает красное окрашивание, при добавлении щѐлочи окраска переходит в голубую. Эта цветная реакция объясняется образованием индофенола, анион которого имеет синюю окраску:
NaNO2 + H2SO4 NaHSO4 + HNO2
HNO2 + H2SO4 NO+ + HSO4 + H2O
525
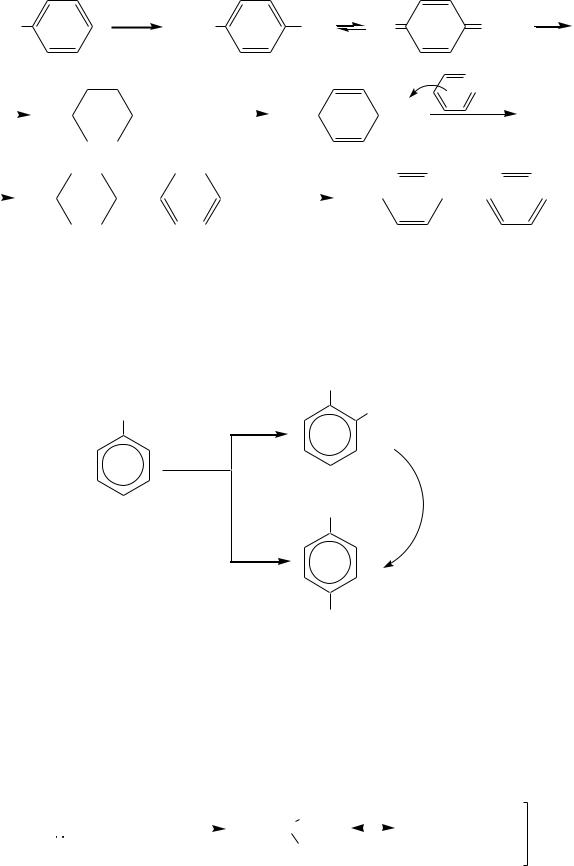
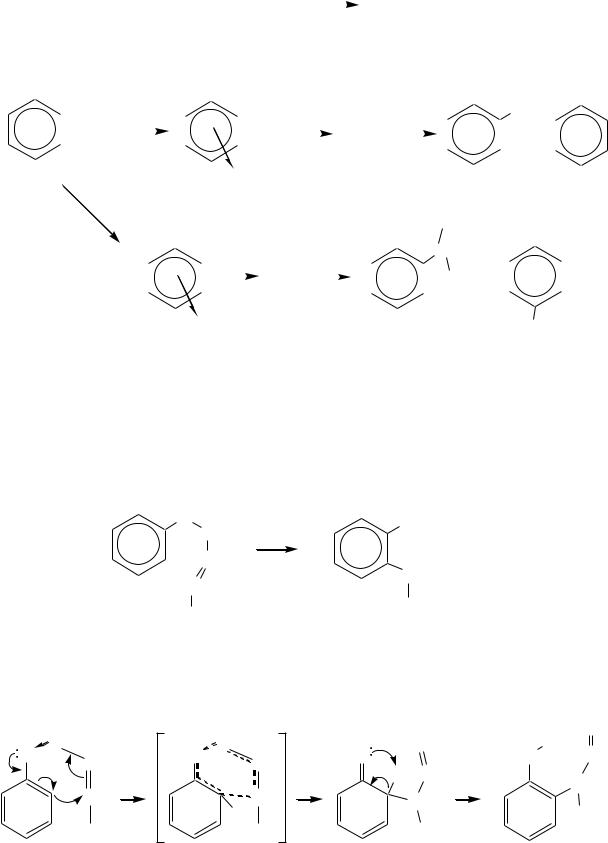
R-CH=CH2 + H + |
|
+ |
|
|
|
R-CH-CH3 |
|
|
|
||
и затем электрофил взаимодействует с молекулой фенола:
|
OH |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
+ |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
R [BF3OH] |
|
|
|
|
|
|
|
|
|
|
. . . |
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-BF3 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
R . . .BF3OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
R-CH-CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
OH CH3 |
|
OH |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . . -H + |
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
CH3-CH-R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R-CH-CH3 |
||||||||||||
Кроме того, продукты алкилирования фенолов по атому кислорода в ряде случаев могут претерпевать перегруппировку, приводящую к образованию о- и п-алкилфенолов. Таким превращением является перегруппировка Кляйзена, заключающаяся в миграции аллильного радикала в аллиловых эфирах фенолов при нагревании до 150 200 С и приводящая к образованию С-аллильных производных:
O |
OH |
|
CH2 |
|
CH |
HC |
CH-CH=CH2 |
|
|
R |
R |
|
Механизм реакции учитывает повышение электронной плотности в орто- и пара-положениях бензольного кольца и возможность электрофильной атаки аллильного фрагмента по кольцу:
CH2 |
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
H C |
|
H |
|||
O |
CH |
O |
CH |
O |
|
2 |
O |
CH |
|
|
|||||||
|
|
|
H |
CH |
|
|
||
|
|
|
|
|
|
CH |
||
|
CH |
|
CH |
|
|
|
|
|
|
H |
|
|
CH |
|
R |
||
|
|
|
|
|
|
|
||
|
R |
|
R |
|
|
R |
|
|
527
Если оба о-положения заняты и прототропная таутомерия промежуточного циклического кетона невозможна, то протекает повторная перегруппировка и образуется п-аллильное производное:
O |
CH2 CH |
O |
|
O |
|
|
|||
H3C |
CH3CHR H3C |
CH3 R |
H3C |
CH3 |
|
|
CH |
|
|
|
|
CH |
|
|
|
|
CH2 |
H |
CH2-CH=CHR |
OH
H3C
 CH3
CH3
CH2-CH=CHR
Ацилирование фенолов, как и алкилирование, может протекать не только по атому кислорода, но и по атомам углерода бензольного кольца. Здесь так же как и при алкилировании требуется применение кислот Льюиса (AlCl3) в качестве катализатора. Это типичная реакция Фриделя–Крафтса в ароматическом ряду:
OH |
OH O |
OH |
O |
C-R |
|
+ R C |
AlCl3 |
+ |
|
||
Cl |
|
|
|
|
O C-R |
Ацилфенолы могут быть получены и перегруппировкой сложных эфиров фенолов (перегруппировка Фриса*). Для этого также необходимо применение кислот Льюиса:
|
|
|
|
+ |
|
O |
O |
|
|
|
|||
|
O-AlCl3 |
|
AlCl3 |
|
||
+AlCl |
AlCl3 |
O |
|
|||
O-C-R |
3 |
O C-R |
|
+ R C |
+ |
|
|
-AlCl2 |
|
||||
|
|
+ |
Cl |
|
|
|
|
|
|
|
|
|
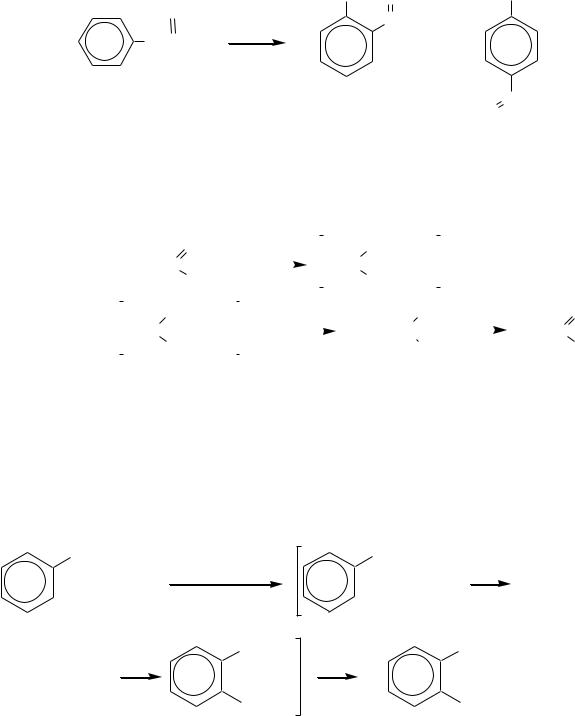
Дальнейшее взаимодействие образовавшихся ацилхлорида и фенолят-иона
— это реакция Фриделя–Крафтса. В целом схему перегруппировки Фриса
можно изобразить следующим образом:
528
O |
OH |
O |
OH |
|
C-R |
|
|
|
AlCl3 |
|
|
O-C-R |
|
+ |
|
|
|
||
|
|
|
|
|
|
|
O C-R |
Частным случаем реакции ацилирования можно считать реакцию Вильсмайера* (реакция Вильсмайера Хаака*) — это формилирование аро-
матических соединений, таких как фенолы и их эфиры, действием N,N- дизамещѐнных формамидов и оксохлорида фосфора:
|
|
|
|
|
O |
|
|
POCl3 |
|
+ |
O-POCl2 |
|
_ |
|
|
|
|||||||
|
|
H |
|
C NRR' |
|
|
|
|
|
H |
|
C NRR' |
Cl |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Ar-H + |
|
|
+ O-POCl2 |
|
_ |
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H |
|
C NRR' |
|
Cl |
|
|
|
|
|
|
Ar |
|
CHNRR' |
|
|
Ar |
|
C H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Формилирующим агентом является комплекс формамидов с POCl3, образующийся в процессе реакции. Обычно используют диметилформамид. Формильная группа обычно вводится в пара-положение к заместителю.
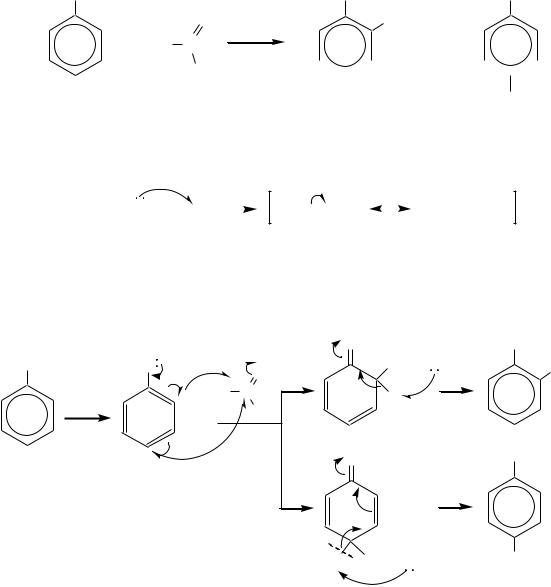
Другая реакция формилирования — это реакция Реймера* Тимана* — получение ароматических о-оксиальдегидов взаимодействием фенолов с хлороформом в щелочной среде. Например, получение салицилового альдегида:
|
_ |
OH |
O |
KOH / 60-80oC |
+ :CCl2 |
+ CHCl3 |
|
OH |
OH |
CHCl2 |
CHO |
Реакция применима для фенолов, содержащих алкильные, алкоксильные группы и галогены в качестве заместителей в ароматическом кольце. Наличие сильных электроноакцепторов дезактивирует молекулу фенола. Вместо CHCl3 можно использовать CHBr3 и CHI3.
Доля образующегося п-изомера, как правило, незначительна.
529
Взаимодействие с формальдегидом. Так же, как и алкилирование и ацилирование фенолов, взаимодействие с формальдегидом — типичная реакция электрофильного замещения в ароматическое кольцо, характерная для активированных ароматических соединений. При проведении реакции в мягких условиях образуются орто- и пара-гидроксиметилфенолы:
OH |
OH |
OH |
O |
|
CH2OH |
+ H C |
|
+ |
H 
 CH2OH
CH2OH
Реакция может идти как в кислой, так и в щелочной среде. Кислая среда активирует электрофильный реагент, превращая молекулу формальдегида в карбокатион:
|
+ |
+ |
|
+ |
|
|
||
CH2=O + H |
|
|
CH2=OH |
|
|
|
||
|
|
|
|
CH2 |
- OH |
, |
||
|
|
|||||||
|
|
|
|
|
|
|
|
|
который далее взаимодействует с молекулой фенола как электрофил с обычным ароматическим субстратом. Щелочная среда активирует молекулу субстрата, превращая еѐ в фенолят-ион, способный к взаимодействию даже с очень слабыми электрофилами:
|
|
|
O |
|
O |
|
OH |
|
|
|
|
||
O |
|
O |
CH2-O |
|
CH2OH |
|
|
|
H |
|
|
||
- |
|
C |
H |
|
|
|
|
H |
|
|
|||
OH |
|
|
|
|
|
|
|
|
|
O |
|
O |
|
|
|
|
|
|||
|
|
|
|
|
||
H CH2-O |
CH2OH |
Далее гидроксиметилфенол может снова вступать во взаимодействие со следующей молекулой формальдегида за счѐт свободных о- и п-положений, а может взаимодействовать с молекулой фенола в качестве алкилирующего агента. Таким образом, в жѐстких условиях образуются продукты поликонденсации — фенолоформальдегидные смолы, как линейные, так и разветвлѐнные:
530

 Cl
Cl
 O-C-R
O-C-R Cl
Cl OH
OH
 N
N 
 O
O