
Учебник Органическая химия Щеголев 2016
.pdf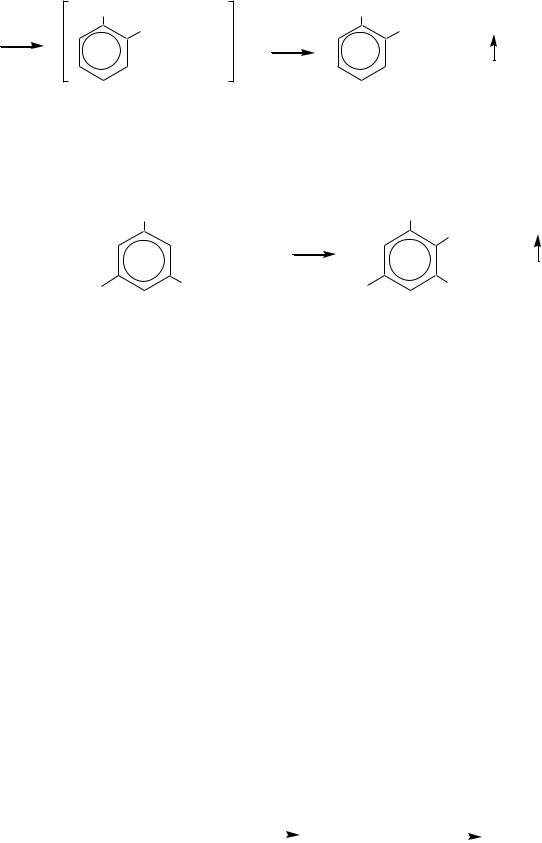
NO2 |
NO2 |
OH |
OK |
+ KH |
+ H2 |
о-нитрофенолят калия
В таких соединениях, как 1,3,5-тринитробензол, под действием нуклеофилов может замещаться не нитрогруппа, а атом водорода, причѐм легче, чем в нитробензоле:
|
NO2 |
|
NO2 |
|
|
|
OK |
|
+ KOH |
|
+ H2 |
NO2 |
NO2 |
NO2 |
NO2 |
2,4,6-тринитрофенолят калия
10.4.3.3. Восстановление
Реакции восстановления ароматических нитросоединений могут протекать в разной среде и с участием разных восстановителей. Получающиеся при этом продукты могут сильно различаться.
При восстановлении в кислой среде (pH < 6) обычно получаются аро-
матические амины. Для этого используют активные металлы (Fe, Zn) или хлорид олова (II) в избытке минеральной кислоты. Схему процесса можно представить следующим образом:
[H ] |
[H ] |
[H ] |
Ar-NO2 Ar-N=O |
Ar-NH-OH |
Ar-NH2 |
Промежуточные продукты при этом не выделяются.
В нейтральной среде восстановление тем же цинком или хлоридом олова (II) приводит к получению только N-арилгидроксиламина:
[H ] |
[H ] |
Ar-NO2 |
Ar-N=O Ar-NH-OH |
В щелочной среде (pH > 8) из нитрозосоединений и арилгидроксиламинов наблюдается образование азокси- и азосоединений, которые дальше превращаются в гидразосоединения. Для восстановления используют обычно цинк в растворе гидроксида натрия:
|
|
|
|
+ |
|
|
|
[H] |
|
||
Ar-N=O + Ar-NH-OH |
|
|
|
|
Ar-N=N-Ar |
|
|
Ar-N=N-Ar |
|||
|
-H2O |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
|
|||||
Ar-N=N-Ar |
|
[H ] |
|
|
|||||||
Ar-NH-NH-Ar |
|
||||||||||
|
|
|
|
511 |
|
|
|
|
|
|
|
Использование многих других восстановителей также может привести к получению продуктов полного восстановления нитрогруппы, то есть ароматических аминов. Для этого могут быть применены амальгамы натрия и цинка, сульфиды щелочных металлов, молекулярный водород на металлических катализаторах. Н.Н. Зинин*, впервые восстановивший нитробензол до анилина (1842 г.), использовал для этих целей сульфид аммония (реакция Зи-
нина).
10.4.3.4. Комплексообразование
Многие полинитросоединения являются хорошими акцепторами электронов и образуют комплексы с переносом заряда с электронодонорными компонентами, такими как, например, мезитилен:
|
|
NO2 |
|
|
NO2 |
|
CH |
|
NO2 |
|
|
3 |
|
|
NO2 + H3C |
- |
NO2 |
- |
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
NO2 |
|
CH3 |
|
CH3 |
|
|
|
|
В кристаллическом состоянии комплексы построены из стопок чередующихся донорных и акцепторных компонент с параллельными бензольными кольцами. В ряде случаев комплексы можно выделить в виде красивых блестящих кристаллов.
10.4.3.5.Особенности нитросоединений с нитрогруппой
вбоковой цепи
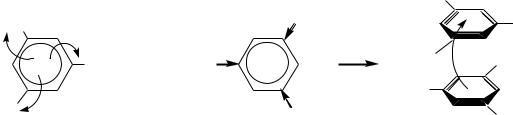
Свойства нитрогруппы в боковой алкильной цепи аналогичны свойствам еѐ в молекулах алифатических соединений. Наиболее важными из этих свойств являются кислотные свойства и таутомерные превращения нитросоединений.
Превращение одной таутомерной формы в другую здесь обусловлено лѐгким отрывом протона от соседнего с нитрогруппой углеродного атома и присоединением его к атому кислорода. Особенно сильные кислотные свойства наблюдаются у соединений, в молекулах которых нитрогруппа находится у -углеродного атома по отношению к бензольному кольцу. При этом анион такой кислоты стабилизирован не только сопряжением р-орбитали-углеродного атома с -связью нитрогруппы, но и с -электронной системой кольца.
512
H |
+ |
|
O |
|
|
- + |
O |
+ H + |
|
OH |
|
|
= |
|
|
C - N |
= |
|
C=N+ |
|
|
C - N |
O |
- H |
+ |
O |
|
O |
||||
R |
|
|
|
R |
|
R |
||||
|
|
|
|
|
|
|
|
|||
аци-форма
Как видно из схемы, для таких соединений характерна стабилизация не только аниона, но и аци-формы — за счѐт - -сопряжения двойной связи C=N с бензольным кольцом. По мере удаления нитрогруппы от бензольного кольца кислотные свойства нитросоединений уменьшаются и становятся такими же, как и у нитроалканов.
В целом же кислотность -нитроаренов сравнима с кислотностью фенолов и слабых минеральных кислот, и они образуют соли при взаимодействии с водными растворами щелочей. Например:
|
CH - NO2 + NaOH |
|
|
|
|
|
|
C - N |
O |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Na + |
|||
|
-H2O |
O |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
R |
|
|
|
|||||||||||
|
|
|
|
|
R |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||
В щелочной среде такие нитросоединения могут подвергаться электрофильной атаке, например, молекул галогенов или галогеналканов:
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
R - Br |
|
|
||||
|
OH |
|
|
|
|
Ar-CH-NO2 |
||||||||
Ar-CH2-NO2 |
Ar-CH-NO2 |
|
||||||||||||
|
|
|
|
|
|
|||||||||
-H2O |
|
- Br |
|
|
||||||||||
|
|
|
||||||||||||
|
|
|
|
|
R |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
Br - Br |
Ar- |
CH-NO2 |
||||
|
|
|
|
|
|
|
|
- Br |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Br |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
10.4.4. СПОСОБЫ ПОЛУЧЕНИЯ
Способы получения соединений с нитрогруппой в ароматическом кольце и соединений с нитрогруппой в боковой цепи различаются между собой.
1.Для нитробензола и его производных важнейшим способом получения является прямое нитрование в бензольное кольцо (гл. 9.5.1.1), которое осуществляется азотной кислотой или нитрующей смесью. Существуют случаи использования и других нитрующих агентов. Это реакции замещения атомов водорода (или сульфогрупп) в бензольном кольце на нитрогруппы.
2.Окисление ариламинов.
[O]
Ar-NH2 Ar-NO2
513
В качестве окислителей применяют трифторпероксиуксусную кислоту CF3-CОOOH, перманганат калия, азотную кислоту или пероксид водорода. Этот способ применяется для получения таких нитроаренов, которые прямым нитрованием получить нельзя. Например:
NH2 |
NO2 |
|
[O] |
NO2 |
NO2 |
3. Соединения с нитрогруппой в ароматическом кольце могут быть получены при замене первичной аминогруппы через образование диазосоеди-
нений (реакция Зандмейера*):
Ar-NH2 |
HNO HCl |
+ |
|
KNO / Cu |
+ KCl + N2 |
|
[Ar-N2] Cl |
|
Ar-NO2 |
||
|
2 |
|
|
2 |
|
4. Прямое нитрование может быть применено и для получения соединений с нитрогруппой в боковой цепи (аналогично нитрованию алканов по М.И. Коновалову). Так, нитрование толуола и его гомологов разбавленной азотной кислотой при 130 К приводит к образованию -нитрозамещѐнных. Реакция протекает по радикальному механизму; еѐ направление определяется стабильностью промежуточной частицы — радикала бензильного типа. Например:
CH2- |
CH-CH3 |
+ HNO3 |
|
|
|
|
NO2 |
||
|
|
||||||||
|
|
|
|
CH-CH-CH |
|||||
|
|
|
|
|
|
||||
|
|
|
- H2O |
|
3 |
||||
CH3 |
|
|
|
|
|
|
CH3 |
||
|
|
|
|
||||||
5. Нуклеофильным замещением атома галогена в боковой цепи при взаимодействии с нитритами можно получать не только -, но и -, - и т.д. замещѐнные нитросоединения, например:
Ar-CH2-CH2-Br + NaNO2 Ar-CH2-CH2-NO2 + NaBr
Эта реакция аналогична нуклеофильному замещению в галогеналканах
(гл. 3.2.2.1).
10.4.5. ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ И ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Ароматические нитросоединения угнетают нервную и особенно кровеносную систему, нарушая снабжение организма кислородом. Метаболизм
514
нитросоединений связан с окислительно-восстановительными реакциями, и в частности с окислительным фосфорилированием.
Нитробензол — бесцветная или светло-жѐлтая жидкость с запахом горького миндаля; температура плавления 6 С, температура кипения 211 С. Плохо растворим в воде. Является нервным и кровяным ядом.
Нитробензол является одним из важнейших продуктов органического синтеза. Получают его нитрованием бензола. Объѐм мирового производства нитробензола измеряется сотнями тысяч тонн. Около 90% нитробензола расходуется на производство анилина.
Тринитротолуол (тол, тротил) — жѐлтое кристаллическое вещество с температурой плавления 80 С.
Получают нитрованием нитротолуолов. Является одним из наиболее распространѐнных взрывчатых веществ.
Пикриновая кислота (2,4,6-тринитрофенол) — жѐлтое кристаллическое вещество с температурой плавления 123 С. Малорастворима в воде.
Получают нитрованием фенола и нитрофенолов. Использовалась в качестве жѐлтого красителя. Еѐ соли термически нестабильны, при нагревании взрываются.
10.5. ФЕНОЛЫ. АРОМАТИЧЕСКИЕ СПИРТЫ. ХИНОНЫ
Фенолы и ароматические спирты являются гидроксильными производными ароматических углеводородов. В молекулах фенолов гидроксогруппа (одна или несколько) непосредственно связана с ароматическим кольцом, например
|
OH |
|
CH3 |
OH |
|
|
|
|
|
|
|
|
|
|
 OH
OH
OH ,
а в молекулах ароматических спиртов гидроксильная группа связана с одним из атомов углерода алифатической боковой цепи арена, например
CH2-OH |
CH2-CH-OH |
|
CH3 . |
Этим фенолы принципиально отличаются от ароматических спиртов.
515
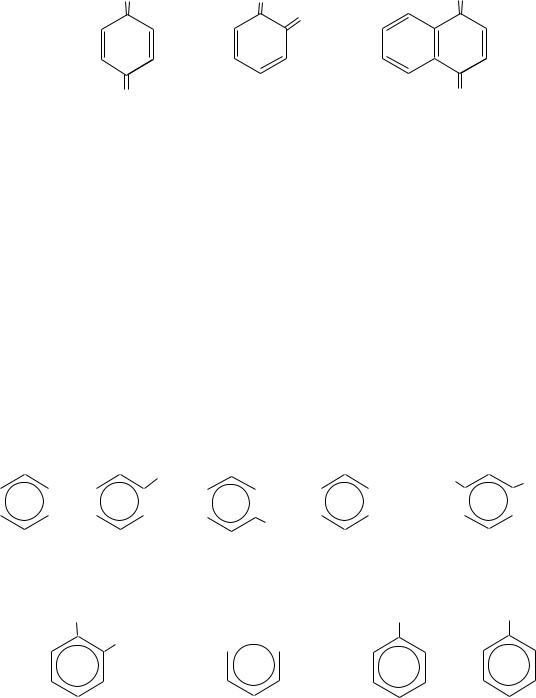
Хинонами называют моно- и полициклические соединения с двумя двойными связями и двумя карбонильными группами в шестичленном цикле, например:
O O O
O
O O
10.5.1.КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ ФЕНОЛОВ И АРОМАТИЧЕСКИХ СПИРТОВ
Взависимости от количества гидроксогрупп, входящих в молекулу фенолов, их классифицируют на одноатомные и многоатомные (двухатомные, трѐхатомные и т.д.).
Для наиболее простых по строению и широко распространѐнных фенолов употребительными являются тривиальные названия. Так, фенолом называют родоначальника ряда, а крезолами (орто-, мета- и пара-) — соответствующие метилпроизводные фенола, имеются тривиальные названия и для некоторых замещѐнных фенолов и их производных (простых эфиров фенолов):
OH |
|
OH |
|
OH |
OH |
|
OH |
|||||||||
|
|
|
|
|
CH3 |
|
|
|
|
(H3C)3C |
|
|
|
C(CH ) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
3 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|||||
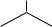
фенол |
о-крезол |
|
м-крезол п-крезол |
|
|
ионол |
||||||||||
|
CH3-CH-CH3 |
|
|
OH |
|
|
|
OCH3 |
|
OC2H5 |
||||||
OH O2N
 NO2
NO2
|
|
|
|
|
|
CH3 |
NO2 |
|
|
||
тимол |
пикриновая кислота |
анизол |
фенетол |
||
Двухатомные и трѐхатомные фенолы тоже имеют тривиальные названия. Например:
516
|
OH |
|
|
OH |
|
|
|
|
|
HO |
OH |
OH |
OH |
|
|
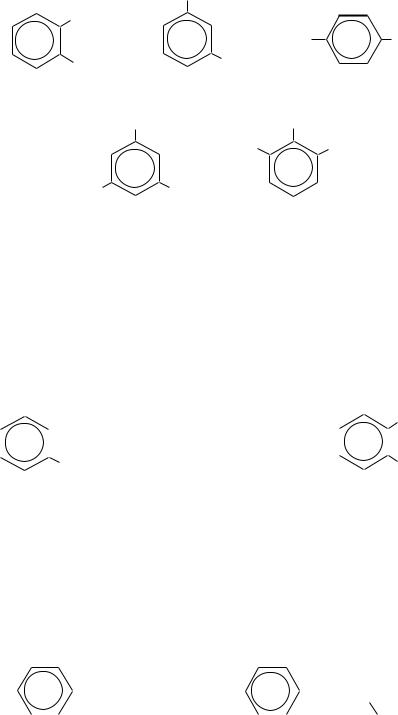
пирокатехин |
резорцин |
|
гидрохинон |
|
OH |
OH |
|
|
HO |
|
OH |
HO |
OH |
|
|
флороглюцин |
пирогаллол |
||
Для систематического названия фенолов применяется заместительная номенклатура ИЮПАК, согласно которой фенолы рассматриваются как гидроксильные производные бензола. Так, сам фенол, родоначальник ряда, должен иметь строгое название гидроксибензол. Однако во многих случаях производные бензола, содержащие гидроксогруппу в кольце, рассматриваются как производные фенола, что и отражается в названии. Например:
|
OH |
|
OH |
||||
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
Br |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
NO2 |
||
3-этилфенол |
3-бром-2,4-динитрофенол |
||||||
(1-гидрокси-3-этилбензол) |
(1-гидрокси-3-бром-2,4-динитробензол) |
||||||
Для ароматических спиртов названия по заместительной номенклатуре строятся так же, как и для алифатических. При этом родоначальной структурой является боковая алифатическая цепь, так как там находится функциональная группа. Например:
|
|
|
CH2-OH |
|
|
|
CH2-CH-OH |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
CH3 |
фенилметанол |
1-фенилпропан-2-ол |
||||||
Кроме того, для названия ароматических спиртов, так же как и алифатических, могут применяться радикало-функциональная и рациональная номенклатуры. Так, фенилметанол, простейший представитель ароматических спиртов, по радикало-функциональной номенклатуре получит название бен-
зиловый спирт.
517

Фенолы и ароматические спирты являются структурными изомерами (например, крезолы изомерны бензиловому спирту). Кроме того, могут наблюдаться и другие виды изомерии, так же как и для многих производных углеводородов.
10.5.2. СТРОЕНИЕ ФЕНОЛА И БЕНЗИЛОВОГО СПИРТА
В молекуле фенола природа и направленность элек- |
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
||||
тронных эффектов такая же, что и в галогенобензолах. То |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
H |
|
есть, атом кислорода гидроксогруппы взаимодействует с |
|
|
|
|
|
|
|
|
||
|
I |
|||||||||
бензольным кольцом посредством –I- и +М-эффектов. |
|
|
|
|||||||
+M |
|
|
||||||||
Однако (!) в молекуле фенола +М-эффект больше –I- |
|
|
||||||||
|
|
|
|
|
|
|
|
|
||
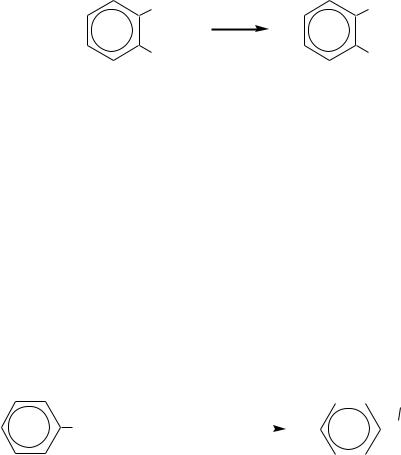
эффекта (по модулю). Значительный положительный мезомерный эффект объясняется соответствием геометрической конфигурации внешних (взаимодействующих) р-орбиталей углерода и кислорода, оба этих атома — это атомы II периода Периодической таблицы химических элементов. В результате суммарный электронный эффект, которым обладает гидроксогруппа по отношению к бензольному кольцу, — это донорный эффект.
За счѐт р- -сопряжения увеличивается степень двоесвязанности между углеродом и кислородом: эта связь имеет 23.7 % -характера. Строение фенола должно быть сходно также со строением несуществующего винилового спирта (гл. 5.1.2, 5.3.1). Но в отличие от винилового спирта фенол не изомеризуется благодаря устойчивой ароматической системе.
Длина связи C–О в феноле меньше, чем в спиртах (в феноле 0.136 нм, в метаноле 0.143 нм), а прочность этой связи больше, чем в спиртах. Кроме того, вследствие р- -сопряжения на атоме кислорода появляется дефицит электронной плотности (частичный положительный заряд), за счѐт которого увеличивается полярность связи О–Н настолько, что фенолы проявляют свойства слабых кислот.
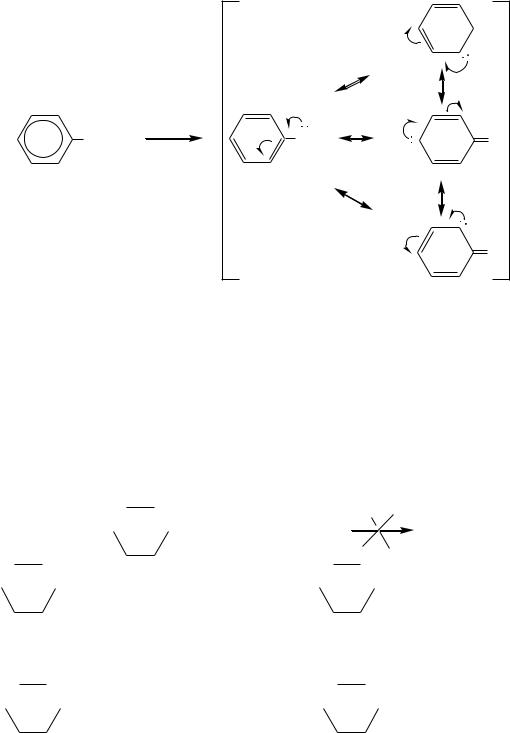
Положительный мезомерный эффект гидроксогруппы приводит к значительному увеличению электронной плотности на бензольном кольце и главным образом в о- и п-положениях (гл. 10.1.1). Этому состоянию отвечает мезоформула
'+
OH
- 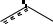




 -
-
+M
-
518

 O
O
-
O-H |
|
O - |
- |
O |
- H + |
|
|||
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
O |
Однако кислотные свойства фенолов выражены слабее, чем у карбоновых кислот, диссоциация фенолов в водных растворах протекает, но равновесие этой реакции смещено влево. Значение рКа для фенола и его гомологов лежит в пределах от 9.9 до 10.4, в то время как для уксусной кислоты рКа = 4.76, а для угольной рКа = 6.35 (по первой ступени диссоциации). То есть фенол не взаимодействует с гидрокарбонатами металлов, но может взаимодействовать со средними солями угольной кислоты, превращая их в кислые соли, так как по второй ступени диссоциации угольная кислота слабее фенола.
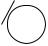
 OH + NaHCO3
OH + NaHCO3
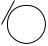
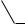 OH + Na2CO3
OH + Na2CO3 
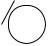
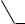 ONa + NaHCO3
ONa + NaHCO3
Соли фенола, феноляты, при взаимодействии с угольной кислотой превращаются в фенол:
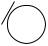
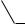 ONa + H2CO3
ONa + H2CO3 
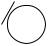
 OH + NaHCO3
OH + NaHCO3
Введение электронодонорных или акцепторных заместителей в ароматическое кольцо фенола (особенно в о- и п-положениях) соответственно понижает или повышает его кислотные свойства. Это влияние аналогично действию заместителей на ароматическое кольцо сульфокислот (гл. 10.3.3.4). Так же, как и в аренсульфокислотах, электроноакцепторные заместители увеличивают кислотные свойства за счѐт более полной делокализации отрицательного заряда в анионе; электронодонорные заместители, наоборот,
520

