- •1.1 Аминокислоты
- •1.1.1 Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •1.1.2 Классификация природных аминокислот
- •1.1.3 Физико - химические свойства природных аминокислот
- •1.1.4 Качественная реакция обнаружения аминокислот
- •1.1.5 Химические свойства аминокислот
- •1.2 Полипептиды и белки
- •1.2.1 Определения « пептид» «белок» Биологические функции пептидов и белков
- •1.2.2. Классификация белков
- •1.2.3 Первичная структура белка
- •1.2.4 Вторичная структура белка
- •1.2.5 Третичная структура
- •1.2.6 Четвертичная структура
- •1.2.7 Физико-химические свойства белка Амфотерность - кислотно- основные
- •1.2.8 Электрофорез белков
- •1.2.9 Денатурация белка
- •1.2.10 Качественные реакции обнаружения белков в биологических объектах.
- •Незаменимые аминокислоты обозначены звездочкой*
- •1.3 Внутриклеточные посредники ( мессенджеры) передачи сигналов
- •1.3.1 Циклические нуклеотиды
- •2.1.1. Окислительно-восстановительные реакции биоорганических соединений
- •2.2. Карбоновые кислоты и их производные – участники реакций цикла Кребса
- •2.2.1 Цикл Кребса
- •2.2.2. Физико-химические и химические свойства in vivo карбоновых кислот – субстратов цикла Кребса
- •2.2.3 Биоактивные вещества -ингибиторы цикла Кребса
- •2.2.4 Строение макроэргических соединений
- •2.2. 5 Строение коферментов оксидоредуктаз
- •3.1 Классификация углеводов: пищевые и природные углеводы
- •3.1.2 Моносахариды
- •3.1.3 Химические превращения моносахаридов in vivo
- •3.2 Олигосахариды
- •3.2.2 Нередуцирующие дисахариды
- •5. 4 Строение витамина в6 и механизм реакции с его участием
- •5.5 Медико - биологическое значение аминокислот
- •5.6 Строение, физмко-химические свойства мочевины.
- •5.7 Азотистые т основания- производные пиримидина (урацил, тимин, цитозин)
- •5.8 Азотистые основания- производные пурина( аденин, гуанин)
- •5.9 Нуклеотиды
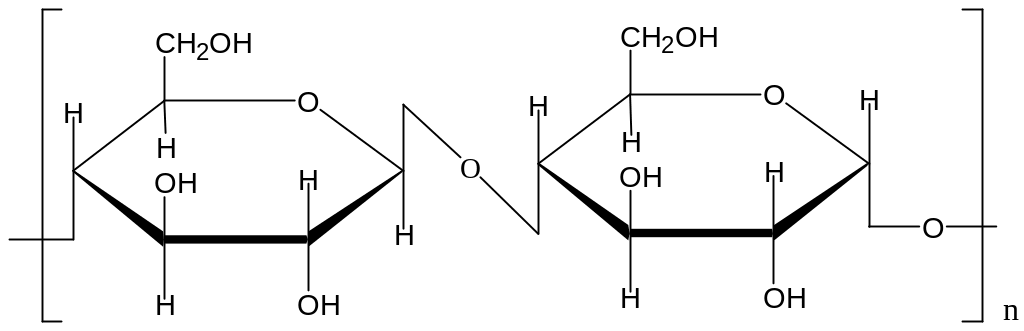
3.2 Олигосахариды
В клетках животных и растений присутствуют углеводы, которые образуются в результате соединения мономерных звеньев моносахаридов.
Олиго- и полисахара отличаются количеством мономерных звеньев:
олигосахара содержат до 10-12 моносахаридов, углеводы с большим числом звеньев относят к полисахаридам. Соединение моносахаридов происходит путем реакции поликонденсации, выделяется вода, образуются гликозидные связи.
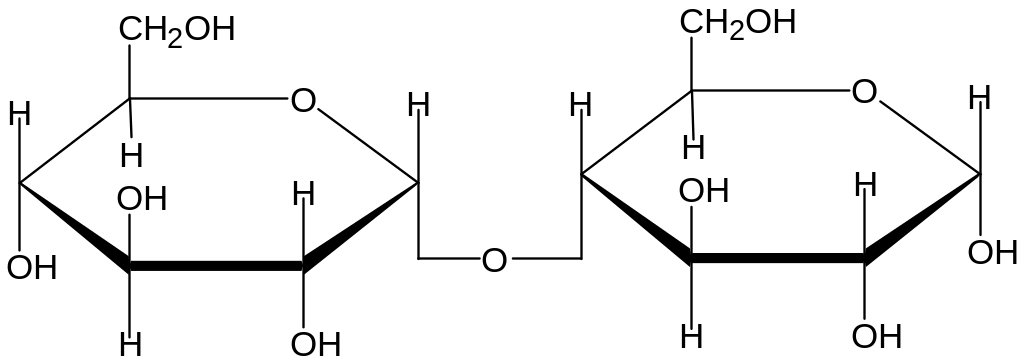
3.2.1 Олигосахариды. Дисахариды
Дисахариды- наиболее распространенные и важные в биологическом плане представители олигосахаридов.
Дисахариды классифицируют по составу и способности к реакции окисления ( редуцирующие свойства )
В растениях в составе сока присутствует дисахарид сахароза, его добывают для пищевой промышленности из сахарного тростника или сахарной свеклы (тростниковый или свекловичный сахар). В молоке животных и женском молоке находится дисахарид лактоза.
При переваривании полисахаридов в качестве промежуточных соединений образуются дисахариды : из крахмала - мальтоза , из целлюлозы - целлобиоза.
Состав сахарозы, лактозы, маннозы, целлобиозы С12 Н22 О11. В кислой среде они гидролизуются с образованием моносахаридов.
С12 Н22 О11 + Н2О ——> С6 Н12 О6 + С 6Н12О6
Наиболее важные дисахариды, их состав, типы гликозидных связей. Способность к окислению представлены в нижеприыеденной таблице.
Природные дисахариды
Дисахарид |
Продукты гидролиза
|
Тип гликозидной связи |
Способность к дисахарида окислению |
сахароза |
а-глюкоза и β- фруктоза |
1-а, 2- β |
нередуцирующий |
а-лактоза |
а- галактоза и глюкоза |
а –(1,4 ) |
редуцирующий |
β- лактоза |
β –галактоза и глюкоза |
β -( 1,4) |
редуцирующий |
мальтоза |
а-глюкоза и а- глюкоза |
а –(1,4) |
редуцирующий |
3.2.2 Нередуцирующие дисахариды
Сахароза. Систематическое название О- а- D-глюкопиранозил-(1,2) - β – D – фруктофуранозид.
Твердое кристаллическое вещество, хорошо растворимо в воде, не растворимое в спирте, растворяется в водно-спиртовой смеси. Это основной пищевой углевод, относится к так называемым « легкоусвояемым углеводам», которые быстро и легко всасываются , Сахароза гидролизуется в полости рта и желудочно -кишечном тракте, образуются моносахариды глюкоза и фруктоза, которые всасываются в кровь и вызывают быструю ответную реакцию выделения гормона инсулина. В полости рта сахароза способствует развитию микрофлоры, способствующей возникновению кариеса. Гидролиз сахарозы не происходит в щелочной среде, но достаточно растворенного в воде углекислого газа, чтобы вызвать гидролитический распад на моносахариды.
Сахароза не относится к восстанавливающим ( редуцирующим) дисахаридам, так как полуацетальный ( аномерный) гидроксил глюкозы участвует в образовании гликозидной связи с фруктозой, у которой , в свою очередь, также участвует гликозидная гидроксильная группа.
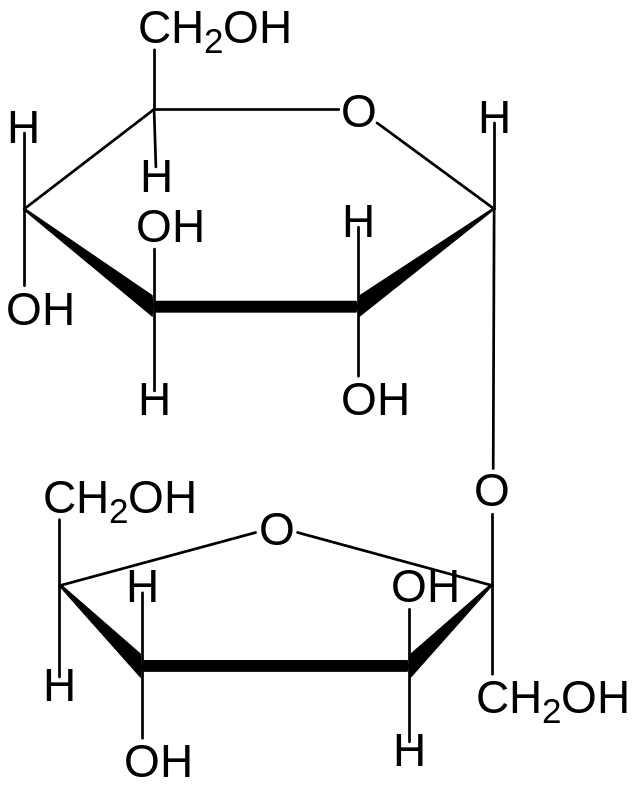
связь гликозидная ( 1- а, 2-β )
Сахароза не реагирует ни с реактивом Фелинга, ни с реактивом Толленса.
При гидролизе сахарозы образуется смесь двух моносахаридов и изменяется направление плоскости поляризованного луча света раствором. Сахароза вращает вправо
[а ] = + 66,50, при гидролизе образуется равная смесь глюкозы [а ] = + 59,70 и фруктозы
[а ] = -92,30. , направление вращения становится левым ( -92,30+ 59,70 = -32,60)
Смесь D-глюкозы и D-фруктозы, образующаяся при гидролизе сахарозы, носит название «инвертный сахар». Процесс гидролиза можно зафиксировать появлением качественной реакции на свободную глюкозу.
Сахароза широко применяется в пищевой промышленности, производстве спиртов (сорбита, маннита), пищевого этанола , искусственного меда, подсластитель в составе лекарственных препаратов.
Трегалозы
Невосстанавливающие дисахариды, построенные из остатков D-глюкозы, связанных между собой гликозидной связью, которая образована из полуацетальных гидроксилов обеих молекул глюкопиранозы. Возможно образование трех различных трегалоз: а,а ; β,β; а, β . В природе существует только а,а-изомер ( грибной сахар ). Систематическое название: а-D –глюкопиранозил-а-D-глюкопиранозид. Встречается в низших и высших грибах ( шампиньоны), дрожжах, водорослях, лишайниках, насекомых( саранча).
Трегалоза – кристаллическое соединение, хорошо растворима в воде, плохо- в большинстве органических растворителях, Водные растворы не мутаротируют. Медленно и трудно переваривается в кишечнике человека в составе пищи.
3.2.3 Редуцирующие дисахариды.
Лактоза – молочный сахар
Лактоза – кристаллическое соединение, по сравнению с сахарозой значительно хуже растворима в воде и в 4-5 раз менее сладкая В природе известны два вида лактозы : а- лактоза и β – лактоза. В женском грудном молоке содержится β – лактоза, а в коровьем и других домашних животных, чье молоко применяют в пищу, а- лактоза
Систематическое название а- лактозы : 4-О- а –D-галактопиранозил- D-глюкопираноза.
-
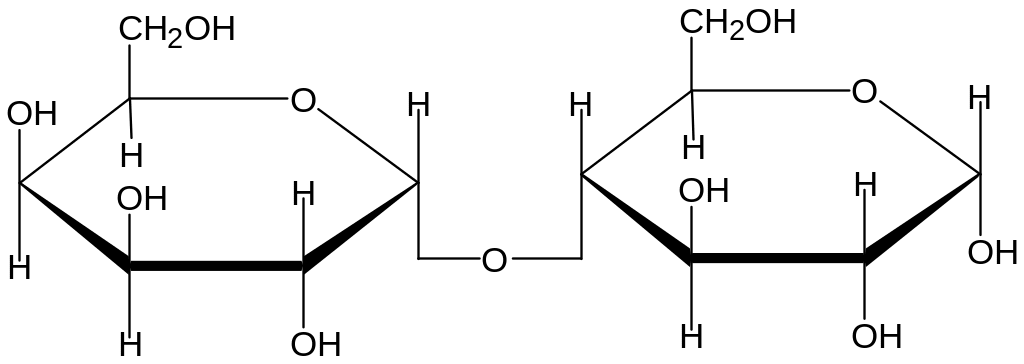 а-Лактоза( связь а-1,4 )
а-Лактоза( связь а-1,4 )
Систематическое название β- лактозы : 4-О-β –D-галактопиранозил- D-глюкопираноза
Из названия следует, что галактоза предоставляет для связи гликозидный гидроксил, а глюкоза сохраняет его и способность окисляться или восстанавливаться. Лактоза- редуцирующий дисахарид. При окислении лактозы , как и других дисахаридов , образуется бионовая кислота. В даннм случае она носит название - лактобионовая.
-
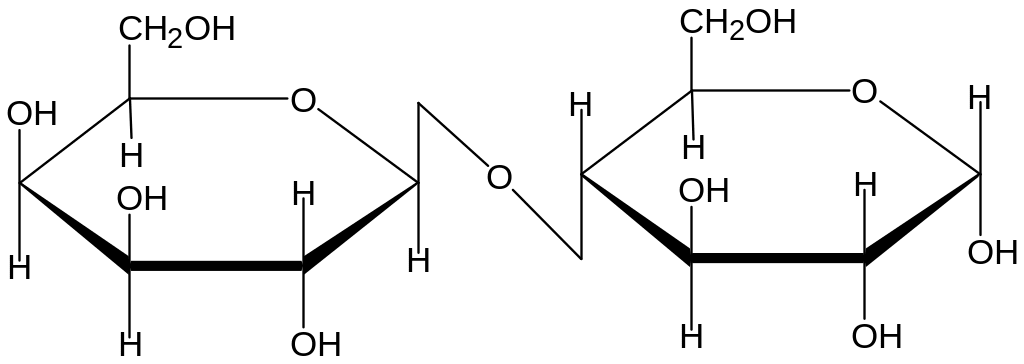 β-Лактоза ( связь β-1, 4 )
β-Лактоза ( связь β-1, 4 )
Лактоза гидролизуется в тонком кишечнике под влиянием фермента лактазы. Существует два вида лактаз, которые избирательно действуют каждая на свой изомер лактозы – а-лактаза гидролизует только а-лактозу, β- лактаза гидролизует β-лактозу.
У новорожденного синтезируется только β- лактаза, поэтому легко усваивается лактоза материнского молока, а коровьего - значительно медленнее. Примерно к году жизни в соответствии с генетической программой развития организма продукция фермента β- лактазы прекращается.. Употребление в пищу коровьего молока стимулирует синтез нового белка-фермента - – а-лактазы, и ребенка можно полностью отлучать от груди.
(этот пример подтверждает теорию Жакоба и Моно лактозного оперона, которую изучают в курсе биологии).
Мальтоза (солодовый сахар)
Систематическое название О-а –D-глюкопиранозил-(1-4)-D-глюкопираноза. Твердое кристаллическое вещество, сладкое, хорошо растворимо в воде, нерастворимо в этаноле. В свободном состоянии содержится в соке некоторых растений.
Является основным продуктом гидролиза крахмала под действием фермента амилазы, который выделяется в составе сока поджелудочной железы. Амилаза слюны осуществляет гидролиз крахмала несколько иначе: образуются, в основном, молекулы олигосахаридов с большим числом звеньев - декстраны.
Мальтоза хорошо растворима в воде и нерастворима в этаноле. Гликозидная связь
( а- 1,4) - быстро гидролизуется в кислой среде и особыми ферментами мальтазми, которые имеются у микроорганизмов, растений, животных; у человека находятся в тонком кишечнике (пристеночное пищеварение).
эта глюкоза может быть в а-, β- аномерных формах,-и оксо-форме на рисунке изображен а-аномер
Мальтоза (гликозидная связь α-1,4 ) |
|
Мальтоза дает качественные реакции с реактивами Фелинга и Толленса, при окислении бромной водой превращается в мальтобионовую кислоту. Используется
мальтоза в микробиологии для
приготовления сред при идентификации
микроорганизмов, в пищевой и винной
промышленности.и
особыми ферментами- мальтазами.ся, в
основном, крупные
мол |
|
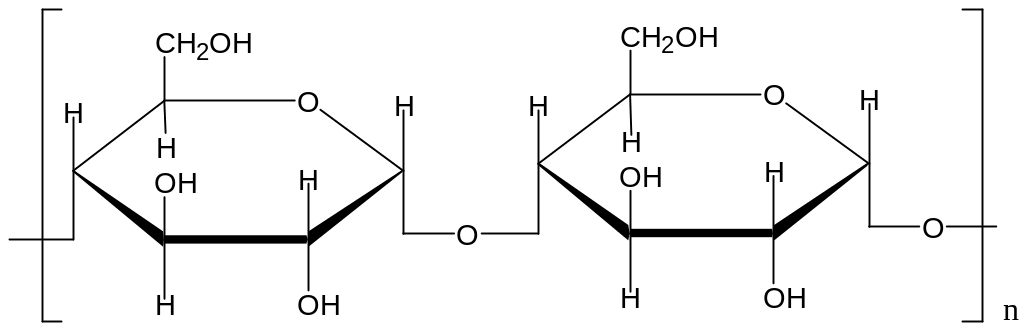
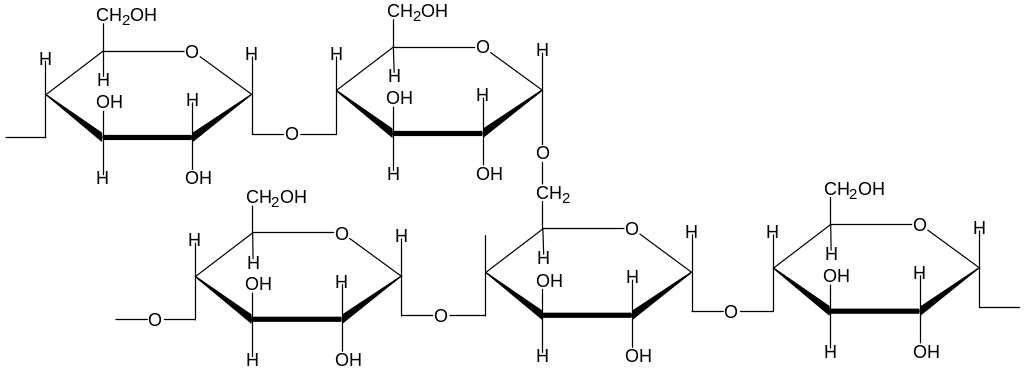
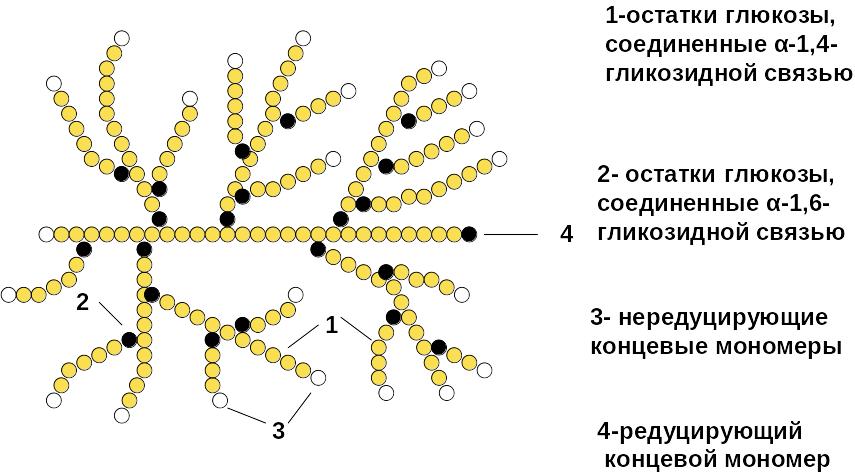
3.3. Полисахариды Полимеры, которые образованы моносахаридами и содержат до тысячи и более мономерных остатков. Полисахариды принято классифицировать на две группы: - гомополисахариды - гетерополисахариды. 3.3.1 Гомополисахариды Гомополисахариды состоят из одинаковых моносахаридных единиц (Х) n В природе наиболее распространены полимеры состава (С6 Н10О 5 ) n : * крахмал, гликоген, целлюлоза ( клетчатка ), которые построены из мономерных звеньев глюкопиранозы * инулин, построенный из мономерных звеньев фруктопиранозы Крахмал ( С6 Н10О 5 ) n Кристаллическое вещество, хрустящий при растирании порошок (крахмальные гранулы). Основной резервный полисахарид растений. Обычно при обсуждении крахмала указывают его биологический источник: картофельный, рисовый, маисовый (кукурузный) крахмал. Это связано с тем, что разные виды крахмала отличаются степенью поликонденсации, соотношением фракций. Крахмал содержится в корнях, клубнях, листьях, семенах растений. В составе крахмалов могут присутствовать две различные фракции :амилоза и амилопектин. Амилоза- линейный полимер , ее макромолекулы состоят из 200-1000 молекул а- D -глюкопиранозы, которые соединены между собой а-1,4- гликозидными связями. Редуцирующий полуацетальный гидроксил находится в составе той молекулы глюкопиранозы, которая является последней в полисахаридной цепи крахмала. Поэтому амилоза не обладает редуцирующими свойствами- на длинную полисахаридную цепь приходится лишь одна концевая альдегидная(полуацетальная) группа. Молекулярная масса амилозы от 32 000 до 160 000. Макромолекула амилозы свернута в спираль, на одном витке спирали размещается 6 пиранозных циклов.
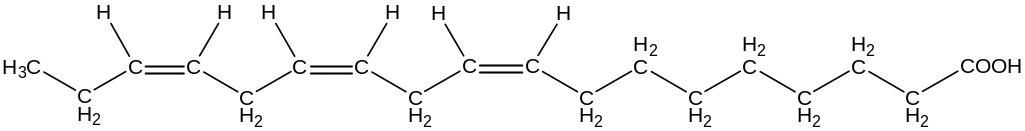
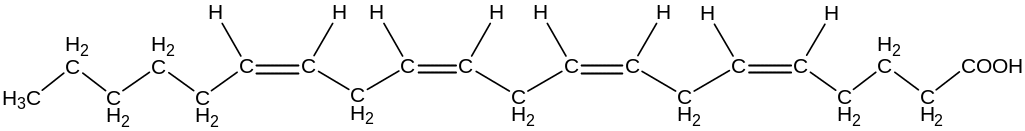
Жидкокристаллическое состояние мембраны обозначают термином «текучесть». Биологические и физико-химические свойства мембран ухудшаются при появлении транс-изомеров полиненасыщенных кислот, продуктов окисления двойных связей в составе этих кислот, при частичном гидролизе фосфолипидов и белков. В тоже время перечисленные превращения входят в обязательный комплекс изменений, связанных с процессами адаптации к меняющимся условиям среды существования организма.
Дисциплинарный модуль 4 Обмен белков, аминокислот, нуклеотидов в организме человека Для успешного усвоения этой темы необходимо Знать -классификацию белков по составу, строению третичной структуры, биологической ценности для организма человека, -заменимые и незаменимые аминокислоты, - особенности химического и пространственного строения (стереоизомерию) аминокислот , присутствующих в организме человека и продуктах питания, физические свойства, -химические свойства аминокислот, определяющие их биологическую активность in vivo. -физические и химические свойства биоактивного вещества мочевины, конечного продукта обмена аминокислот в организме -физические и химические свойства , явление таутомерии азотистых оснований пуринового и пиримидинового ряда, мочевой кислоты. -структурные формулы нуклеозидов, нуклеотидов, Уметь - записать структурные формулы изучаемых аминокислот, мочевины, азотистых оснований, нуклеозидов и нуклеотидов, образованных азотистыми основаниями. -составить схемы реакций декарбоксилирования, переаминирования (трансаминирования) -написать реакцию окислительного дезаминирования глутаминовой кислоты
Ключевые слова к теме: |
Аденин, аминокислота, амфотерность, буферный раствор, витамин В6, гипоксантин, гуанин, дезаминирование, декарбоксилирование, изоэлектрическая точка, ксантин, мочевина, мочевая кислота, нуклеозид, нуклеотид, окислительное дезаминирование, основание Шиффа (азометин), пептид (полипептид), пептидная группа, переаминирование (трансаминирование), стереоизомер, стереоряд, тимин, урацил, цитозин, энантиомер.
5.1 Номенклатура, классификация природных аминокислот (Примечание. Общий список природных аминокислот, структурные формулы представлены на стр. 17-20)
Аминокислоты - большой класс органических соединений. характерным признаком которых является наличие в составе молекулы двух функциональных групп- карбоксильной и аминогруппы. Особую группу составляют природные аминокислоты. Их условно можно разделить на 2 группы:
- аминокислоты , которые участвуют в образовании пептидов и белков. Для них характерно только а- строение и все принадлежат к L – стереоряду.
- аминокислоты, которые обладают биологической активностью, но не являются мономерами природных полимеров белков и пептидов.
Природные а –L - аминокислоты – мономеры полипептидов и белков.
Обычно выделяют около 20 природных аминокислот , из которых образуется все множество природных белков растительного и животного происхождения.
Единый генетический код природы определяет единство аминокислотного состава белков.
Номенклатура природных аминокислот: применяются тривиальные названия.
Природные аминокислоты классифицируют по нескольким признакам:
1) биологическому : в отношении обмена веществ в организме человека различают два вида аминокислот
заменимые( синтезируются в клетках человека) :
аланин, аргинин, аспарагиновая кислота, глицин, глутаминова кислота,
гистидин, пролин, серин, тирозин, цистеин,
незаменимые( не синтезируются в клетках человека, должны поступать с продуктами
питания) :
валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин
Для детей дополнительно незаменимыми являются аргинин и гистидин.
2) химическому , который связан со строением и составом радикала
3) физико- химическому, в основу которого положены кислотно- основные свойства:
различают нейтральные , кислые , основные аминокислоты.
5.2 Особенности пространственного и структурного строения
Природные аминокислоты относятся к L – стереоряду и имеют а- строение (это означает, что обе функциональные группы - амино- и карбоксильная - связаны с общим атомом углерода, который всегда оптически активный (за исключением глицина – аминоуксусной кислоты). Исследованию пространственного строения природных аминокислот посвящены фундаментальные работы Э.Фишера, П. Каррера.
R –C*H – COOH COOH NH2 - СН2- СООН
| | глицин
NH2 NH2 - *C – H
|
R L – стереоряд
5.3 Химические свойства аминокислот in vivo
Физические, химические, кислотно-основные свойства природных аминокислот обсуждались на стр.4 - 8 (Модуль1).
5.3.1 Декарбоксилирование
Общая реакция для всех природных а- аминокислот , в которой участвуют ферменты декарбоксилазы при участии витамина В6. Образуются вещества с выраженной биологической активностью – биогенные амины.
R – CH – COOH фермент декарбоксилаза
| ————> R – CH2 - NH2 + CO2
NH2 В6 биогенный амин
Аминокислота
Синтез важнейших биоактивных соединений связан с декарбоксилированием серина, глутаминовой кислоты, гистидина , 5-окситриптофана, диоксифенилаланина ( в последнем случае образуется вначале дофамин, затем норадреналин и адреналин)
СН2 - СН- СООН ———> НО - СН2 – СН2 - NH2 + СО2
| | аминоэтанол( коламин)
OH NH2
серин
Аминоэтанол является предшественником в синтезе холина и медиатора ацетилхолина.
Аминоэтанол и холин входят в состав фосфолипидов: аминоэтанол – кефалина, холин-
лецитина.
фермент глутаматдекарбоксилаза
НООС- СН2 -СН2 -СН-СООН ———> НООС- СН2 -СН2 -СН2 -NH2 + CO2
| γ -аминомасляная кислота ( ГАМК)
NH2
глутаминоая кислота
4-Аминобутановая кислота (γ -аминомасляная кислота , ГАМК) - медиатор торможения ц.н.с.. применяется как лекарственный препарат( аминалон, гаммалон ). У экспериментальных животных недостаток витамина В6 сопровождается дефицитом образования нейромедиаторов и проявляется возникновением судорог, напоминающих эпилепсию .
5.3.2 Дезаминирование
Различают два вида дезаминирования : неокислительное и окислительное.
Неокислительное дезаминирование
Различают несколько видов неокислительного дезаминирования:
* элиминирование аминогруппы – получается непредельная кислота
* гидролитическое – аминокислота превращается в гидроксикислоту
* восстановительное – образуется насыщенная аминокислота
* трансаминирование (переаминирование). Представляет собой основное направление обмена аминокислот в организме человека.
Трансаминирование (переаминирование)
Эта чрезвычайно важная реакция, которая протекает во всех тканях организма человека, но особенно активно в печени, почке, миокарде, сводится к взаимопревращению двух различных аминокислоты и кетокислоты- образуются новая аминокислота и новая кетокислота. В результате трансаминирования вступают в обмен веществ аминокислоты, поступающие в составе белков, синтезируются заменимые кислоты.
R1 - CH –COOH + R2 – C- COOH ———> R 2 - CH –COOH + R1 – C- COOH
| | | <——— | | |
NH2 О NH2 О
аминокислота (1) кетокислота( 1) аминокислота(2) кетокислота( 2)
Наиболее важные пары :
аланин + щавелевоуксусная кислота <=== > ПВК + аспарагиновая кислота
аланин + а -кетоглутаровая кислота <===> ПВК + глутаминовая кислота
аспарагиновая кислота+ а –кетоглутаровая <=== >ЩУК + глутаминовая
кислота кислота
В составе катализаторов- ферментов обязательно присутствует витамин В6
Элиминирование аминогруппы
Реакция характерна для бактерий и грибов. Для примера можно привести превращение аспарагиновой кислоты в фумаровую
Н СООН
НООС- СН2-СН-СООН ———> > С = С < + NH3
| НООС Н
NH2 фумаровая кислота( транс-бутендиовая)
Окислительное дезаминирование
Рассмотрите внимательно еще раз схему трех наиболее важных реакций трансаминирования. В двух из них участвует а-кетоглутаровая кислота, а образуется глутаминовая. Для непрерывности процесса необходимо превратить обратно глутаминовую кислоту в а -кетоглутаровую. В клетках организма человека это происходит путем реакции окислительного дезаминирования.
В организме человека только глутаминовая кислота участвует в обратимой реакции окислительного дезаминирования, схема которой приведена ниже.
НООС-СН2-СН2 -СН-СООН + НАД + —> НООС-СН2-СН2-С-СООН + НАДН + Н+
| | |
NH2 NH
глутаминовая кислота иминоглутаровая
Далее иминоглутаровая кислота подвергается гидролизу , образуется кетоглутаровая кислота и аммиак
НООС-СН2-СН2-С-СООН + НОН —> НООС-СН2-СН2-С-СООН + NH3
| | | |
NH О
а-кетоглутаровая кислота

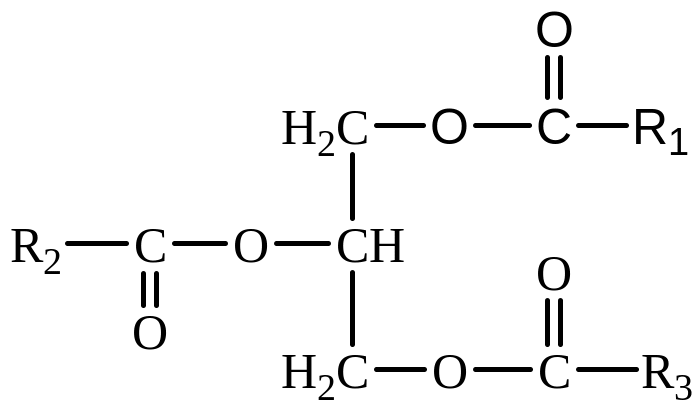
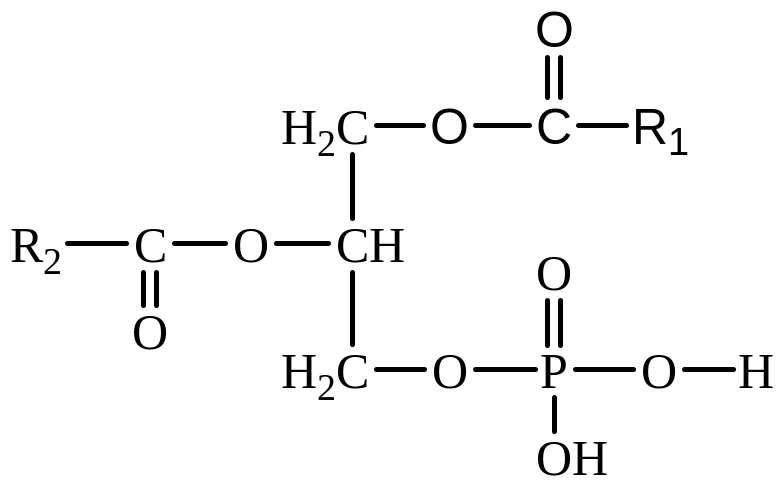
 полярная
часть, «полярная головка»
полярная
часть, «полярная головка» полярная часть
полярная часть Холестерин
Холестерин