
- •Кафедра фізичної та неорганічної хімії
- •Конспект лекцій
- •Херсон 2011
- •Оптичні методи аналізу
- •Фотометричний аналіз. Адсорбційна фотометрія
- •Закони поглинання світла
- •Полум'яна фотометрія
- •Атомізація в полум'ї
- •Атомізація в електротермічних атомізаторах
- •Люмінесцентний аналіз Загальна характеристика методу
- •Класифікація видів люмінесценції
- •Природа явища
- •Види люмінесценції
- •Енергетичний і квантовий виходи люмінесценції
- •Гасіння люмінесценції
- •Техніка проведення аналізу
- •Прилади
- •Рефрактометрія
- •Поляриметрія
- •Теоретичні основи мас-спектроскопії.
- •Апаратура для проведення мас-спектроскопії
- •Радіометричні методи аналізу
- •Електрохімічні методи аналізу кондуктометричний метод аналізу
- •Потенціометричне титрування (загальні прийоми)
- •Кулонометрический аналіз
- •Література
- •73008, М. Херсон, Бериславське шосе, 24
Закони поглинання світла
Оптичні методи аналізу ґрунтуються на взаємодії речовини з електромагнітним випромінюванням. Це випромінювання характеризується довжиною хвилі λ, відповідною енергією Е і частотою випромінювання υ.
Характеристику спектра електромагнітного випромінювання і процесів, що відбуваються в результаті поглинання чи випромінювання світла речовиною, наведено в таблиці нижче.
Спектральна ділянка |
Довжина хвилі λ,нм |
Енергія Е,еВ |
Процеси,що відбуваються внаслідок поглинання світла |
Ультрафіолетова: вакуумна ближня |
100-200 |
— |
Електронні переходи
|
200-350 |
100-10 |
||
Видима |
350-800 |
10-1 |
|
Інфрачервона: ближня дальня |
800-1500 |
1-0,01 |
Коливання молекул |
1,5х10³-1000000 |
1-0,01 |
Обертання молекул |
Як видно із наведеного електромагнітного спектра випромінювання, для збудження обертальних і коливальних рівнів молекули достатньо найменшої енергії випромінювання дальньої інфрачервоної ділянки спектра. Збудження ж електронних рівнів молекули відбувається під дією видимої та ультрафіолетової ділянки спектра, тобто за рахунок випромінювання з енергією близько 100-10 еВ. Зміна електронних рівнів молекули супроводжується також зміною її коливальної й обертальної енергії, тому при поглинанні молекулою ультрафіолетового випромінювання високої енергії спектр поглинання складається з широких смуг. Практично спектр поглинання,що відображає графічну залежність величини поглинання від довжини хвилі, можна дістати,якщо на шляху електромагнітного випромінювання помістити речовину, що поглинає промені певних довжин хвиль.
При проходженні монохроматичного пучка світла з інтенсивністю I крізь забарвлений розчин певна частина світла(І ) відбивається, інша (І ) – поглинається, а решта (І)- проходить крізь шар розчину:
![]()
Оскільки у фотометрії порівнюють розчин з однаковою товщиною шару, то величиною І можна знехтувати, тоді дістанемо:
![]()
Таким чином, світловий потік при проходженні крізь розчин втрачає частину своєї інтенсивності. Вчені П.Бугер і І.Ламберт встановили, що здатність розчину поглинати світло певної довжини залежить від товщини шару l і визначається за формулою:
![]()
де k-
коефіцієнт поглинання, який є сталою
величиною для певного розчину. Після
логарифмування одержимо: ![]()
Відношення
![]() називають оптичною густиною розчину і
позначають літерою D.
називають оптичною густиною розчину і
позначають літерою D.
Отже, 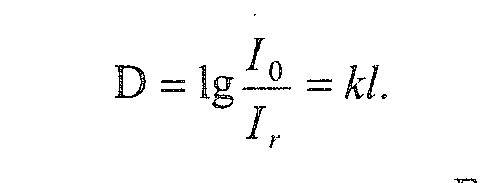
це рівняння є математичним виразом закону Бугера-Ламберта.
У 1862 р. А.Бер встановив зв'язок між інтенсивністю потоку світла та концентрацією речовини в розчині, який полягає в тому, шо поглинання світла прямо пропорційне кількості частинок (концентрації) речовини, крізь яку проходить світло.
Ця залежність відома під
назвою закону Бугера-Ламберта-Бера
і є основним законом поглинання світла
розчинами. В інтегральній формі цей
закон виражають рівнянням: ![]()
Після логарифмування: D=![]() ,
де k -
коефіцієнт пропорційності; С-концентрація
розчину; l-
товщина шару розчину.
,
де k -
коефіцієнт пропорційності; С-концентрація
розчину; l-
товщина шару розчину.
Коефіцієнт пропорційності
k- це показник
поглинання розчину з концентрацією і
товщиною шару, що дорівнює одиниці, є
характерним фізико-хімічним параметром
для кожної забарвленої речовини. Якщо
концентрація розчиненої речовини
становить 1 моль/дм³, то показник
поглинання розчину k
за товщиною шару розчину, що дорівнює
1 см, називається молярним коефіцієнтом
поглинання і позначають ε. Він є мірою
здатності речовини вбирати світло
певної довжини хвилі, залежить від
природи речовини і температури, дає
можливість оцінити чутливість
фотометричних методів. Величину молярного
коефіцієнта поглинання обчислюють за
результатами вимірювання оптичної
густини розчину за даної довжини
хвилі: ![]() .
.
Оптичну густину розчину з
масовою часткою розчиненої речовини,
що дорівнює 1% за товщини шару розчину
1 см, називають питомим коефіцієнтом
поглинання і позначають
![]() .
Його обчислюють за формулою:
.
Його обчислюють за формулою:![]() ,
де ω – масова частка
розчиненої речовини, %.
,
де ω – масова частка
розчиненої речовини, %.
Отже, оптична густина розчину залежить від концентрації речовини, її природи і товщини шару розчину, крізь який проходить світло.
Графічна залежність оптичної густини від концентрації виражається прямою лінією, що проходить через початок координат.
Щоб мати спектральну характеристику забарвленої речовини, потрібно одержати експериментально спектр поглинання, що є графічною залежністю оптичної густини D від довжини хвилі λ. Спектрограма є індивідуальною характеристикою речовини, що поглинає світло, її використовують для якісного аналізу та визначення кількісного вмісту її в розчині. За спектром поглинання можна вибрати оптимальну довжину хвилі для аналітичного визначення речовини, причому найбільша чутливість відповідає максимуму світло поглинання.
З рисунку електронного спектру поглинання видно, що смуга поглинання характеризується трьома основними параметрами: максимумом поглинання, довжиною хвилі, що відповідає максимуму поглинання і ефективною шириною смуги 2 σ.
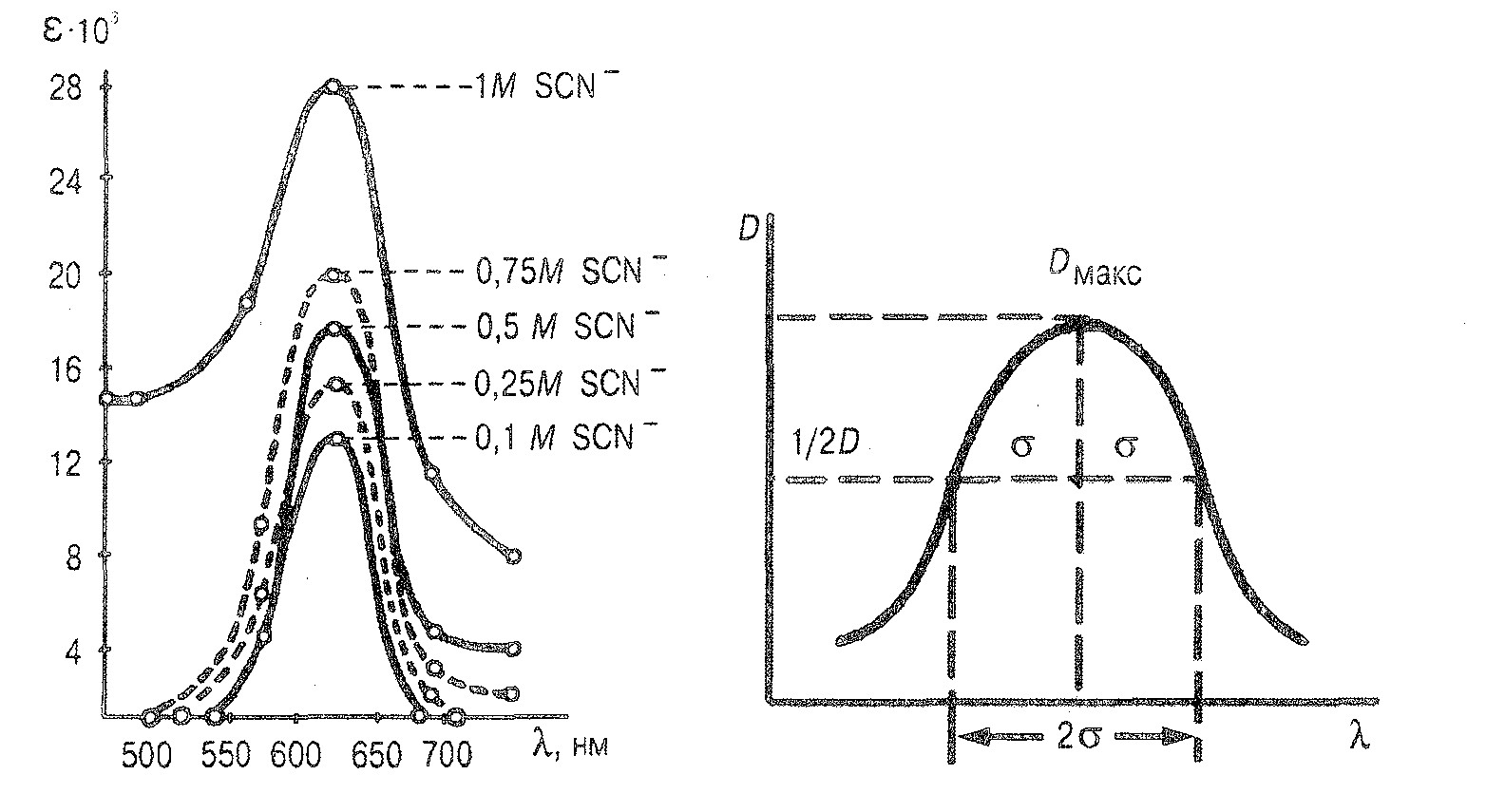
Перший малюнок – це спектр поглинання водно-ацетонового розчину тіоціанатного комплексу кобальту. Другий малюнок –це електронний спектр поглинання забарвленої сполуки в розчині.
Важливим чинником у фотометрії, що впливає на чутливість визначення оптичної густини розчину, є правильний вибір світлофільтра. Світлофільтр вибирають так, щоб його максимум пропускання збігався зі спектральною ділянкою максимального поглинання променів забарвленим розчином. Тобто, світлофільтр повинен максимально пропускати тільки ту ділянку спектра, яка поглинається розчином досліджуваної речовини.
Відношення інтенсивності потоку випромінювання, що пройшов крізь досліджуваний розчин, до інтенсивності початкового потоку випромінювання називають прозорістю, або пропусканням, і позначають літерою Т:
![]()
Пропускання – це частина падаючого світла, яке пройшло крізь розчин. Оптична густина і пропускання пов’язані між собою таким співвідношенням:
![]()
Якщо пропускання Т виразити у відсотках,то
![]()
Із закону Бугера-Ламберта-Бера випливає, що для однієї й тієї самої речовини за однакової оптичної густини розчинів їх концентрації обернено пропорційні товщина шару розчинів, що поглинають світло.
![]()
Отже, за однакової інтенсивності забарвлення двох розчинів однієї й тієї самої речовини концентрації розчинів обернено пропорційні товщині шару рідини.
Вимоги до кольорових реакцій:
1) забарвлення сполуки має відбуватися швидко;
2) одержана сполука повинна мати сталий склад і достатньо інтенсивне забарвлення;
3) забарвлення має бути стійким і не руйнуватися під дією світла;
4) інтенсивність забарвлення розчину має підпорядковуватися закону Бугера -Ламберта-Бера.
Правила приготування забарвлених розчинів:
1. До стандартного і досліджуваного розчинів добавляють однакові реактиви в тій самій послідовності і в однакових кількостях.
2. Забарвлені розчини, як стандартний, так і досліджуваний, готують одночасно.
3. Об’єми стандартного й досліджуваного розчинів мають бути однаковими.
4. Забарвлення досліджуваного й стандартного розчинів порівнюють за однакових умов.
Залежно від способу вимірювання інтенсивності поглинання світла забарвленими сполуками метода фотометричного аналізу поділяють на дві групи: візуальні (колориметричні) та фотоелектроколориметричні.
У колориметрії порівняння інтенсивності забарвлення стандартного та досліджуваного розчинів здійснюють шляхом зміни концентрації (методи стандартних серій, розбавляння та колориметричного титрування), товщини шару розчинів (метод зрівнювання) або інтенсивності світлового потоку (метод діафрагм). Однак слід визначити, що візуальну колориметрію нині практично не використовують, вона має лише теоретичне та історичне значення.
Фотоелектроколориметричні методи дають можливість виміряти інтенсивність поглинання світла за допомогою спеціальних приладів – фотоелектроколориметрів (ФЕК) або спектрофотометрів (СФ). Усі ФЕКі складаються з освітлювача, світлофільтрів, систем регулювання опорів, мікроамперметра. У комплекс також входить набір спеціальних кювет.
Принцип вимірювання світло поглинання забарвлених розчинів за допомогою таких приладів полягає в тому, що потік світла, який проходить крізь кювету з розчином або розчинником, потрапляє на фотоелемент і перетворюється на електричну енергію, що вимірюється.
Принцип роботи фотоелектроколориметра можна розглянути на прикладі КФК-2. Він призначений для вимірювання коефіцієнтів пропускання і оптичної густини довжин хвиль від 315 до 980 нм та визначення на підставі цих даних концентрацій речовин у розчинах. Пучок світла від лампи 1 проходить крізь конденсор 2, діафрагму 3, об’єктиви 4,5 і світлофільтри 6,7,8. Кювету 10 з досліджуваним розчином вводять у світловий потік між захисними стеклами 9,11. Пластина 13 розподіляє світловий потік на два потоки: один потрапляє на фотодіод 12, другий –на фотоелемент 14.
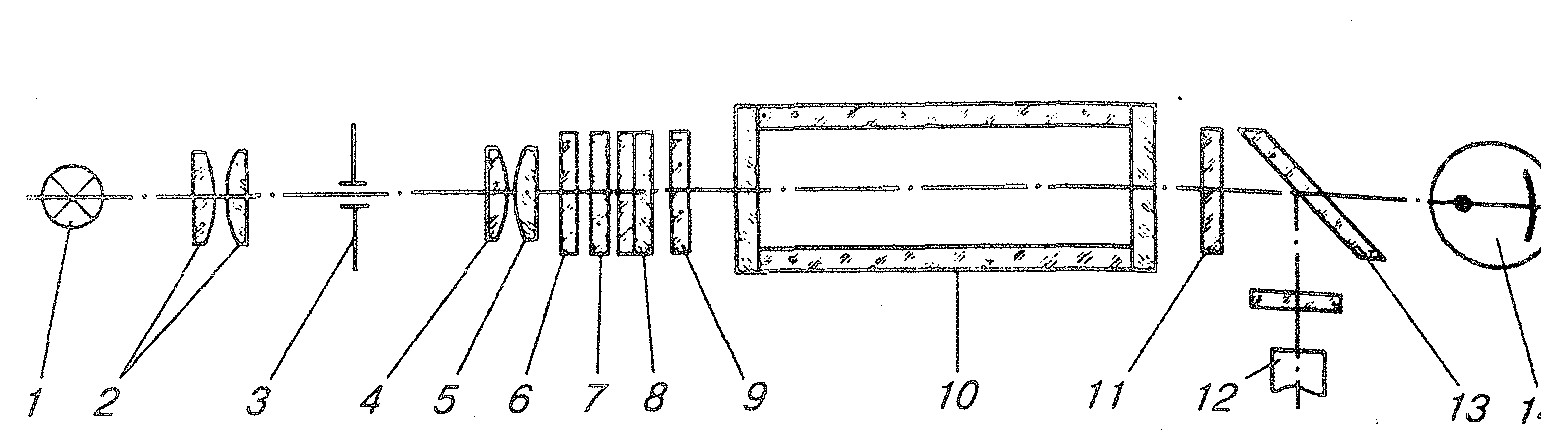
Ф отоприймачі
працюють у різних ділянках спектра:
фотоелемент у ділянці 315-540 нм; фотодіод
- у ділянці 590-980 нм. Підключення
фотоприймачів здійснюється перемикачем,
який має шість положень. У перших трьох
положеннях (1-3), позначених чорним
кольором, працює фотоелемент, а трьох
інших (1-3), позначених червоним кольором,
- фотодіод. Струм фотоприймача підсилюється
і подається на вимірювальний прилад
(мікроамперметр), що фіксує струм, сила
якого пропорційна інтенсивності
світлового потоку, що проходить крізь
досліджуваний розчин.
отоприймачі
працюють у різних ділянках спектра:
фотоелемент у ділянці 315-540 нм; фотодіод
- у ділянці 590-980 нм. Підключення
фотоприймачів здійснюється перемикачем,
який має шість положень. У перших трьох
положеннях (1-3), позначених чорним
кольором, працює фотоелемент, а трьох
інших (1-3), позначених червоним кольором,
- фотодіод. Струм фотоприймача підсилюється
і подається на вимірювальний прилад
(мікроамперметр), що фіксує струм, сила
якого пропорційна інтенсивності
світлового потоку, що проходить крізь
досліджуваний розчин.
Визначення концентрації речовини у розчині слід проводити в такій послідовності: вибір світлофільтра; вибір кювети; побудова калібрувального графіка для даної речовини; вимірювання оптичної густини досліджуваного розчину та визначення концентрації речовини в розчині.
Вибір світлофільтра. Наявність у колориметрі вузла світлофільтра і набору кювет дає змогу підібрати таку їх комбінацію,за якої похибка у визначенні концентрації буде найменшою. Вибір світлофільтрів проводять так. У кювету наливають розчин і визначають його оптичну густину при всіх наявних світлофільтрах. За одержаними даними будують криву залежності оптичної густини розчину від довжини хвилі,що відповідає максимуму коефіцієнта пропускання світлофільтрів, і відмічають ділянку кривої, де оптична густина має максимальне значення. Світлофільтр для роботи вибирають такий,щоб довжина хвилі,яка відповідає максимуму його коефіцієнта пропускання, припадала на відмічену ділянку спектральної кривої досліджуваного розчину.
Вибір кювети. Попередній вибір кювет проводять візуально, відповідно до інтенсивності забарвлення розчину. Якщо розчин інтенсивно забарвлений, слід користуватися кюветами з малою робочою довжиною і навпаки. Заздалегідь підібрану кювету наливають розчин і вимірюють його оптичну густину. Значення оптичної густини розчину має становити 0,3-0,5, у разі одержання інших значень беруть кювету з більшою робочою довжиною, якщо D<0,3, і меншою, - якщо D>0,5.
Побудова калібрувального графіка для даної речовини. Для побудови калібрувального графіка готують низку розчинів досліджуваної речовини з відповідними концентраціями. Забарвлені стандартні розчини повинні бути виготовленні за тих самих умов, що й забарвлені розчині досліджуваної речовини. За допомогою фотоелектроколориметра вимірюють оптичну густину всіх розчинів і будують калібрувальний графік, відкладаючи на осі абсцис значення молярної концентрації розчину,а на осі ординат-відповідні їм значення оптичної густини.
Калібрувальний графік будують окремо для кожної досліджуваної речовини. У разі заміни кювети потрібно будувати інший калібрувальний графік, оскільки оптична густина змінюється зі зміною товщини шару l, крізь який проходить пучок світла.
Визначення концентрації речовини. Для визначення концентрації речовини готують її забарвлений розчин і вимірюють його оптичну густину. У деяких випадках зазначають час, що минув від приготування забарвленого розчину до початку вимірювань. Потім за калібрувальним графіком знаходять концентрацію, що відповідає виміряному значенню оптичної густини.
Під час проведення несерійних аналізів концентрацію досліджуваної речовини можна визначити шляхом порівняння оптичних густин стандартного й досліджуваного розчинів. Під час вимірювання оптичної густини в обох випадках застосовують однаково приготовлені розчини порівняння.
Вміст досліджуваної речовини обчислюють за формулою:
Сд = Сст · Dд/Dст,
де Dст – оптична густина стандартного розчину, Dд – оптична густина проби, Сст – концентрація стандартного розчину, Сд – концентрація проби.
Концентрацію речовини можна обчислити і за рівнянням калібрувального графіка, який пов’язує значення оптичної густини розчину D зі значення її концентрації С рівнянням прямої лінії:
![]() ,
,
де
![]() -оптична
густина розчину за нульової концентрації
досліджуваної речовини,
-оптична
густина розчину за нульової концентрації
досліджуваної речовини,
![]() -кутовий
коефіцієнт, який дорівнює tgα
(α – кут
нахилу прямої). Коефіцієнти
і
розраховують методом найменших квадратів
за експериментальними даними вимірювання
оптичної густини розчинів. Після
розрахунків параметрів
і
та їх інтервальних значень для визначення
невідомої концентрації С виконують
кілька вимірювань оптичної густини D,
обчислюють середнє значення оптичної
густини D
і за рівнянням
-кутовий
коефіцієнт, який дорівнює tgα
(α – кут
нахилу прямої). Коефіцієнти
і
розраховують методом найменших квадратів
за експериментальними даними вимірювання
оптичної густини розчинів. Після
розрахунків параметрів
і
та їх інтервальних значень для визначення
невідомої концентрації С виконують
кілька вимірювань оптичної густини D,
обчислюють середнє значення оптичної
густини D
і за рівнянням
![]() визначають концентрацію С.
визначають концентрацію С.
УФ-спектрофотометрія набула значного поширення і використовується для вивчення структури, якісного аналізу органічних речовин та їх кількісного визначення.
Спектроскопія у видимій та Уф-ділянках спектра є одним із важливих і доступних методів аналізу. Його широко застосовують для аналізу багатьох органічних речовин, барвників, лікарських препаратів, контролю за перебігом технологічних процесів, у медичних та біологічних дослідженнях.
Поглинання світла в УФ-ділянці спектра зумовлене змінами електронного стану молекул,тому спектри вбирання у видимій та ультрафіолетовій ділянці називаються електронними. Вони характерні для певних класів органічних речовин,оскільки поглинання УФ-випромінювання пов’язане з переходом валентних електронів одинарних і кратних зв’язків та електронів неподільних пар гетерероатомів, спостерігаються електронні переходи, для яких потрібна більша енергія, і тому вони знаходяться в межах вакуумного ультрафіолету. Атоми або групи атомів, які здатні поглинати світло, називаються хромофорами. Ароматичні амінокислоти (триптофан,тирозин і фенілаланін) є основними хромофорами.
ІЧ-спетрофотометрію широко використовують для ідентифікації, встановлення будови та кількісного визначення речовини, оскільки ІЧ-спектри мають багато смуг поглинання, які характеризують кожний тип зв’язку або функціональну групу. Метод ґрунтується на вивченні коливальних та обертальних спектрів поглинання в ІЧ-ділянці спектра. Виникнення спектра пов’язане з коливанням атомів у молекулі,тобто ІЧ-спектри зумовлені переходами між двома коливальними рівнями молекули.
У спектрах цього типу виявлені коливання, що супроводжуються зміною дипольного моменту молекули.
Коливання за яких змінюється довжина хімічних зв’язків,називається валентними і позначають літерою υ. Якщо під дією ІЧ-випромінювання змінюється кути між зв’язками,такі коливання називаються деформаційними і позначають δ. Отже,кожна хімічна сполука має свій характерний спектр поглинання в ІЧ –ділянці спектра. Експериментально ІЧ – спектри речовини у різних агрегатних станах вивчають за допомогою приладів, які називають ІЧ-спектрофотометрами.
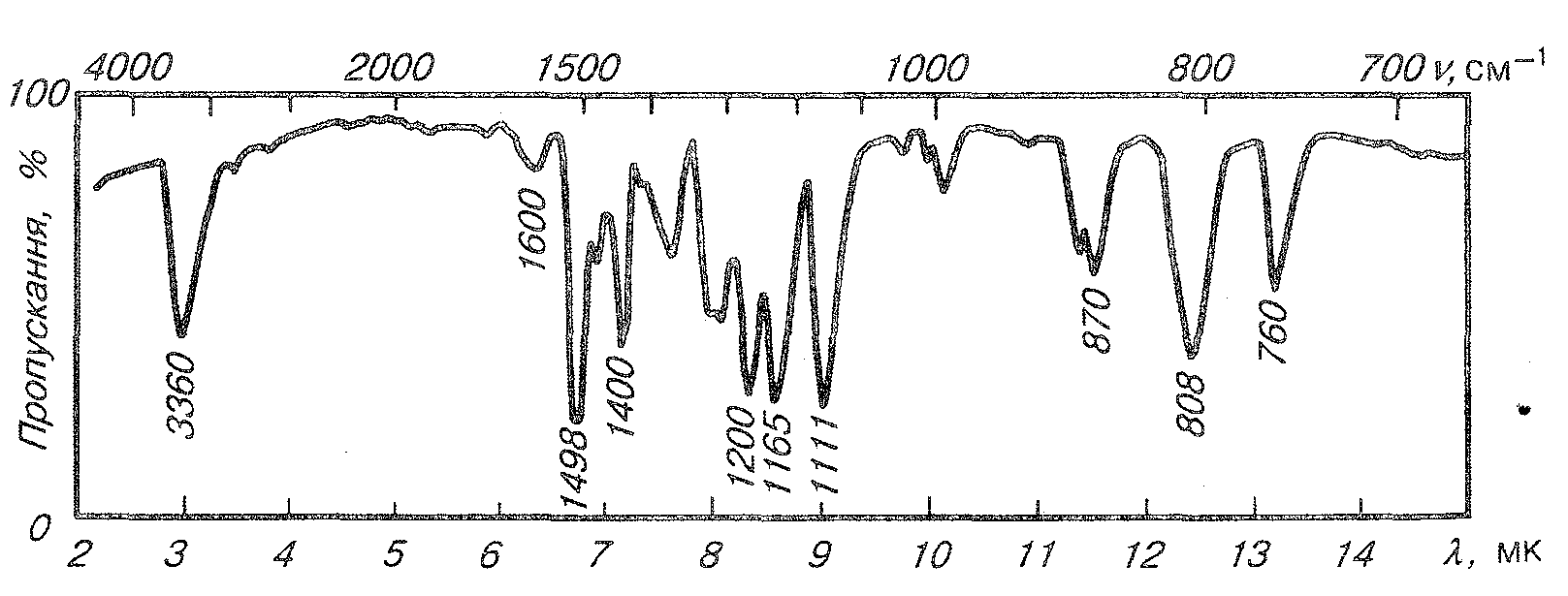 ,
,
ІЧ-спектр поглинання 2-метил-4-хлорфенолу.
Використання фотометричних методів у виноробстві
Спектрофотометричні методи аналізу, зокрема диференціальна спектрофотометрія і спектрофотометричне титрування, характеризуються високою точністю визначення (отн. похибка становить від +0,1 до + 0,5%). Ці методи широко використовуються в дослідженнях, пов'язаних з проведенням агротехнічних заходів, спостережень за розвитком виноградної лози і дозріванням винограду; вивченням складу елементів виноградного куща, а також біохімічних перетворень під час переробки винограду, формування і дозрівання виноматеріалів і т.д. За допомогою спектрофотометрічних методів визначають активність ферментів винограду і дріжджів, зміст і склад фенольних, азотистих, пектинових речовин, полісахаридів, інтенсивність забарвлення вина, зміст і склад високомолекулярних речовин і ін, вони використовуються при вивченні процесу теплової обробки вин, коньяків, карбоніл-амінних реакцій.
