
- •Кафедра фізичної та неорганічної хімії
- •Конспект лекцій
- •Херсон 2011
- •Оптичні методи аналізу
- •Фотометричний аналіз. Адсорбційна фотометрія
- •Закони поглинання світла
- •Полум'яна фотометрія
- •Атомізація в полум'ї
- •Атомізація в електротермічних атомізаторах
- •Люмінесцентний аналіз Загальна характеристика методу
- •Класифікація видів люмінесценції
- •Природа явища
- •Види люмінесценції
- •Енергетичний і квантовий виходи люмінесценції
- •Гасіння люмінесценції
- •Техніка проведення аналізу
- •Прилади
- •Рефрактометрія
- •Поляриметрія
- •Теоретичні основи мас-спектроскопії.
- •Апаратура для проведення мас-спектроскопії
- •Радіометричні методи аналізу
- •Електрохімічні методи аналізу кондуктометричний метод аналізу
- •Потенціометричне титрування (загальні прийоми)
- •Кулонометрический аналіз
- •Література
- •73008, М. Херсон, Бериславське шосе, 24
Електрохімічні методи аналізу кондуктометричний метод аналізу
Кондуктометричний метод аналізу заснований на залежності концентрації досліджуваних речовин від електропровідності електролітів. Цим методом можна визначати тільки електроліти, слабкі й сильні. Електропровідність є зростаючою функцією від концентрації. У дуже розведені (ідеальних) розчинах ця залежність линейна:
χ = k·З, де χ – електропровідність розчину (каппа), ДО – коефіцієнт пропорційності, що залежить від природи електроліту, З – концентрація електроліту. У концентрованих розчинах залежність більше складна й не підкоряється закону лінійності.
Вимір електропровідності рідини проводять із використанням змінного струму звукової частоти в межах 20–20000 Гц. У прецизійні (точних) методах застосовують частоти порядку кілька тисяч Гц. У більше простих пристроях застосовують низькі частоти – промислова частота 50 Гц. Кондуктометрические методи, у яких застосовують більші частоти на рівні телевізійного віщання (МГц), звуться високочастотні. Методи з використанням низьких частот називають низькочастотні. Для вимірів низькочастотними методами використовують мости змінного струму (міст Кольрауша).
Схема мосту змінного струму (Кольрауша), що працює на промисловій частоті:
R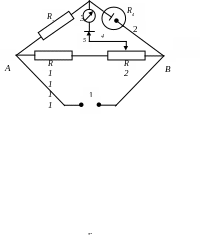 4
– опір осередку; R3
– набір опорів, що дозволяють міняти
діапазон вимірів; R1,
R2
– опір з точно відомим значенням. Міст
дозволяє вимірювати опори розчинів
електролітів порядку 0,3–30000 Ом. Робоча
область показань мосту ділиться на
п'ять меж вимірів. Чим нижче вимірюваний
опір, тим менше треба встановлювати
опір порівняльного плеча мосту.
4
– опір осередку; R3
– набір опорів, що дозволяють міняти
діапазон вимірів; R1,
R2
– опір з точно відомим значенням. Міст
дозволяє вимірювати опори розчинів
електролітів порядку 0,3–30000 Ом. Робоча
область показань мосту ділиться на
п'ять меж вимірів. Чим нижче вимірюваний
опір, тим менше треба встановлювати
опір порівняльного плеча мосту.
Відношення плечей (R1/R2) може плавно регулюватися.
Міст грубо врівноважують обертанням рукояток плеча порівняння й реохорда, а потім ставлять нуль-інструмент (гальванометр постійного струму) у положення "точно" і обертанням рукоятки реохорда зрівнюють міст. Погрішність вимірів опорів у межах 0, 3-30 Ом не перевищує 5 %, а в межах 30-3000 Ом – не більше 1,5 %. Постійний струм для визначення електропровідності застосовувати небажано, тому що на електродах у цьому випадку будуть проходити електродні процеси (електроліз), що викликають електрохімічну поляризацію електродів (виділення на електродах різних продуктів електролізу). Така поляризація спотворює результати вимірів. При використанні змінного струму величина цієї поляризації тим менше, чим вище його частота, тому в приладах високої точності використовують високі частоти.
Аналітичні методи ділять на 2 групи:
1. Прямий метод заснований на безпосереднім визначенні електропровідності розчину. Для цього готовлять стандартні розчини з точно відомою концентрацією й вимірюють їхню електропровідність.
Б удують
графік залежності χ від З електроліту.
Електропровідність сильно залежить
від температури, тому при проведенні
аналізу створюють умови, щоб температура
залишалася постійної, для цього
використовують термостати. При їхній
відсутності знімають графічну залежність
електропровідності (?) від концентрації
(З) при різних температурах, тобто при
кожній температурі одержують свої
ізотерми. Вимірюють електропровідність
досліджуваного розчину й за графіком
знаходять його концентрацію.
удують
графік залежності χ від З електроліту.
Електропровідність сильно залежить
від температури, тому при проведенні
аналізу створюють умови, щоб температура
залишалася постійної, для цього
використовують термостати. При їхній
відсутності знімають графічну залежність
електропровідності (?) від концентрації
(З) при різних температурах, тобто при
кожній температурі одержують свої
ізотерми. Вимірюють електропровідність
досліджуваного розчину й за графіком
знаходять його концентрацію.
Як прилад, де використовується пряме визначення електропровідності, служить солемер. З його допомогою визначають щільний залишок у паровому конденсаті. Його використовують при аналізі якості дистильованої води в медицині й в аналітичній хімії. Зміст щільного залишку в перерахуванні на Na2SO4 у гарній якісній дистильованій воді не повинне перевищити 5 мг/л.
2. Кондуктометрическое титрування використовують, якщо досліджувані розчини пофарбовані й застосування звичайних індикаторів важко, тому що фарбування розчину маскує фарбування індикатора. Метод заснований на одержанні кривої залежності електропровідності від кількості доданого титранта. Розглянемо три випадки кондуктометрического титрування.
Титрат - речовина, що досліджують. Титрант - це речовина, якою титрують.
Титрування сильної кислоти сильною підставою. Титрат - HCl, титрант -NaOH.
1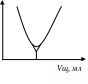 /R У
крапці А електропровідність максимальна,
за рахунок повної дисоціації титранта
(HCl). У міру додатка титранта (по 0,5 мол)
кількість іонів Гідрогену зменшується
в результаті зв'язування гидроксид-іонами
лугу з утворенням малодиссоциирующего
речовини (H2O).
/R У
крапці А електропровідність максимальна,
за рахунок повної дисоціації титранта
(HCl). У міру додатка титранта (по 0,5 мол)
кількість іонів Гідрогену зменшується
в результаті зв'язування гидроксид-іонами
лугу з утворенням малодиссоциирующего
речовини (H2O).
HCl + NaOH = NaCl+ H2O ; H+ + OH– = H2O.
Внаслідок зменшення концентрації самого рухливого іона Гідрогену (H+) електропровідність зменшується [АЭ].
У крапці еквівалентності (т.Э) всі іони Гідрогену зв'язані, тобто вся кислота оттитрована й електропровідність у цій крапці сама мінімальна.
Ця крапка при даному виді титрування виражена чітко. У міру додатка титранта на відрізку [ЭВ] збільшується електропровідність за рахунок збільшення концентрації іонів ВІН– (це другі по рухливості іони після іона Гідрогену). Цей графік не симетричний. Відрізок [АЭ] більше різкий, а [ЭВ] більше пологий.
2) Титрування слабкої кислоти сильною підставою. Титрат – CH3COOH, титрант -NaOH.
1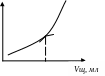 /R У
крапці А електропровідність мінімальна,
тому що ступінь дисоціації слабкої
кислоти менш 3 %, отже, іонів Гідрогену
мало. На ділянці [АЭ] у міру додатка
титранта (луг по 0,5 мол) відбувається
реакція нейтралізації з утворенням
солі слабкої кислоти (натрій ацетату),
що є більше сильним електролітом, чим
CH3COOH.
/R У
крапці А електропровідність мінімальна,
тому що ступінь дисоціації слабкої
кислоти менш 3 %, отже, іонів Гідрогену
мало. На ділянці [АЭ] у міру додатка
титранта (луг по 0,5 мол) відбувається
реакція нейтралізації з утворенням
солі слабкої кислоти (натрій ацетату),
що є більше сильним електролітом, чим
CH3COOH.
CH3COOH + NaOH = CH3COONa + H2O;
CH3COOН + Na+ + ВІН– = CH3COO– + Na+ + H2O.
За рахунок появи цих іонів незначно збільшується електропровідність на ділянці [АЭ]. У крапці Э CH3COOH повністю оттитрована. У цьому випадку крапка еквівалентності виражена не чітко й перебуває графічно по дотичних у крапці перегину. На ділянці [ЭВ] концентрація збільшується за рахунок збільшення концентрації гидроксид іонів.
3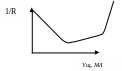 ) Кондуктометрическое
титрування суміші сильної й слабкої
кислот.
) Кондуктометрическое
титрування суміші сильної й слабкої
кислот.
Титрат – HCl + CH3COOH, титрант -NaOH. У крапці А максимум електропровідності за рахунок дисоціації сильної кислоти. На ділянці [АЭ1] у міру додатка лугу титрується сильна кислота. У крапці еквівалентності Э1 вся кислота HCl оттитрована й це крапка відповідає об'єму еквівалентному Vэ1.
На ділянці [Э1Е2] у міру додатка NaOH титрується слабка кислота. На цій ділянці електропровідність незначно збільшується за рахунок утворення сильного електроліту - натрій ацетату.
У крапці Э2 CH3COOH повністю оттитрована й ця крапка відповідає загальному об'єму лугу, пошедшему на титрування обох кислот. Кількість кислот розраховуємо по формулах:
υпр (HCl) = Vэ1·С(NaOH); υпр (CH3COOH) = Vэ2·С(NaOH), где Vэ2 = Vэ – Vэ1
На ділянці [Э2У] електропровідність збільшується за рахунок нагромадження гидроксид-іонів.
Високочастотне кондуктометрическое титрування
Метод заснований на вимірі електропровідності при частотах трохи Мгц. Істотна відмінність високочастотного титрування від низькочастотного полягає в тім, що електроди можна розташувати на зовнішніх стінках посудини - кондуктометрической осередку. Це відмінність важливо при роботі з агресивними середовищами (царська горілка, олеум). Цей метод точний і дає можливість виміряти електропровідність будь-яких середовищ.
ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДИ АНАЛІЗУ
Засновані на залежності потенціалу індикаторного електрода від концентрації потенциалопределяющих іонів.
Застосовують різні електродні системи й різні електроди.
Електроди I роду являють собою металеву пластину, занурену в розчин солі, що містить катіони цього металу. Формула Нернста зв'язує потенціал індикаторного електрода з концентрацією потенциалопределяющих іонів:
![]() ,
, ![]() ;
;
![]() ,
де φ0
–
стандартний електродний потенціал,
обмірюваний стосовно водневого електрода
при стандартних умовах; R – універсальна
газова постійна; Т – абсолютна температура;
F – число Фарадея (96485 Кл/моль); z – число
електронів, що беруть участь в елементарному
акті електрохімічної реакції.
,
де φ0
–
стандартний електродний потенціал,
обмірюваний стосовно водневого електрода
при стандартних умовах; R – універсальна
газова постійна; Т – абсолютна температура;
F – число Фарадея (96485 Кл/моль); z – число
електронів, що беруть участь в елементарному
акті електрохімічної реакції.
Електроди
II роду являють
собою метал, покритий важко розчинною
своєю сіллю й занурений у розчин солі,
що містить однойменні аніони солі. До
електродів другого роду відносять
хлоридсеребряный електрод, що представляє
собою срібну пластину або дріт, покритий
шаром AgCl і занурену в розчин КCl. Цей
розчин повідомляється з досліджуваним
розчином через сольовий місток або інше
пристосування, що утрудняє змішання
розчинів. Через азбестове волокно,
по-перше, здійснюється електролітичний
контакт із досліджуваним розчином, а
по-друге, завдяки великому гідродинамічному
опору азбесту не відбувається змішування
розчину КCl з досліджуваним розчином.
Формула Нернста має вигляд ![]() .
.
У
випадку окислювально-відновних систем,
коли відновлена й окислена форми
перебувають у розчині, електродний
потенціал благородного металу (платина),
зануреного в розчин цих іонів, буде
дорівнює:
![]() ,
де ox – окислена форма, red – відновлена
форма.
,
де ox – окислена форма, red – відновлена
форма.
Потенциометрические осередки являють собою електродну систему з електрода порівняння, потенціал якого не залежить від природи розчину, і індикаторного електрода, потенціал якого чутливий до природи яких-небудь іонів або розчинених речовин.
Як електроди порівняння в цей час використовують 2 типи електродів II роду: хлоридсеребряный (див. вище) і каломельний електрод. Каломельний електрод являє собою шар ртуті, покритий шаром каломелю Hg2Cl2, над яким перебуває розчин КCl. Контакт із зовнішнім середовищем здійснюється платиновим дротом. Розчин КCl контактує з досліджуваним через азбестове волокно. Як індикаторні електроди застосовують при визначенні окислювально-відновних систем – платинові, золоті електроди, електроди з вуглецевих матеріалів (стеклоуглерод). При вимірі рн і деяких лужних металів (натрій, кальцій ...) використовують мембранні електроди.
pХ = -lg c(Х+); де Х – природа речовини. Наприклад, pН = -lg c(H+).
Схема скляного електрода, використовуваного для виміру кислотності середовища.
Скляний
електрод – трубка з електропровідного
скла, що закінчується внизу кулькою з
дуже тонкою стінкою – мембраною. Зовнішня
частина мембрани контактує з досліджуваним
розчином. Електрод заповнений буферним
розчином (0,1 н розчин НСl із рН = 1,1). Контакт
із НСl здійснюють за допомогою
хлоридсеребряного електрода. Потенціал
скляного електрода:
![]() або
або
![]() .
Потенціал на мембрані реалізується в
результаті рівноважного процесу:
переходу іонів Li+
у розчин, а іонів Гідрогену Н+
у скло. Li+стік
+
H+розчин↔
Li+розчин+
H+стекло.
.
Потенціал на мембрані реалізується в
результаті рівноважного процесу:
переходу іонів Li+
у розчин, а іонів Гідрогену Н+
у скло. Li+стік
+
H+розчин↔
Li+розчин+
H+стекло.
Аналогічно
поводяться електроди зі скла, чутливі
до іонів Na+,
Ca2+,
Li+
і ін. Формула Нернста:
![]() або
або
![]() ,
х – іон, до якого чутлива мембрана.
Відомо багато іон-селективних
електродів, чутливих до різних катіонів
і аніонів. Недоліком
цих електродних систем є одночасна
чутливість до інших іонів.
,
х – іон, до якого чутлива мембрана.
Відомо багато іон-селективних
електродів, чутливих до різних катіонів
і аніонів. Недоліком
цих електродних систем є одночасна
чутливість до інших іонів.
Теоретичне обгрунтування потенціометричного методу аналізу
Потенціометричний аналіз належить до електрохімічних методів аналізу. Суть його полягає у вимірюванні потенціалу електрода, поміщеного в досліджуваний розчин. Потенціометричний аналіз був розроблений ще наприкінці 19 ст., після того, як В. Г. Нернст вивів рівняння, яке пов'язує величину потенціалу металічного електрода з концентрацією іонів цього ж металу у розчині:
![]()
де Ех - потенціал металічного електрода за даної концентрації іонів металу у розчині; Е0 - потенціал цього ж електрода у розчині з концентрацією іонів, рівній одиниці (1моль/л) - стандартний потенціал; С(ме) - концентрація іонів металу; R - газова стала (8,313 Дж); Т - абсолютна температура; F - число Фарадея (96500 К); n - заряд іона металу.
Якщо підставити в рівняння (1) відповідні значення R і Т (t = 25°С) і врахувати коефіцієнт переходу від натуральних логарифмів до десяткових (2,3026), то рівняння Нернста матиме такий вигляд:
![]()
Часто вимірювання проводять у розчинах, що містять іони одного і того самого металу в різних ступенях окиснення. У цих випадках застосовують інертний металічний електрод, частіше платиновий, потенціал якого залежить від співвідношення концентрацій окисненої і відновленої форм іонів:
![]()
Розглянемо, коли метал знаходиться в рівновазі з розчином своєї солі. Якщо металічну пластинку занурити в воду, деяка кількість металу з поверхні пластинки перетвориться на розчин. Цей процес проходить під впливом молекул води, котрі сприяють до відриву іонів металу від поверхні пластинки. Іони металу переходять в розчин, і поверхня металічної пластинки заряджається від'ємно за рахунок електронів, які знаходяться на поверхні пластинки.
Здатність іонів переходити в розчин залежить від природи металу, яка у різноманітних металів неоднакова. Якщо металічна пластинка занурена не в воду, а в розчин, який містить сіль цього металу, то й разом з переходом іонів в розчин відбувається і зворотний процес - іони металу з розчину переходять на пластинку. Між цими процесами швидко встановлюється рівновага. Якщо мідна пластинка занурена в розчин купрум (II) сульфату, то рівновагу в цьому випадку записують наступним чином:
![]()
Аналогічно для цинкової пластинки можна записати таке рівняння:
![]()
Ця рівновага динамічна. На межі металу і розчину неперервно відбувається обмін іонів, причому кількість іонів, котрі переходять в одиницю часу із металу в розчин, ті з розчину в метал, однакова.
Якщо з металу в розчин перейшли іони металу, то на поверхні металу утвориться надлишок електронів і металічна пластинка заряджається від'ємно. Від'ємні заряди на поверхні металу притягують додатно заряджені іони металу (катіони), які знаходяться в розчині. Катіони групуються на поверхні пластинки, утворюючи шар додатно заряджених частинок на самій поверхні металу. Таким чином, на межі між металом і розчином утворюється подвійний електричний шар, який можна порівняти з електричним конденсатором (одна обкладка - заряджена поверхня металу, інша - шар іонів на поверхні металу). Цей подвійний шар обумовлює виникнення так званого потенціалу електрода. Величина й знак цього потенціалу залежить від направлення та інтенсивності обміну іонів між пластиною (електродом) і розчином. Так як властивості пластинки з даного металу, наприклад цинку, в основному постійні, то потенціал в значній мірі залежить від властивості розчину, в тому числі від вмісту в ньому іонів, які приймають участь в обміні. Таким чином, значення електродного потенціалу зв'язане з концентрацією розчину, в якому знаходиться електрод.
Важкість визначення електродних потенціалів зв'язана з тим, що виміряти абсолютне значення потенціалу окремо взятого електрода неможливо. Щоб зробити вимірювання, цей електрод з'єднують провідником з іншим електродом і вимірюють різницю між ними. Другий електрод (його називають електродом також має потенціал. В якості електрода порівняння використовують водневий електрод, потенціал якого умовно приймають за нуль. Прийоми вибору нульових точок відомі з курсу фізики: наприклад, температура замерзання води умовно прийнята за нуль температури по шкалі Цельсія.
Таким чином, різниця потенціалів двох електродів - металічного і водневого - приймають умовно за потенціал металічного електрода. Ця різниця потенціалів зображує собою електрорушійну силу гальванічного елемента, утвореного двома напівелементами - металічним електродом, зануреним в досліджуваний розчин, та електродом порівняння, зануреним в стандартний розчин.
В подальшому, говорячи про електродний потенціал, ми будемо мати на увазі різницю потенціалів індикаторного електрода і електрода порівняння, тобто електрорушійну силу (ЕРС) електродної пари.
Електродні потенціали, які виникають при зануренні металу він. розчин його солі при 25°С, називають стандартними або нормальними. В таблиці 1 приведені стандартні потенціали деяких металів. В першій графі таблиці приведена реакція, яка відбувається на електроді і призводить до виникнення потенціалу.
Таблиця 1
Стандартні потенціали по відношенню до нормального водневого електрода
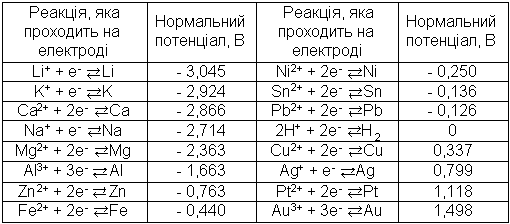
Всі реакції, які проходять на електродах, зображають собою реакції окиснення-відновлення, причому легкість їх проходження залежить від значення потенціалу. Чим більш від'ємний потенціал, тим легше метал віддає електрони, тим легше він окиснюється.
Значення потенціалу обумовлюють важливі хімічні властивості металів та їх іонів. Наприклад, метали, які володіють менш стандартними електродними потенціалами (більш електронегативні метали), слугують відновленню по відношенню до іонів металів з більшими потенціалами.
Якщо розташувати метали в ряд по зростанню стандартного електродного потенціалу, то вони утворять відомий з курсу неорганічної хімії електрохімічний ряд напруг. Всі метали, більш електронегативні, ніж водень, відновлюють іони водню до молекулярного.
Таким чином, можна зробити два висновки, важливих для практичної роботи:
- значення електродного потенціалу залежить від концентрації в розчині іонів, визначаючих потенціал, і від температури розчину; - для вимірювання потенціалу необхідно мати систему з двох електродів: робочого (індикаторного) та електрода порівняння.
Однак величини реальних електродних потенціалів, як правило, не співпадають з обчисленими. Це пояснюється тим, що на значення потенціалу впливають не тільки ті іони, котрі визначають потенціал, але й інші іони, присутні в розчині. Тому використовувати значення електродного потенціалу для визначення концентрації речовини в розчині практично неможливо.
В потенціометричному аналізі використовують не абсолютні значення електродних потенціалів, а зміну потенціалів в ході аналізу, наприклад при титруванні. На цьому і базується метод потенціометричного титрування. Отже, потенціометричне титрування - це титрометричний метод аналізу, але точку еквівалентності визначають не за допомогою кольорових індикаторів, а за характером зміни потенціалу електрода. Безпосередній розрахунок за значенням електродного потенціалу застосовується для визначення концентрації водневих іонів.
Потенціометричне титрування застосовують головним чином для визначення досить великих кількостей речовини. Порівняно з іншими методами потенціометричне титрування має такі переваги: 1) дає змогу титрувати забарвлені розчини (кольорові індикатори не придатні, як і колориметричний метод); 2) легко визначати кілька речовин у суміші без попереднього їх розділення. На кривій титрування у цьому разі з'являється кілька стрибків потенціалу, за якими знаходять кількість робочого розчину, витраченого на взаємодію з кожним компонентом складного розчину.
Вимірювання електродного потенціалу
Для вимірювання електродного потенціалу використовують систему з двох електродів. Один електрод - індикаторний - повинен бути чутливим до іонів, які знаходяться в розчині; потенціал, який виникає на ньому, залежить від концентрації цих іонів.
Вимоги до індикаторних електродів можуть бути різними в залежності від того, де вони використовуються - в абсолютній потенціометрії чи в потенціометричному титруванні. В обох випадках індикаторні електроди повинні бути оборотними, тобто їхній потенціал повинен змінюватися із зміною концентрації іонів металу в розчині відповідно до рівняння Нернста. Індикаторні електроди повинні бути хімічно стійкими по відношенню до речовин, які містяться у розчині. У методах кислотно-основного титрування необхідно виміряти концентрацію гідроген-іонів розчину. В аналітичній практиці використовують різноманітні індикаторні електроди в залежності від складу аналізуючого розчину - найчастіше водневі, хінгідронні та скляні.
Водневий електрод - це платинова пластинка, вкрита електролітичною губчастою платиною, яка насичена воднем. Під час занурення такого електрода у розчин з певною концентрацією гідроген-іонів між воднем, адсорбованим губчастою платиною, і іонами Гідрогену у розчині встановлюється рівновага, а потенціал електрода визначається рівнянням:
Еx = E0 + 0,058 lg[H+],
де Е0 - потенціал нормального водневого електрода.
Нормальним, або стандартним, водневим електродом називається водневий електрод, у якому платиновий провідник насичений воднем під тиском 101 кПа, занурений у розчин з концентрацією іонів Гідрогену 1 моль/л за температури 25°С.
Нормальний потенціал водневого електрода прийнято вважати рівним нулю, тому Еx = 0,058 lg [H+]. Звідси рН = Ex/0,058.
Водневим електродом можна вимірювати концентрацію іонів Гідрогену у широких межах: у кислих і лужних розчинах. Але водневий електрод має істотні недоліки в роботі: треба мати джерело водню, який необхідно старанно очищати, підтримувати його тиск, не можна використовувати у розчинах, що містять сильні окисники або відновники.
Хінгідронний електрод - це скляна посудина з платиновим електродом, зануреним у насичений розчин хінгідрону. Хінгідрон - малорозчинна молекулярна сполука хінону, яка у розчині розпадається на хінон і гідрохінон:
![]()
При вмиканні хінгідронного електрода в коло з будь-яким електродом порівняння, наприклад каломельним, на ньому відбувається реакція:
![]()
Потенціал такого електрода визначається рівнянням:
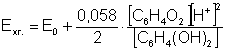
У розчині гідрохінону концентрації хінону і гідрохінону однакові, ось чому
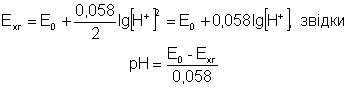
Таким чином, вимірюючи потенціал хінгідронного електрода, можна легко обчислити рН або концентрацію іонів Гідрогену розчину. Величина нормального хінгідронного електрода Е0 дорівнює 0,704 В.
В останні роки почали широко використовувати скляний електрод, що являє собою кульку з дуже тонкого спеціального скла, в яку наливають електропровідний розчин. У цей розчин занурюють срібну дротину, на поверхні якої наносять аргентум хлорид. Теорія скляного електрода дуже складна, тому обмежимося лише окремими даними. Електродна акція в ньому полягає в обміні іонами Гідрогену між рідкою фазою (рН якої вимірюється) і склом.
Потенціал скляного електрода перебуває у певній залежності від концентрації іонів Гідрогену, що дає змогу використовувати його для вимірювання рН.
Промисловість випускає велику кількість приладів для вимірювання потенціалів електродів компенсаційним методом. Це високоомні потенціометри постійного струму ППТВ, Р-307 та інші, лампові потенціометри ЛП-5, ЛП-58, ЛПУ-01, до яких додається інструкція щодо використання. Під час користування потенціометром ЛП-58 спеціальним перемикачем можна включити прилад для вимірювання різниці потенціалів в мілівольтах або в одиницях рН. Потенціометр (рН-метр) ЛПУ-1 використовується головним чином для вимірювання рН розчинів із скляним електродом.
Інший електрод - електрод порівняння - повинен бути нечутливим до іонів, які знаходяться в розчині; його потенціал постійний і не залежить від складу розчину.
Водневий електрод невигідний для виконання технічних вимірювань, тому в якості електрода порівняння використовують інший електрод, забезпечуючий достатньо постійний та відтворюючий потенціал, - найчастіше каломельний. Він являє собою систему металічна ртуть - розчин каломелі в розчині калій хлориду. Якщо використовують насичений розчин калій хлориду, електрод називають насиченим каломельним. В найбільш розповсюдженій зараз конструкції електрода ртуть і пасту каломелі розташовують у вузьку скляну трубку, закривають знизу пористою перегородкою. Трубка впаяна в скляний посуд, у який наливають насичений розчин калій хлориду. Такий електрод розташовують в аналізуючий розчин разом з індикаторним електродом. Для виконання електричного контакту каломельного електрода з аналізуючим розчином в нижній частині електрода є шліф з нещільно закріпленою скляною пробкою.
С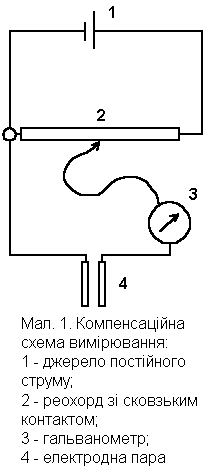 истема
з двох електродів, розташованих в
аналізуючому розчині, являють собою
гальванічний елемент, ЕРС котрого
дорівнює потенціалу, характеризуючого
склад аналізуючого розчину.
истема
з двох електродів, розташованих в
аналізуючому розчині, являють собою
гальванічний елемент, ЕРС котрого
дорівнює потенціалу, характеризуючого
склад аналізуючого розчину.
Вимірювання електродного потенціалу або різниці потенціалів - непроста задача. Звичайний пристрій, який вимірює напругу, - вольтметр непридатний до вимірювання електродних потенціалів, так як на цьому пристрої відбувається втрата напруги, що призводить до значних помилок при вимірюванні. Для вимірювання електродного потенціалу частіше всього використовують компенсаційну схему (малюнок 1). Назустріч ЕРС, яка виникає в колі електродів 4, напрямляють через реохорд 2, ЕРС джерела постійного струму 1. За допомогою сковзького контакту змінюють різницю потенціалів до досягнення повної компенсації. В момент компенсації, тобто рівності ЕРС електродів та сухого елемента 1 гальванометр 3 покаже відсутність струму в колі. За положенням бігунця реохорда визначають ЕРС електродної пари, тобто електродний потенціал.
Реохорд може мати різну форму. В сучасних лабораторних рН-метрах, які використовуються для технічного аналізу, використовуються барабанні реохорди зі сковзьким контактом. Оскільки січна дроту реохорда по всій довжині однакова, то опір її також однаковий по всій довжині і спад напруги на кожній ділянці пропорційний довжині цієї ділянки. Якщо, наприклад, на реохорд від сухого елемента подається напруга 1,3 В, а реохорд розділений по довжині на 130 ділянок, то спад напруги на кожній ділянці дорівнюватиме 10 мВ. Відповідно шкалу реохорда також ділять на 130 ділянок. Якщо при компенсації бігунець реохорда знаходиться на дільниці 20, електродний потенціал дорівнює 200 мВ.
При роботі по компенсаційній схемі в вимірювальних приладах не відбувається втрата струму і виключається можливість помилок, зв'язаних з опором системи або поляризацією.
Конструкція приладу основана на описаній вище компенсаційній схемі вимірювання. В цій схемі гальванометр потрібний для визначення моменту компенсації, тобто моменту, коли в схемі немає струму. Струм, який виникає в електродному колі, дуже малий, і його посилюють за рахунок лампового підсилювача.
Ламповий підсилювач являє собою мостову схему, в якій ввімкнуті електронні лампи. В діагональ моста ввімкнутий нуль-гальванометр. Після ввімкнення підсилювача і підігріву електронних ламп налагоджують підсилювач. Для цього за допомогою спеціального перемінного опору вирівнюють анодні точки обох електронних ламп. Якщо стрілка нуль-гальванометра займає нульове положення, підсилювач налагоджений.
Потенціометрична схема слугує для вимірювання ЕРС електродної пари, попередньо підсиленої ламповим підсилювачем. Для точного виміру ЕРС електродної пари потрібно подавати на вимірюючу схему постійний струм з визначеною напругою. Джерело постійного струму - важлива частина вимірюючої схеми. В лабораторних рН-метрах джерелом постійної напруги звичайно слугує постійний елемент, наприклад батарея З-СЛ-30. Оскільки її ЕРС змінюється з часом, в схему підключають нормальний гальванічний елемент Вестона. Його обрали в якості еталону тому, що володіє постійною ЕРС (1,0183 В при 20°С). Цей елемент підключають в схему таким чином, щоб можна було перевірити по ньому ЕРС сухого елемента. Для цього на реохорд подають ЕРС нормального елемента, підключають йому назустріч ЕРС сухого елемента і за допомогою спеціального перемінного опору зменшують ЕРС, яка подається від сухого елемента, до момента компенсації - відсутність струму в колі. Компенсація означає, що ЕРС, яка поступає від сухого елемента, дорівнює ЕРС нормального елемента, тобто 1,0183 В при 20°С. Описану операцію називають налагодженням вимірюючої схеми за допомогою нормального елемента.
Коли пристрій готовий до вимірювання, до вимірюючої схеми підключають ЕРС електродної пари. При цьому рівновага мостової схеми порушується і стрілка нуль-гальванометра відхиляється. Для компенсації відхилення ЕРС електродів протиставляють ЕРС сухого елемента. Держак реохорда обертають до тих пір, поки стрілка нуль-гальванометра знову не займе нульового положення, тобто поки ЕРС електродної пари не буде компенсована ЕРС на реохорді. За допомогою пристрою відліку реохорда відраховують ЕРС електродної пари. За допомогою потенціометра в лабораторіях виконують аналізи двох видів: знаходження концентрації іонів Гідрогену в розчині; знаходження концентрацій різних речовин за рахунок потенціометричного титрування.
