
- •Тема 16. Котельные установки……………..………………………………149
- •Тема 17. Использование вэр и охрана окружающей среды………..…..170
- •Введение
- •Часть 1. Термодинамика
- •Тема 1. Основные понятия и определения
- •Предмет и метод термодинамики
- •Объект изучения термодинамики
- •1.3 Параметры состояния термодинамической системы
- •1.4 Уравнение состояния идеального газа. Понятие об идеальных и реальных газах
- •1.5 Газовые смеси
- •1.6 Термодинамический процесс
- •Тема 2. Первый закон термодинамики
- •2.1 Аналитическое выражение первого закона термодинамики. Частные случаи закона
- •2.2 Внутренняя энергия системы
- •2.3 Работа расширения и pv-диаграмма для изображения работы
- •2.4 Работа и теплота
- •2.5 Теплоемкость газов
- •2.6 Энтальпия
- •Тема3. Второй закон термодинамики
- •3.1 Общая характеристика
- •3.2 Энтропия и математическое выражение второго закона
- •3.3 III начало термодинамики
- •3.4 Т,s диаграмма для изображения теплоты
- •3.5 Физический смысл энтропии
- •3.6 Основное уравнение термодинамики и вычисление энтропии
- •Тема. 4 термодинамические процессы идеальных газов в закрытых системах
- •4.1 Изохорный процесс
- •4.2 Изобарный процесс
- •4.3 Изотермический процесс
- •4.4 Адиабатный процесс
- •4.5 Политропный процесс
- •Тема 5. Термодинамические циклы
- •5.1 Круговые процессы
- •5.2 Термодинамическая схема теплового двигателя
- •5.3 Прямой цикл Карно
- •5.4 Обратный цикл Карно
- •Тема 6. Циклы паросиловых, холодильных установок и теплового насоса
- •6.1 Циклы паросиловых установок. Цикл Ренкина
- •6.2 Циклы холодильных установок
- •6.3 Цикл теплового насоса
- •6.4 Эксергия. Эксергический анализ
- •Тема7. Теоретические циклы двигателей внутреннего сгорания
- •7.1 Цикл Отто
- •7.2 Цикл Дизеля
- •7.3 Цикл Тринклера (или Сабатэ)
- •Тема8. Термодинамика потока газов и паров
- •8.1 Уравнение первого закона термодинамики для потока
- •8.2 Истечение газов и паров
- •8.3 Дросселирование. Температура инверсии
- •Часть 2. Теория тепло и массообмена
- •Тема 9. Основы теории теплообмена
- •9.1 Введение. Теплопроводность
- •9.2 Закон Фурье – основной закон теплопроводности
- •9.3 Теплопроводнсть плоской однородной, однослойной стенки
- •9.4 Теплопроводность многослойной стенки
- •9.5 Теплопроводность цилиндрической стенки.
- •Тема10. Конвективный теплообмен
- •10.1 Понятие теплообмена. Закон Ньютона Рихмана
- •10.2 Критерии подобия
- •10.3 Теплоотдача при вынужденном движении теплоносителя
- •10.4 Теплоотдача при свободном движении теплоносителя
- •10.5. Теплоотдача при кипении
- •10.6 Теплоотдача при конденсации пара
- •Тема11. Теплопередача чарез стенку
- •11.1 Понятие теплопередачи, теплопередача через плоскую стенку.
- •11.2 Уравнение теплопередачи.
- •11.3 Теплопередача через цилиндрическую стенку
- •Тема12. Лучистый теплообмен
- •12.1 Понятие лучистого теплообмена
- •12.2 Законы лучистого теплообмена
- •12.3 Теплообмен излучением системы тел в прозрачной среде
- •Тема13. Водяной пар
- •13.1 Процесс парообразования в pv-координатах
- •13.2 Ts и hS диаграмма водяного пара
- •13.3 Параметры состояния жидкости и пара
- •Тема14. Влажный воздух
- •14.1 Понятие влажного воздуха, его характеристики
- •14.3 Сушка материала
- •Тема15. Топливо
- •15.1 Классификация топлива
- •15.2 Состав топлива
- •15.3 Характеристики топлива.
- •15.4. Примеры твердого, жидкого, газообразного топлива.
- •15.5 Процесс горения топлива
- •15.6 Состав и объем продуктов сгорания.
- •15.7 Нефтяные топлива.
- •15.8 Понятие детонации, октанового числа и цетанового числа.
- •Тема16. Котеьные установки
- •16.1 Понятие котла и котельной установки
- •16.1 Паровой котёл и его основные элементы
- •16.3 Паровые и водогрейные котлы
- •16.4 Вспомогательное оборудование
- •16.5 Топка, топочные устройства
- •16.6 Котлы утилизаторы
- •16.7 Тепловой баланс горения
- •Тема17. Использование вэр и охрана окружающей среды
- •17.1 Понятия вэр
- •17.2 Классификация вторичных энергетических ресурсов в промышленности
- •17.3 Использование вторичных энергетических ресурсов промышленности
- •17.4 Расчет вэр на экономическую эффективность
- •Заключение.
13.2 Ts и hS диаграмма водяного пара
Ts–диаграмму водяного пара строят аналогично предыдущему, а именно, наносят изобары, изотермы и изохоры (рисунок 13.2). В области насыщенного пара изобары совпадают с изотермами. В области перегретого пара изобары и изохоры представляют собой логарифмические кривые разной кривизны (учитывая, что ср > cv).

Рис. 13.2 – Тs – диаграмма процесса парообразования
На диаграмме процесс парообразования при p=const изображен кривой a–b–c–d. Кроме того, наносят пограничные кривые 1 (х = 0) и 2 (х = 1). Площадь под кривой а–b эквивалентна количеству теплоты q’, подведенной к жидкости при ее нагреве до состояния кипения; площадь под линией b–с количеству теплоты q, сообщаемой в процессе парообразования; площадь под кривой c–d – теплоте перегрева qпер.
Точка а соответствует температуре 273 К (0°С), точка К – критическому состоянию пара.
На практике широко пользуются hs–диаграммой водяного пара (рисунок 13.3). За начало координат принято состояние воды в тройной точке (в равновесном состоянии находятся пар, вода и лед – р0 = 611 Па, Т0 = 273,16 К, v0 = 0,001 м3/кг), при этом s0 = 0, h0 = 0. Пограничные кривые строятся по точкам h' и s' для кривой х = 0 и h" и s" – для кривой х = 1. Термодинамические параметры воды, доведенной до кипения (х = 0), и сухого насыщенного пара берут из таблиц теплофизических свойств воды и водяного пара.
В области влажного пара изобары и изотермы совпадают и изображаются расходящимися линиями. От пограничной кривой х=1 изотермы идут плавными кривыми вправо, а при больших степенях перегрева они практически параллельны оси OS.
Диаграмма hs имеет много ценных свойств: она позволяет быстро определять параметры пара с достаточной для технических расчетов точностью.
13.3 Параметры состояния жидкости и пара
Состояние влажного насыщенного пара определяется его давлением или температурой и степенью сухости х. Очевидно, значение х = 0 соответствует воде в состоянии кипения, а х = 1– сухому насыщенному пару.
Температура влажного пара есть функция только давления и определяется так же, как и температура сухого пара, по табличным значениям. Удельный объем влажного пара зависит от давления и от степени сухости и определяется из уравнения:
![]() .
(13.1)
.
(13.1)
Из этой формулы получаем значение:
![]() . (13.2)
. (13.2)
Для давлений до 3 МПа и х ≥ 0,8 можно пренебречь последним членом равенства. Тогда удельный объем влажного насыщенного пара:
vx = v"x. (13.3)
Для больших давлений и малых следует пользоваться полной формулой.
Плотность влажного пара:
![]() (13.4)
(13.4)
или приближенно
![]() .
(13.5)
.
(13.5)
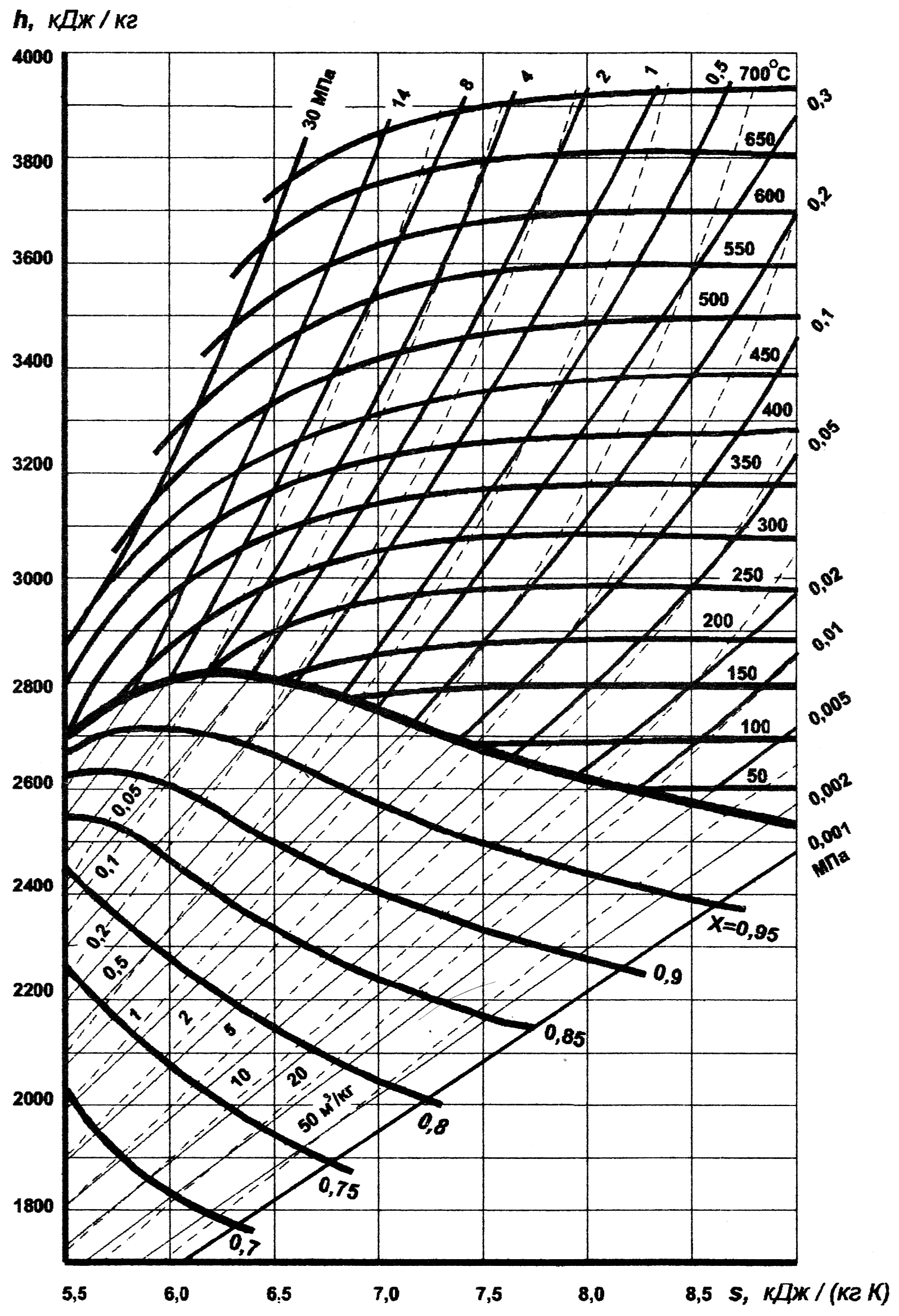
Рис. 13.3 – hs – диаграмма процесса парообразования
Перегретый пар имеет более высокую температуру по сравнению с температурой U сухого насыщенного пара того же давления. Следовательно, в отличие от насыщенного пара перегретый пар определенного давления может иметь различные температуры. Для характеристики состояния перегретого пара необходимо знать два его параметра, например давление и температуру. Разность температур перегретого и насыщенного пара того же давления t – tн называют перегревом пара.
Весьма важным в теплотехнических расчетах является определение количества теплоты, затрачиваемой на отдельные стадии процесса парообразования и изменения внутренней энергии.
Количество теплоты, затраченной для подогрева жидкости от 0 С до температуры кипения при постоянном давлении, называют теплотой жидкости. Ее можно определить как разность энтальпий жидкости в состоянии кипения и жидкости при том же давлении и 0° С, т.е.
![]() ,
(13.6)
,
(13.6)
а так как
![]() при невысоких давлениях с достаточной
для технических расчетов точностью
можно считать равным нулю, то
при невысоких давлениях с достаточной
для технических расчетов точностью
можно считать равным нулю, то
![]() . (13.7)
. (13.7)
Значения внутренней энергии жидкости можно вычислить из общей зависимости h = u + pv.
Тогда
u' = h' – pv', (13.8)
а так как величина рv' мала, то при невысоких давлениях можно принимать
u' = h', (13.9)
т.е. внутренняя энергия жидкости равна энтальпии жидкости. Значения h', а следовательно, и u' приводятся в таблицах насыщенного пара.
Количество теплоты, необходимое для перевода 1 кг кипящей жидкости в сухой насыщенный пар при постоянном давлении, называют теплотой парообразования и обозначают буквой r. Это количество теплоты расходуется на изменение внутренней энергии, связанное с преодолением сил сцепления d между молекулами жидкости, и на работу расширения (ф).
Величину d называют внутренней теплотой парообразования, а величину ф – внешней теплотой парообразования. Очевидно,
ф
= р
![]() (13.10)
(13.10)
и r = d + ф. (13.11)
Значения г приводятся в таблицах сухого насыщенного пара. Энтальпия h " сухого насыщенного пара определяется по формуле
![]() ,
(13.12)
,
(13.12)
а изменение внутренней энергии при получении сухого насыщенного пара из 1 кг жидкости при 0 °С – из выражения:
u" = h" – pv". (13.13)
Для влажного насыщенного пара имеем следующие соотношения:
![]() (13.14)
(13.14)
![]() ,
(13.15)
,
(13.15)
где hx – энтальпия влажного насыщенного пара;
ux – внутренняя энергия влажного насыщенного пара. Количество теплоты, необходимое для перевода 1 кг сухого насыщенного пара в перегретый при постоянном давлении, называется теплотой перегрева. Очевидно,
 ,
(13.16)
,
(13.16)
где
![]() – истинная массовая теплоемкость
перегретого пара при постоянном
давлении.
– истинная массовая теплоемкость
перегретого пара при постоянном
давлении.
В результате тщательных исследований установлено, что теплоемкости cp перегретых паров зависят от температуры и давления.
Однако пользоваться этой зависимостью неудобно. Расчеты существенно упрощаются тем, что в таблицах водяного пара приводятся значения энтальпии перегретого пара h(i). Поэтому теплота перегрева может быть найдена из выражения:
![]() .
(13.17)
.
(13.17)
Энтропия водяного паря отсчитывается от условного нуля, в качестве которого принимают энтропию воды при 0,010С и при давлении насыщения, соответствующем этой температуре, т.е. при давлении 611 Па.
Энтропия жидкости s' определяется из выражения
![]() ,
(13.18)
,
(13.18)
где с – теплоемкость
воды, а
![]() – температура насыщения, К.
– температура насыщения, К.
Значение теплоемкости для воды с достаточной точностью можно принять равным 4,19 кДж/(кг · К). Следовательно,
![]() кДж/(кг · К)
(13.19)
кДж/(кг · К)
(13.19)
Если жидкость нагревается не до температуры кипения, а до произвольной температуры Т, то под Тн в формуле следует понимать эту произвольную температуру.
Энтропия сухого насыщенного пара s" определяется из уравнения
![]() ,
(13.20)
,
(13.20)
где r – теплота парообразования.
Энтропия влажного насыщенного пара
![]() ,
(13.21)
,
(13.21)
или
![]() ,
(13.22)
,
(13.22)
где х – степень сухости пара.
Энтропии s' и s" приведены в таблицах насыщенного пара, а r/Тн можно получить из этих же таблиц как разность s"–s'.
Энтропия перегретого пара может быть найдена из уравнения
 .
(13.23)
.
(13.23)
Значения s приводятся в таблице перегретого пара.
