
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
Билет 4.
1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
Обычно атомы формируют связи за счет электронов разных энергетических состояний. Так у атомов Be(2s22p1), B(2s22p2), и C(2s22p3) в образовании связей одновременно принимают участие как s, так и p электроны. Несмотря на различие форм исходных электронных облаков, связи образованные с их участием оказываются равноценными и расположенными симметрично в молекулах BeCl2, BCl3, CCl4 180, 120, 10928'. Возникает вопрос, каким образом неравноценные по исходному состоянию электроны образуют равноценные химические связи. Ответ на него дает представление о гибридизации валентных орбиталей. Согласно ему химические связи формируют электроны не «чистых», а «смешанных», так называемых гибридных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей взаимно изменяются и образуются орбитали новой, но уже одинаковой формы и энергии. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей и более симметрично расположенной электронной плотности в молекуле.
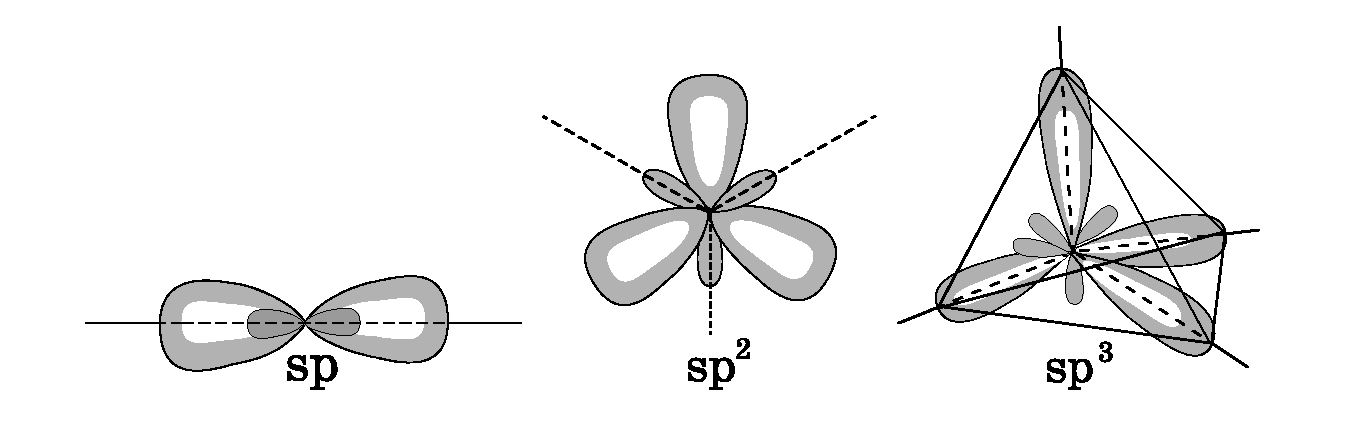
Необходимым условием устойчивости гибридного состояния атома является энергетическая близость и достаточная плотность гибридизируемых орбиталей, также достаточная степень перекрывания гибридных орбиталей с орбиталями соседних атомов при образовании связи. Указанные факторы позволяют объяснить изменение по группам и периодам периодической системы способности атомов элементов к переходу в соответствующее состояние(гибридное). По периодам энергетическое различие внешних s и p орбиталей увеличивается в направлении от элементов I группы к элементам VII группы. Увеличение энергетического различия орбиталей уменьшает возможность sp3 гибридного состояния.
Более общую теорию пространственного строения молекул предложил Гиллеспи(концепция отталкивания электронных пар), исходя из чисто электростатических представлений. Она базировалась на большом экспериментальном материале, обобщенном Сидвиком и Пауэллы. Основные положения теории заключаются в следующем:
Геометрия молекулы или иона определяется исключительно числом электронных пар на валентной оболочке центрального атома.
Электронные пары принимают такое расположение на валентной оболочке атома, при котором они максимально удалены друг от друга, т. е. электронные пары ведут себя так, как если бы они взаимно отталкивались. Геометрические многогранники, реализующиеся при этом, подчиняются формуле Декарта-Эйлера: «число вершин + число граней — число ребер равно двум».
Область пространства, которую занимает несвязывающая неподеленная пара электронов имеет большие размеры, чем та область, которая занята связывающей электронной парой.
Размер области пространства, занятой связывающей парой электронов, уменьшается с увеличением электроотрицателъности лиганда и с уменьшением электроотрицателъности центрального атома.
Две электронные пары двойной связи занимают большую область пространства, чем одна электронная пара простой связи.
Обозначения, использованные для описания геометрической конфигурации молекул
А — многовалентный атом, X— атомы, связанные с атомом А, n — число атомов X, Е - неподеленная пара электронов, m — количество неподеленных электронных пар
Тогда формула молекулы по Гиллеспи записывается так: АХnЕm. Геометрия молекулы зависит от суммы n+m. Число n, определяющее количество атомов X, непосредственно присоединенных к атому А, равно и его координационному числу. Каждая электронная пара принимается за точечный заряд. Центральный атом А помещается в центр сферы некоторого радиуса, который для однотипных присоединенных атомов X равен длине связи А—X. На поверхности сферы располагаются точечные электронные пары. Применяя правило максимального удаления электронных пар на сфере друг от друга, можно вывести геометрию простейших молекул и ионов, постепенно увеличивая сумму поделенных и неподеленных пар (см. рис.). Молекулу АХ рассматривать не имеет смысла, так как она всегда линейна, сколько бы атом А ни имел неподеленных электронных пар.
Молекула АХ2 также всегда линейна, так как максимальное отталкивание двух электронных пар располагает их на концах диаметра условной сферы.
Три связывающие электронные пары, максимально удаленные друг от друга, образуют правильный треугольник (молекулы АХ3). В этом случае угол Х-А-Х равен 120°. Такое строение имеют молекулы BF3, AlF3. Если одну из связывающих электронных пар заменить неподеленной парой электронов, молекула будет описываться формулой АХ2Е и иметь угловое строение, причем, согласно третьему правилу Гиллеспи, угол Х-А-Х станет меньше 120°. Примером такой геометрии может служить молекула SnF2.
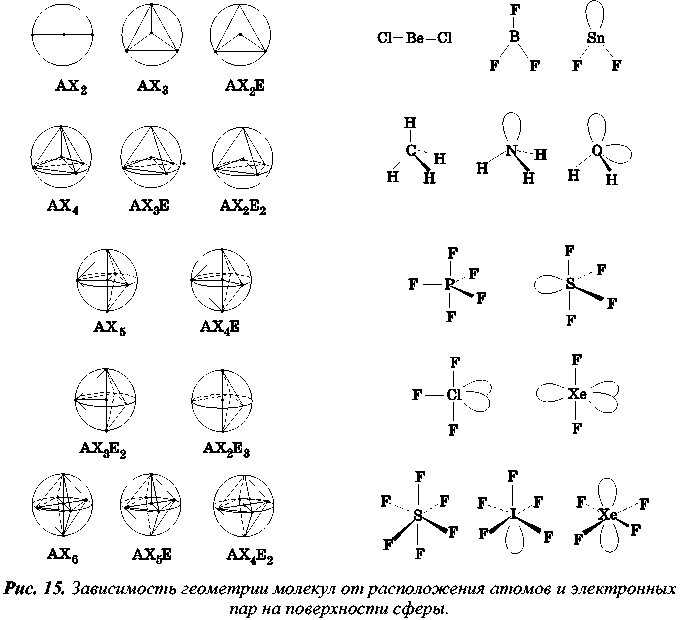
Четыре связывающие пары электронов в пространстве образуют тетраэдр. По Гиллеспи, это тип АХ4. Угол Х-А-Х составит 109°28'. Типичными представителями этого типа молекул являются молекулы СН4, CCl4, SnF4. Последовательно уменьшая число связывающих пар электронов и увеличивая число неподеленных электронных пар, для молекул типа АХзЕ приходим к их тригональному пирамидальному строению, а для молекул типа АХ2Е2— к угловому. Такая геометрия получается, если в вершинах тетраэдра последовательно локализуются неподеленные электронные пары, что приводит к уменьшению тетраэдрического угла. Примером молекулы типа АХ3Е является молекула аммиака NH3, а типа АХ2Е2 — молекула воды Н2О.
Координационное число "пять" реализуется в молекулах типа АХ5. Примерами подобных молекул являются пентафторид и пентахлорид фосфора (PF5, PCl5). Пять атомов галогенов в пространстве занимают вершины тригональной бипирамиды. Три атома располагаются в экваториальной плоскости, образуя равнобедренный треугольник, а два-соответственно над и под этой плоскостью. Расстояние А—X от центра молекулы до одной из вершин пирамиды, называемое аксиальным, больше аналогичного экваториального. Валентный угол между связями, лежащими в экваториальной плоскости, равен 120°, а в аксиальной— 180°. При выводе геометрической формы молекул, являющимися производными от тригональной бипирамиды, для неподеленных электронных пар возникают две альтернативные возможности расположения. При аксиальном расположении она испытывает отталкивание от трех близлежащих атомов, а в экваториальной— от двух. Поэтому первые неподеленные пары электронов всегда занимают экваториальное положение как энергетически наиболее выгодное. Примером может служить молекула тетрафторида серы SF4, которая имеет форму качелей или дисфеноида. В молекулах типа АХ3Е2, таких, как ClF3 или IClз, вторая неподеленная электронная пара располагается также в экваториальной плоскости. Поэтому все четыре атома находятся в одной плоскости, напоминая по форме букву Т. За счет того, что неподеленная пара электронов занимает область пространства большего размера, происходит искажение соответствующих валентных углов в сторону их уменьшения. Третья неподеленная пара электронов, также занимая положение в экваториальной плоскости, преобразует Т-образную молекулу в линейную. Представителем молекул типа АХ2Е3 является молекула XeF2.
Наиболее выгодное размещение шести атомов X вокруг центрального атома А- октаэдрическое. Молекулы типа АХ6, например SF6, имеют форму октаэдра. Первая неподеленная пара электронов занимает любую из вершин октаэдра, превращая его в квадратную пирамиду. Примером молекулы типа АХ5Е может служить IF5. Для второй электронной пары имеются две возможности расположения: по соседству с первой (цис-положение) и напротив нее (транс-положение). Максимальное отталкивание заставляет принять транс-ориентацию двух электронных пар. Вследствие этого молекулы типа АХ4Е2 имеют форму квадрата, например, XeF4. Увеличивая дальше число неподеленных пар электронов для молекул типа АХ3Е3 и АХ2Е4, легко прийти к выводу соответственно о Т-образном и линейном их строении. Примеры веществ с таким типом молекул неизвестны.
Аналогичным образом, исходя из теории максимального отталкивания электронных пар, можно предсказать строение молекул с числом электронных пар более шести. Таким образом, теория валентных связей и максимального отталкивания электронных пар обладает лишь предсказательной силой в обосновании геометрии молекул. Объяснить же многие другие экспериментальные факты они не могут. Эти методы несостоятельны при описании электрондефицитных молекул, таких как бороводороды, с нечетным числом электронов. Они также испытывают большие трудности при объяснении цвета соединений и предсказании их магнитных свойств.
