- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
Гетероциклические соединения, орг. соединения, молекулы которых содержат циклы, включающие наряду с атомами углерода один или несколько атомов др. элементов (гетероатомов). Наибольшее значение имеют Г. с, в цикл которых входят атомы N, О, S. К ним относятся многие алкалоиды, витамины, антибиотики, природные пигменты; они входят в виде структурных фрагментов в молекулы нуклеиновых к-т, белков и др.
Г. с. Можно классифицировать по типу гетероатома (N, O, S) и по количеству атомов в цикле.
Названия используются как правило тривиальные.
Важнейшие представители:
|
|
|
|
|
|
|
|
|
фуран |
тио-фен |
пиррол |
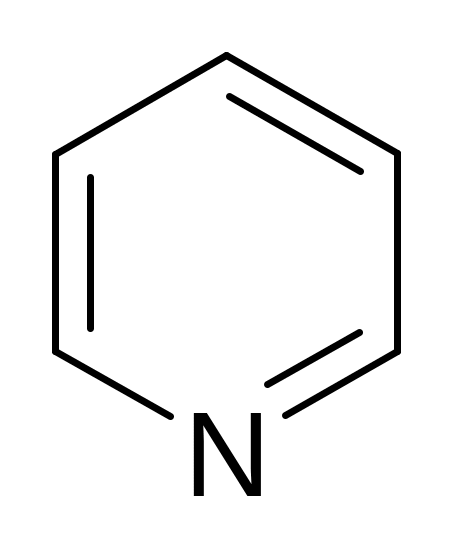
пири-дин |
индол |
изо-хинолин |
хино-лин |
пурин |
пирими-дин |
Получение:
Из 1,4-дикарбоновых соединений:

Из хлоркетонов:

Из спиртов:

фурфурол
Получение тиофена:

Превращения по Юрьеву:

Хим. свойства:
1. В кислой среде все системы нестабильны
2. Реакции типа SE: в положение 2 – сульфирование, нитрование, диазотирование, азосочетание, ацилирование, галогенирование:

Реакции галогенирования – образование тетрагалогенпроизводных.
3.

Шестичленные
SE затруднено (сульфирование в положение 3).
Реакция Чичибабина:



Присоединение:

пиперидин
Билет №24
1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
Равновесные электродные процессы. При переходе заряженных частиц (ионы, электроны) через границу раздела двух фаз, например раствор электролита – металл, возникает электрохимическая реакция. В результате этого металл и раствор приобретают электрический заряд, и на границе их раздела создается двойной электрический слой, которому соответствует скачок потенциала.
Электродные (потенциалопределяющие) процессы представляют собой окислительно-восстановительные реакции, которые можно записать в следующем виде:
![]()
Если в электродном процессе участвует только одно вещество в окисленной (Ох) и восстановленной (Red) формах, то запись реакции упрощается:
![]()
Различают обратимые и необратимые электроды. При перемене направления электрического тока на обратимых электродах возникают реакции, противоположные по направлению, на необратимых — протекают реакции не обратные друг другу. Примером обратимого электрода служит медь в растворе, содержащем Си2+. При прохождении тока в противоположных направлениях идут реакции Си2+ + 2е Си и Си Си2+ + 2е. К необратимым электродам относится, например, медь в растворе кислоты.
Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме:

Если металлическую пластинку опустить в растворитель (например, воду), то металл начнет переходить в раствор в виде катионов. Вследствие этого на пластинке будет накапливаться отрицательный заряд, так как электроны не переходят в раствор. Отметим, что превалирующий переход катионов в другую фазу характерен только для полярных жидкостей и объясняется большей выгодностью сольватации катионов, чем электронов.
Процесс перехода катионов металла не бесконечен. По мере протекания процесса заряд на пластинке увеличивается, и переход в раствор новых катионов становится все менее выгодным. С другой стороны, раствор заряжается все более положительно и начинает выталкивать катионы на поверхность металлической пластинки. Установившееся равновесие характеризуется равенством скоростей перехода катионов из раствора на пластинку металла и перехода катионов из пластинки в раствор. При изменении условий нахождения металла в растворе равновесие будет нарушаться, а при возвращении в первоначальные условия равновесие будет возвращаться в исходное состояние. Данное равновесие называется обратимостью электрода.
Вблизи границы с металлической пластинкой концентрация катионов высока. Значительное количество катионов находится в первом ряду, непосредственно прилегающем к поверхности металла, образуя положительную обкладку двойного электрического слоя.

Электрохимический потенциал. Электрохимическая цепь представляет собой систему, состоящую из различных фаз, через границы раздела которых переходят заряженные частицы, что вызвано стремлением системы к термодинамическому равновесию. При этом на границах раздела фаз возникают скачки потенциала. ЭДС электрохимической ячейки определяется как суммарный результат всех процессов, происходящих на границах раздела фаз.
Состояние электрохимической частицы в фазе определяется электрохимическим потенциалом µэ который, согласно Гугенгейму, представляет собой сумму ее химического потенциала µ и электрической энергии:
![]()
где g – внутренний потенциал, отвечающий работе переноса элементарного отрицательного заряда из бесконечности в вакууме в глубь фазы.
Переход незаряженных частиц из одной фазы в другую обусловлен неравенством химических потенциалов частиц в этих фазах. При этом работа переноса 1 моль соответствует разности химических потенциалов µ1 и µ2. Если через границу раздела фаз переносятся заряженные частицы, то кроме работы на преодоление сил химического взаимодействия необходимо произвести дополнительную работу против электрических сил. Мерой работы будет служить разность электрохимических потенциалов:
![]()
А в условиях равновесия соответствующие электрохимические потенциалы будут равны. Переход заряженных частиц через границу раздела фаз сопровождается нарушением баланса электрических зарядов в каждой фазе и приводит к возникновению двойного электрического слоя, которому соответствует скачок потенциала.
Понятие о скачке потенциала на границе раздела фаз. Существует несколько теорий, объясняющих возникновение скачка потенциала на границе раствор — металл. Наиболее современной является сольватационная теория электродного потенциала.
Скачок потенциала на границе раствор — металл вызван следующими процессами: 1) ионизацией атомов металла на ионы и электроим внутри металла. Согласно современным представлениям о строении металлов в узлах кристаллической решетки расположены ионы метал ла, находящиеся в равновесии с электронами, которые образуют элект ронный газ, обеспечивающий электрическую проводимость металлов, 2) сольватацией ионов металла, находящихся на его поверхности, при соприкосновении с раствором, содержащим молекулы растворителя L. Обе стадии и общую реакцию на границе раствор — металл записываем в следующем виде:
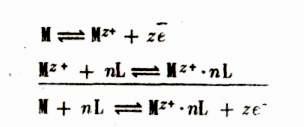
В ходе растворения металл приобретает отрицательный, а раствор — положительный электрический заряд. По мере протекания реакций их скорости выравниваются и на границе раствор — металл устанавливается состояние динамического равновесия.
К моменту наступления равновесия металл получил определенный отрицательный электрический заряд, а раствор — равный ему положительный заряд. На границе раздела раствор — металл формируется двойной электрический слой, которому соответствует скачок потенциала, называемый равновесным.
Скачок потенциала между фазами не поддается экспериментальному определению. Так как ЭДС электрохимической ячейки может быть легко найдена, то принято электродный потенциал считать равным ЭДС цепи, составленной из водородного электрода (является стандартным электродом) и исследуемого электрода. Водородный электрод находится в стандартном состоянии и его потенциал при любой температуре всегда равен «0». ЭДС электрохимической цепи соответствует разности разности правого (положительного) и левого (отрицательного) электродов. ЭДС гальванической ячейки представляет собой сумму межфазных потенциалов на границе раздела фаз.
Межфазный потенциал – это разность внутренних потенциалов контактирующих фаз.
Внутренний потенциал фазы – это работа, совершаемая при переносе единицы отрицательного электричества из бесконечности в вакууме в глубь данной фазы.