
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
Общепризнанного определения понятия «комплексное соединение» нет. Это обусловлено разнообразием комплексных соединений и их характерных свойств. Под комплексным соединением в химии понимают соединения, в узлах кристаллов которых находятся комплексы, способные к самостоятельному существованию в растворе.
В большинстве комплексных соединений различают внутреннюю и внешнюю сферы. Центральный атом (ион) внутренней сферы называется комплексообразователем, а координированные вокруг него молекулы (ионы) - лигандами. В формулах комплексных соединений внутреннюю сферу (комплекс) часто заключают в квадратные скобки.
Классификация комплексов. По характеру электрического заряда различают катионные, анионные и нейтральные комплексы. В приближении ионной модели заряд комплекса представляет собой алгебраическую сумму зарядов образующих его частиц.
Катионный комплекс можно рассматривать как образованный в результате координации вокруг положительного иона нейтральных молекул (Н2О, Н3N и др.). Молекулы Н2О и Н3N в номенклатуре называют -аква- и -аммин- соответственно:
[Al(OH2)6]Cl3 – трихлорид гексаакваалюминия, или хлорид гексаакваалюминия (III).
Соединения, содержащие амминкомплексы, называются аммиакатами, а содержащие аквакомплексы – гидратами.
В роли комплексообразователя в анионном комплексе выступает атом с положительной степенью окисления (положительный ион), а лигандами являются атомы с отрицательной степенью окисления (анионы). Отрицательный заряд комплекса отражают добавлением к латинскому названию комплексообразователя суффикса -ат, например:
К2[BeF4] – тетрафторбериллат (II) калия.
Нейтральные комплексы образуются при координации вокруг атома молекул, а также при одновременной координации вокруг положительного иона-комплексообразователя отрицательных ионов и молекул. Например:
[Pt(NH3)2Cl2] – диамминдихлорплатина (II)
[Ni(CO)4] – тетракарбонил никеля.
Электронейтральные комплексы, следовательно, являются комплексными соединениями без внешней сферы.
Роль комплексообразователя может играть любой элемент периодической системы. В соответствии со своей химической природой неметаллические элементы обычно дают анионные комплексы, в которых роль лигандов играют атомы наиболее электроотрицательных элементов, например K[PF6], K3[PO4], K3[PS4]. Что же касается типичных металлических элементов (щелочных и щелочноземельных металлов), то способность к образованию комплексных соединений с неорганическими лигандами у них выражена слабо. Имеющиеся незначительные комплексные ионы являются катионными, например [Sr(OH2)6]Cl2, [Ca(NH3)8]Cl2. Амфотерные элементы, которые занимают промежуточное значение между типичными металлическими и неметаллическими элементами, образуют как катионные, так и анионные комплексы, например [Al(OH2)6]Cl3 и K[Al(OH)4)].
Классификация лигандов. Лиганды могут занимать в координационной сфереодно или несколько мест, т.е. соединяться с центральным атомом посредством одного или нескольких атомов. По этому признаку различают монодентантные, дидентантные, тридентантные, …, полидентантные лиганды. Примерами монодентантных лигандов являются ионы Cl-, F-, OH-, молекулы H2O, H3N, CO и др. К бидентантным относится, например, молекула этилендиамина H2N – CH2 – CH2 – NH2 (сокращённое обозначение en).Комплексы с полидентантными лигандами называются хелатными. Ниже приведены нехелатный и хелатный комплексы меди (II):
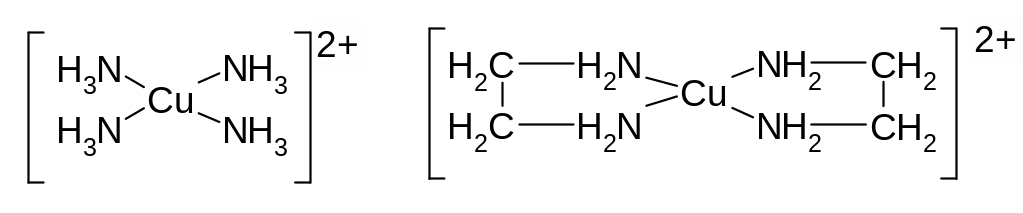
В
качестве бидентантных лигандов часто
выступают также ионы
![]() и им подобные:
и им подобные:
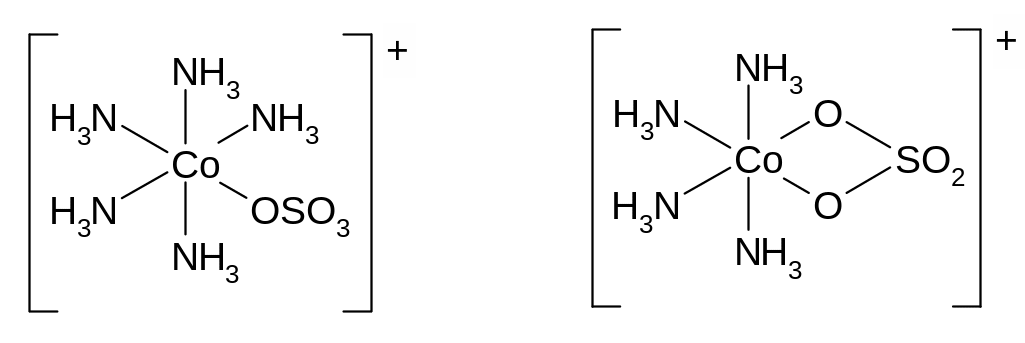
В
левом комплексе ион
![]() выступает как монодентантный лиганд,
в правом комплексе – как бидентантный.
выступает как монодентантный лиганд,
в правом комплексе – как бидентантный.
Проявление
той или иной пространственной конфигурации
комплексов существенно зависит от
характера распределения электронов по
молекулярным орбиталям и от значения
энергии расщепления
![]() .
Так, в октаэдрическом комплексе
электронная плотность наиболее
симметрично распределяется при следующих
электронных конфигурациях:
.
Так, в октаэдрическом комплексе
электронная плотность наиболее
симметрично распределяется при следующих
электронных конфигурациях:
Комплекс |
Центральный атом (ион) |
( |
d3 – Cr (III), Mn (IV) |
( св)12 ( d)3 ( dразр)2 |
d5 – Mn (II), Fe (III) |
( св)12 ( d)6 ( dразр)2 |
d8 – Ni (II) |
( св)12 ( d)6 |
d6 – Co (III), Fe (II), Pt (IV), Pd (IV) |
Следовательно, октаэдрические комплексы наиболее характерны для центральных ионов с конфигурацией d3, d5 и d8, а при больших значениях энергии расщепления – с конфигурацией d6.
При других электронных конфигурациях наблюдается большее или меньшее искажение октаэдрической структуры.
На проявление той или иной структуры влияет также размер лигандов, которые, естественно, взаимно отталкиваются. Так, Mn2+ и Fe3+ (d5) с ионами F- дают октаэдрические комплексы MnF64- и FeF63-, а с более крупными по размерам ионами Cl- - тетраэдрические MnCl42- и FeCl42-.
Комплексные соединения широко распространены в природе, играют важную роль в биологических процессах. Достаточно упомянуть хелатные комплексы – гемоглобин крови (комплексообразователь Fe2+) и хлорофилл зелёных растений (комплексообразователь Mg2+). Комплексные соединения находят самое разнообразное практическое применение. Так, образование хелатных комплексов используется при умягчении жёсткой воды и растворения камней в почках; важнейшую роль играют комплексные соединения в аналитической практике, производстве металлов и т. д.
Карбонилы металлов. В соединениях с молекулами СО как -донорными и -акцепторными лигандами d-элементы проявляют нулевую степень окисления. Для хрома и его аналогов известны гексакарбонилы Э(СО)6. Это бесцветные легко возгоняющиеся твёрдые вещества, их молекулы диамагнитны, имеют форму октаэдра с атомом d-элемента в центре.
Для марганца и его аналогов известны карбонилы состава Э2(СО)10 с похожими свойствами.
Карбонилы металлов способны к реакциям замещения и окисления - восстановления. Так, СО-группы в молекулах карбонилов могут замещаться на другие лиганды -донорного и -акцепторного типа (PF3, PCl3, NO и др.), например Cr(PF3)3(CO)3.
В качестве окислительно-восстановительных реакций можно привести следующие:
[Mn(CO)5]2 + 2Na = 2Na(Mn(CO)5]
[Mn(CO)5]2 + Br2 = Mn(CO)5Br
В первом случае Mn(CO)10 восстанавливается, во втором – окисляется, что отвечает изменению степени окисления Mn от нуля до -1 и +1 соответственно.
Ниже приведены d-элементы, которые образуют нейтральные бинарные карбонилы и дают комплексы, содержащие помимо СО-групп атомы галогенов, например Mn(CO)5Br:
Группы
V |
VI |
VII |
VIII |
I |
II |
||
|
|
|
|
|
|
|
|
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Сплошной линией обведены символы d-элементов, образующих бинарные карбонилы; цветом выделены d-элементы, образующие карбонилгалогениды.
