
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
Алканы CnH2n+2 – предельные, насыщенные углеводороды. Получают из природных источников (газ, нефть - крекинг)
C
уголь + Н2
![]() СxHy
гидрирование
угля
СxHy
гидрирование
угля
nCO + H2 → CnH2n+2 Фишер-Тробш
лаб
CH2=CH-R![]() CH3-CH2-R
CH3-CH2-R
CH3COONa
+ NaOH
![]() CH4
+ Na2CO3
декарбоксилирование
CH4
+ Na2CO3
декарбоксилирование
Al4C3 + H20→ CH4 + Al(OH)3 гидролиз карбида
2R-Hal![]() R-R
+ 2NaCl Вюрц
R-R
+ 2NaCl Вюрц
2RCOONa
![]() R-R
+ NaHCO3
+H2 Кольбе
R-R
+ NaHCO3
+H2 Кольбе
RCO2-
→RCO![]() →R
→R![]() →R-R
(анод)
→R-R
(анод)
R-MgX +H2O→R-H +MgXOH Mg –орг.
R-CH2-OH +HJ R-CH3 + J2 + H2O Восстановление
R-CH2-Cl + HJ R-CH3 +J2 + H2O
Конформации – мол. С определенной конфигурацией «поворотные» изомеры.
Различное расположение атомов за счет вращения вокруг одной связи.
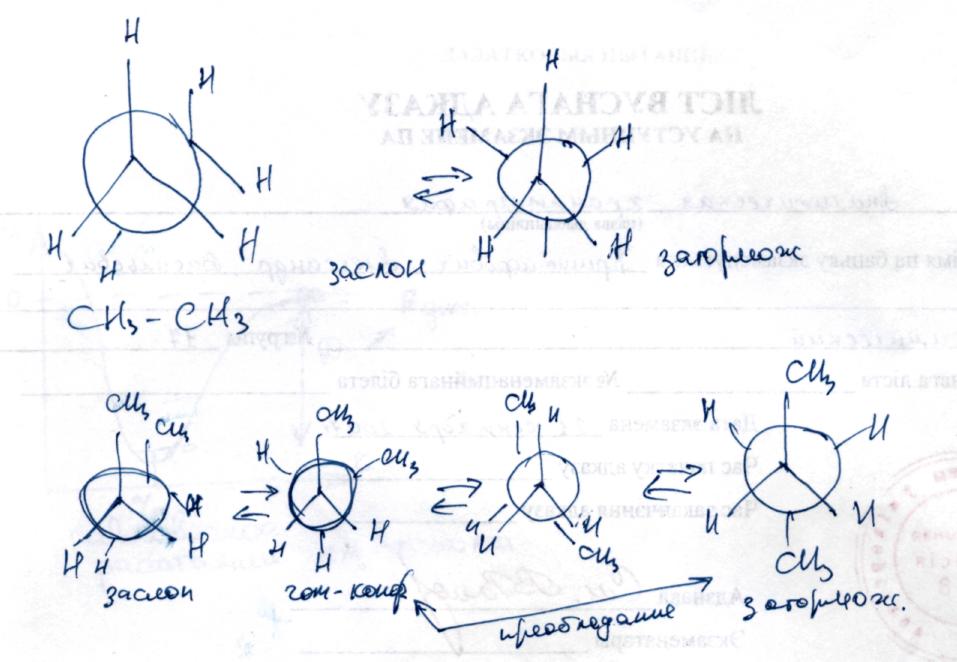
Гомолитический разрыв связи преобладает
CH4
![]() CH3Cl
CH2Cl2
CHCl3
CCl4 SR
CH3Cl
CH2Cl2
CHCl3
CCl4 SR
Cl2![]() 2Cl*
2Cl*
CH4 + Cl* →CH3* +HCl инициирование
CH3* +Cl2→CH3Cl + Cl* рост
CH3* + Cl*→CH3Cl обрыв
CH3* + CH3* →C2H6
Br2 > селективно, чем хлорирование
Коновалов:
HNO3 HO* + NO2*
RH + NO2*→R* + HNO2
HNO3 +HNO2→2NO2* + H2O
R* +NO2*→RNO2
RH
+ SO2
+ Cl2![]() R-S(=O)2Cl
+HClК
R-S(=O)2Cl
+HClК
Cl2→2Cl*
Cl* + R-H→R* +Hcl
R* + SO2→RSO2
SO2 + O2→R-SO2OH
Горение: до СО2; СО
Окисление:
RH![]() ROOH
→ спирты, альдегиды, кетоны, карбоновы
к-ты
ROOH
→ спирты, альдегиды, кетоны, карбоновы
к-ты
Пиролиз:СnH2n+2![]() nC
+ (n+1)H2
nC
+ (n+1)H2
Крекинг:
4CH4![]() CH
CH![]() CH
+3H2
CH
+3H2
Изомеризация:
н-R-H![]() изомер
R-H
изомер
R-H
Нефть – смесь твердых и растворенных в ней тв. УВ.(алканы, арены, циклоалканы)
Переработка – первичная; вторичная.
Первичная – прямая перегонка – фракции.
Бензин, легроин, керосин, газойль, мазут.
Вторичная – крекинг, расщепление длинных цепей
Циклоалканы
СnH2n - насыщенные, но не предельные.
Сsp3 – 109’5
Малые цикли – присоединение АЕ
Средние и макро - SR замещение.
Билет 22
1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
Катализ – процесс селективного ускорения реакции под действием катализатора.
Катализаторы – вещества, изменяющие скорость реакции за счёт участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Изменение
скорости катализируемой реакции за
счёт снижения энергии активации её
отдельных стадий можно рассмотреть на
следующем примере. Допустим, между
веществами А и В возможно взаимодействие
с образованием соединения АВ (![]() ):
):
А + В А . . . В АВ
активированный
комплекс
Но в силу высокой энергии активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть, с другой стороны, найдено такое третье вещество К (катализатор); которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии активации), образуя соединение АК:
А + К А . . . К АК
активированный
комплекс
Соединение АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К:
В + АК В . . . АК АВ + К
активированный
комплекс
Суммируя два последних уравнения, получим
А + В = АВ
т.е. в результате реакции катализатор остался без изменения.
На
рис. 1 показана энергетическая диаграмма
хода реакции в отсутствие (кривая 1) и в
присутствии (кривая 2) катализатора.
Очевидно, в присутствии катализатора
энергия активации снижается на величину
![]() .
.
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный (Wгом ~ Скат), гетерогенный (Wгет ~ S поверхности раздела фаз) и микрогетерогенный (ферментный). Примером гомогенного катализа является реакция окисления СО (в газовой фазе в присутствии паров воды) кислородом. Гетерогеннокаталитическими являются процессы синтеза аммиака (катализатор железо), окисления SO2 до SO3 (катализатор платина или оксид ванадия) и т. д.
Гетерогенный катализ.
Удельная поверхность должна быть максимальной.
Еа гет < Еа гом
Процесс на поверхности катализатора:
1. процесс массопереноса;
2. адсорбция;
3. реакция;
4. десорбция
Если 1 – 4 не имитируют W вцелом, то вся поверхность находится в одинаковых условиях реакция происходит на равнодоступной поверхности. Механизм может быть разным.
1)
А
В;
![]() ,
где
,
где
![]() - доля поверхности, занятая адсорбирующим
веществом.
- доля поверхности, занятая адсорбирующим
веществом.
2) А + В С + D
а)
адсорбируются А и В, взаимодействуют
друг с другом.
![]() .
.
б)
адсорбируется А, В в газообразной фазе
реагирует с Аадс.
![]() .
.
![]()
