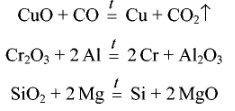- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
Билет №20
1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
В большинстве случаев скорость реакции с повышением температуры увеличивается. Если при повышении температуры не меняется механизм реакции, то увеличение скорости реакции определяется увеличением константы скорости данной реакции. Для характеристики зависимости скорости химической реакции от температуры было введено понятие температурного коэффициента скорости (γ), равного отношению константы скорости при температуре (Т + 10) к константе скорости при температуре Т (т.е. γ показывает, во сколько раз изменяется константа скорости при увеличении температуры на 10 градусов):
![]() .
.
Экспериментально было установлено, что повышение температуры на 10 К в области обычных температур (≈ 300 К) увеличивает скорость многих гомогенных реакций в 2 ‑ 4 раза, т. е. для этих реакций γ = (2 ‑ 4). Это правило называется правилом Вант–Гоффа.
Однако подобная оценка зависимости скорости реакции от температуры является весьма приближенной и эффективна для реакций, протекающих в растворах при относительно низких температурах. При повышении температуры коэффициент γ не остается постоянным (он уменьшается и при высоких температурах стремится к единице).
Более
точную зависимость скорости реакции
от температуры дает уравнение
Аррениуса:
![]() ,
,
![]() ,
где А,В=const,
не зав от температуры.
,
где А,В=const,
не зав от температуры.
АВ Предположение Аррениуса: В реакцию могут вступать только активные молекулы, т.е обладающие некоторым избытком энергии Е. А и А* находятся в равновесии. Та Е, которую поглощает А для превращения в А*, - Еакт. И только А* дают активированный комплекс
Еа к*
А↔А*→В ,К*≠f(Т), Роль Т: при увелич. Т поступает Е. Т влияет на Са (ув. кол-ва)
![]() ,
дифференциальная форма уравнения
Аррениуса.
,
дифференциальная форма уравнения
Аррениуса.
![]() ,
,
![]() ,
,
, интегральная форма уравнения Аррениуса,
Е- энергия активации химической реакции. В случае простых реакций величина Е показывает, какой минимальной (избыточной по сравнению со средней) энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в химическую реакцию. В случае сложных реакций величина Е называется эмпирической или кажущейся энергией активации и в общем случае зависит от энергий активации отдельных стадий данной реакции.
А- предэкспоненциальный множитель. Физический смысл А в случае простых реакций: мономолекулярных — это частота колебаний по разрываемой связи (А 1013 сек-1), бимолекулярных — величина А пропорциональна общему числу столкновений между молекулами реагирующих веществ (А 10-10 10-11 см3/(мол-л·сек).
Энергию
активации можно определить как
аналитически по уравнению
![]() ,
так и графическим методом. Для этого
необходимо знать ряд констант скоростей
при разных температурах. Если реакция
подчиняется уравнению Аррениуса, то
зависимость lnk
от 1/T
должна выражаться прямой линией
,
так и графическим методом. Для этого
необходимо знать ряд констант скоростей
при разных температурах. Если реакция
подчиняется уравнению Аррениуса, то
зависимость lnk
от 1/T
должна выражаться прямой линией
Р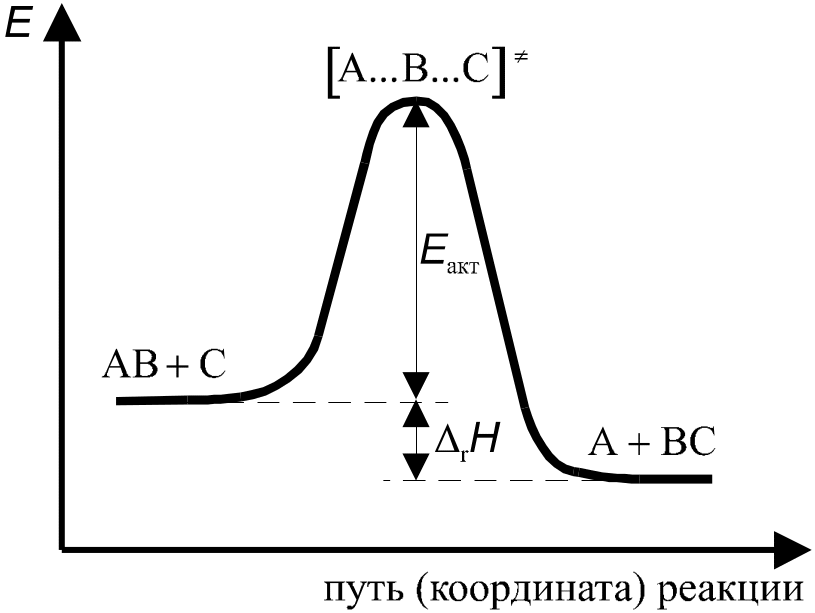 ис.
К расчету энергии активации реакции
ис.
К расчету энергии активации реакции
l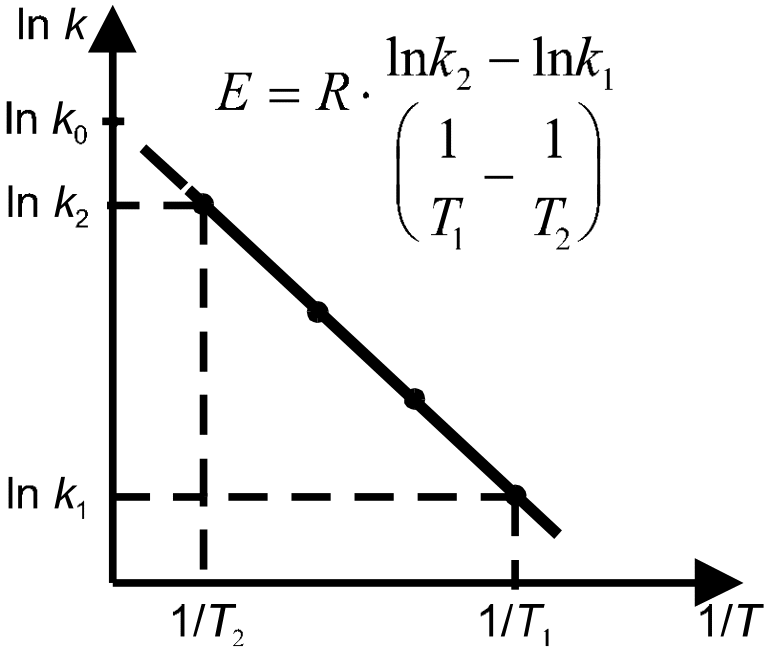 nk
-аррениусовская
координата, tgα
= -
nk
-аррениусовская
координата, tgα
= - ![]() , tgβ
=
, tgβ
=
Рис. Изменение потенциальной
энергии вдоль координаты реакции.
А, Еакт – по температурной зависимости K скорости реакции.
Если Са и СВ во всех опытах одинаковы, то можно строить график в осях ln W и 1/Т(менее точный).
Изменение энергии системы при переходе от исходных к конечным веществам представлено на рис. По оси абсцисс отложена “реакционная координата” (“путь реакции”), характеризующая продвижение системы по пути реакции. Энергия переходного комплекса выше энергии исходных веществ на величину ΔЕ0, которая представляет собой энергию активации реакции (для того, чтобы реакция могла произойти, система должны преодолеть потенциальный барьер ΔЕ0).
2. Нестехиометрические соединения. Кислотные, основные, амфотерные оксиды. Их отношение к воде, кислотам, щелочам. Окислительно-восстановительные свойства оксидов. Двойные оксиды. Пероксиды. Надпероксиды. Озониды.
Оксиды – соединения Э с кислородом. ЭхОу
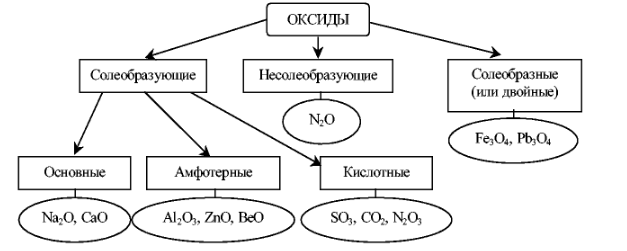
Солеобразными называются двойные оксиды, в состав которых входят атомы одного металла в разных степенях окисления. (Например, Pb3O4, Fe3O4, Mn3O4 ,они могут также быть записаны в таком виде 2 PbO· PbO2 ; FeO·Fe2O3 ;)
Среди оксидов, особенно среди оксидов d-элементов, много соединений переменного состава (бертолиды), содержание кислорода в которых не соответствует стехиометрическому составу, а изменяется в довольно широких пределах, например, состав оксида титана(II) TiO изменяется в пределах TiO0,65 – TiO1,25.
Увеличение степени окисления элемента и уменьшение радиуса его иона (при этом происходит уменьшение эффективного отрицательного заряда на атоме кислорода –σ0) делают оксид более кислотным. Это и объясняет закономерное изменение свойств оксидов от основных к амфотерным и далее к кислотным.
а) В одном периоде при увеличении порядкового номера происходит усиление кислотных свойствоксидов и увеличение силы соответствующих им кислот.
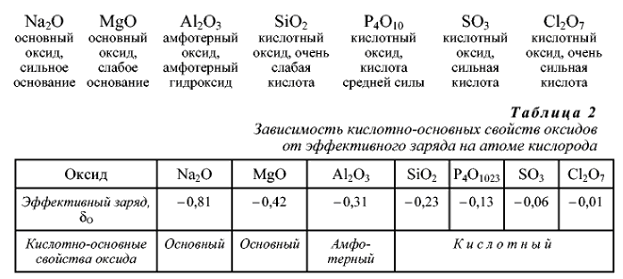
б) В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов:
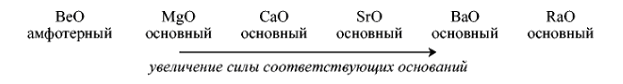
в) При повышении степени окисления элемента усиливаются кислотные свойства оксида и ослабевают основные:
Способы получения:
а) окисление простых и сложных веществ:
![]()
![]()
При
горении щелочных металлов в кислороде
образуются пероксиды
![]() или надпероксиды
или надпероксиды
![]()
а)
термическое разложение карбонатов и
нитратов (карбонаты щеМе, за исключение
карбоната Li,
плавятся без разложения):![]()
![]()
в) Термическое разложение оснований и кислород содержащих кислот:
![]()
![]()
г) Нагревание солей с кислотными оксидами:
![]()
д) Взаимодействие кислот с Ме и неМе:
![]()
Химические свойства:
осн.оксид + кислота→соли
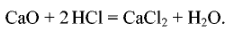
кисл.оксид
+ основание→соли
![]()
амф.оксид + основание→соли
![]()
амф.оксид
+ кислота→соли
![]()
+ Н2О→
осн.окс(ще
и ще-зем)→щелочь
![]()
кисл.+вода→
кислота (SiO2-
не реагирует)
![]()
Между собой (осн.+кисл.→соль):
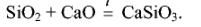
амф.окс+кисл.окс
:
![]()
амф.окс+осн.окс
:![]()
Оксиды могут участвовать в окислительно-восстановительных реакциях приводящих к изменению степени окисления данного элемента.
Восстановители (С,СО,Н2,и др, активные металлы,такие как Мg, Al) :
![]()