
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
Билет №2
1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
Химическая связь образуется только в том случае, если при сближении атомов (2 и >) полная Е (энергия системы) понижается. Рассмотрим простейшую молекулярную систему Н2.
В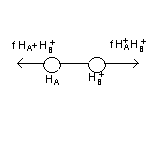 этой системе 1е движется в поле ядер 2-х
протонов. Допустим, мы сближаем протон
НА+
и атом водорода НВ
(НВ++е),
по мере сближения возникаю электростатические
силы 2-х типов: силы притяжения Е к обоим
ядрам и силы отталкивания. Силы
межъядерного взаимодействия f(НА+НВ+)
всегда направлены вдоль оси соединения
и стремиться развести ядра → молекула
образуется если равнодействующие силы
притяжения и отталкивания = 0.
этой системе 1е движется в поле ядер 2-х
протонов. Допустим, мы сближаем протон
НА+
и атом водорода НВ
(НВ++е),
по мере сближения возникаю электростатические
силы 2-х типов: силы притяжения Е к обоим
ядрам и силы отталкивания. Силы
межъядерного взаимодействия f(НА+НВ+)
всегда направлены вдоль оси соединения
и стремиться развести ядра → молекула
образуется если равнодействующие силы
притяжения и отталкивания = 0.
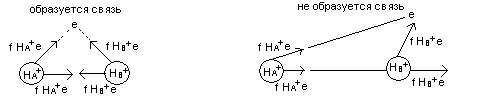
Связь образуется в том случае, если е попадает в область между ядрами – связывание, если нет – область разрыхления, то связь не образуется.
к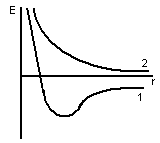 р.1
– связь образуется, min
– наиболее устойчивые системы из 2-х р
и 1е.
р.1
– связь образуется, min
– наиболее устойчивые системы из 2-х р
и 1е.
кр.2 – связь не образуется.
МВС: дает наименьшее представление об образовании и структуре многоатомных частиц.
- нельзя объяснить природу образования связей; -//- вклад неспаренных е в образование связи; -//- спектральные и магнитные характеристики ММО. Каждый е принадлежит своей молекуле и движется в поле всех ее ядер и е, т.е. находятся на МО. Совокупность всех МО молекулы – электронная конфигурация. МО – линейные комбинации АО. Одна МО является результатом сложения АО, обладает повышенной электронной плотностью – связывающая.
МО – результат вычитания АО – характеризуется пространственным разрывом электронной плотности между ядрами, т.е. ядра отталкиваются – разрыхляющая МО.
Условия образования МО из АО: 1) число МО = числу АО; 2) АО должны быть достаточно протяженными в пространстве, чтобы > перекрывание; 3) АО должны быть близки по Е; 4) АО должны иметь одинаковую симметрию.
Принципы распределения е по МО: 1) е заполняют орбитали в порядке возрастания их Е; 2) на каждую МО не более 2-х е (принцип Паули); 3) При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда.
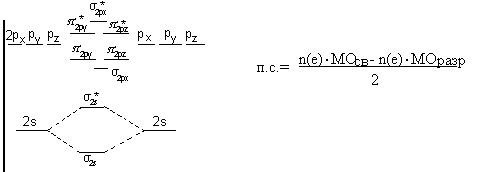
МВС: 1) ковалентная связь образуется 2-мя атомами за счет 2-х е с антипараллельными спинами, т.е. хим.св. локализуется между двумя атомами.
2) хим. связь располагается в том направлении, в котором возможность перекрывания эл. облаков наибольшая.
3) чем > полно перекрываются эл. облака, тем > прочная ков. связь образуется.
![]() -
3 несп. е → 3 ков. связи.
-
3 несп. е → 3 ков. связи.
![]() - 4 ков. связи.
- 4 ков. связи.
Донорно-акцепторная связь не отличается от ковалентной связи.
Таким образом атомы способны образовывать ков.связь различными способами. При использовании МВС эта способность оценивается с помощью валентности.
2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
Способ разделения смеси веществ. Между 2-мя фазами: ПФ и НФ. Разделние веществ основано на: 1) различной сорбционной способности в-в; 2) ∞ большими актами сорбции/десорбции.
По природе хим. Акта: 1) адсорбционная – удерживание компонента в НФ происходит за счет адсорбции; 2) распределительная; 3) ионообменная. Несколько способов получения хроматограмм:
1) элюентный
А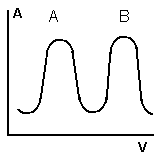
 и В смешиваем с растворителем и вводим
в колонку, колонку промываем элюентом
(растворителем).
и В смешиваем с растворителем и вводим
в колонку, колонку промываем элюентом
(растворителем).
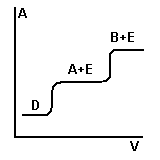
2) Вытеснительная
А и В растворяем в растворителе D и вводим в колонку, туда же D+E, Е – вытеснитель, который вытесняет А и В и по мере прохождения через колонку происходит разделение.
3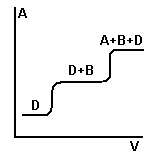 )
Фронтальный
)
Фронтальный
A+B+D непрерывным потоком пропускают через колонку.
Параметры хроматографии.
1.- компонент, который не удерживается тв. фазой.
tA – время удерживания компонента А.
tA’ – исправленное -//-.
V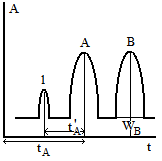 R
= tA•F,
VR
– объем удерживания, F
– V
потока, чем > t,
тем > W.
R
= tA•F,
VR
– объем удерживания, F
– V
потока, чем > t,
тем > W.
WB – ширина пика у основания.
∆WB – расстояние между пиками.
RS=(α∆W)/WA+WB – фактор разделения. RS=1 – перекрывание пиков. RS>>1,5 – полное разделение.
Теория тарелок: колонка разбита на определенные участки, вещество проходит через се тарелки.
n=16(VR/W)2 – число тарелок, чем > n, тем лучше разделение.
h=L/n – высота эквивалентная теоретической тарелке.
Кинетическая теория – связывает ВЭТТ и скорость потока газа-носителя.
h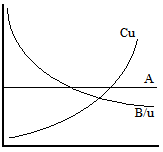 =A+B/u+Cu;
u
– скорость газа-носителя, А-const,
связанная с наличием вихревой диффузии
в колонке, В – const,
продольная диффузия, С – поперечная
диффузия.
=A+B/u+Cu;
u
– скорость газа-носителя, А-const,
связанная с наличием вихревой диффузии
в колонке, В – const,
продольная диффузия, С – поперечная
диффузия.
А – не зависит от u.
B/u – чем > u, тем < диффузия
Cu - ↑ с увеличением u.
dh=-B/u+C=0; u=√(B/C) – оптим u, hоптим=A+B/√(B/C)+C√(B/C)=A+2√(BC)
Газовая хроматография. В качестве ПФ – газы, компоненты разделяемых систем должны быть в газообразном или парообразном состоянии.
-газоадсорбционная (НФ – тв. в-во)
-газо-жидкостная (НФ – жидкость).
Компоненты распределяются между ПФ и НФ в соотв. с Краспр=С(НФ)С(ПФ). ПФ – газ-носитель: Не, N2, H2, Ar, CO2.
НФ (ГАХ) – активный силикагель, пористое стекло.
НФ (ГЖХ) – неполярные УВ, сложные эфиры, нитрилы, полигликоли. Детекторы – катарометры, по ионизации пламени, электронного захвата.
ПФ – поступает в термостат, проходит ч/з детектор, попадает в место ввода пробы, ПФ вместе с пробой проходит ч/з колонку, где в-ва разделяются и попадают в детектор. Колонки: капиллярные – НФ – стенки колонки, стекла кварцевые.
ВЭЖХ. Особенность – маленький размер зерен (до 1 мкм), НФ – как в ГЖХ, ПФ – жидкость, которая не смешивается с НФ. Разделение – на различии коэффициента распределения м/у НФ и ПФ. р до 500 атм, t может быть комнатная. Разделение белков, аминокислот. 2 вида детекторов: 1) реагирует на изменение св-в растворителя (рефрактометр); 2) на св-ва растворенного в-ва (спектрофотометр).
Ионная хр-я. – метод разделения ионов основан на ионной смене м/у НФ (тв. Ионообменником) и ПФ (ж) – раствор, содержащий ионы смешивается с ионами сорбентов. Ионный обмен – гетерогенный процесс, при котором сорбент и раствор обратимо и стехиометрически обмениваются ионами одного и того же знака.
3. Принципы получения высокомолекулярных соединений, регулирование состава и структуры макромолекул. Поликонденсация. Синтез, структура, свойства и применение высокомолекулярных соединений, синтезированных путем поликонденсации.
ПК – ступенчатый процесс образования ВМС их полифункциональных мономеров. Сопровождается исчезновением реакционных центров мономеров после каждого акта роста цепи: часть сопровождается выделением НМ продукта. Тогда элементный состав мономерного звена не совпадает с элементным составом мономера.
Характерная особенность ПК: ступенчатый механизм роста цепи; промежуточный продукт можно выделить на стадии (определенной) реакции; продукт – смесь полимеров (димеры, триммеры).
Бывает: 1) гомополиконденсация – участвуют мономеры 1-го типа;
2) СоПК – участвуют несколько полифункциональных соединений;
3) гетероПК – уч. молекулы 2-х разных соединений.
