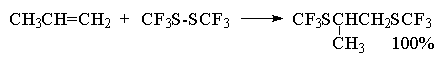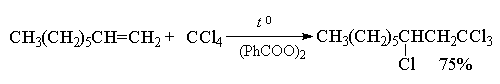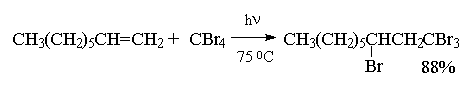- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
В отличие от симметричных электрофилов (Hal2), галогеноводороды представляют собой несимметричные электрофильные реагенты. Присоединение любого несимметричного электрофила (HBr, ICl, H2O, Hg(OAc)2 и т. д.) к несимметричному алкену в принципе могло бы дать смесь двух альтернативных продуктов, однако на практике обычно образуется только один из них. В качестве примера рассмотрим присоединение бромистого водорода к пропилену.
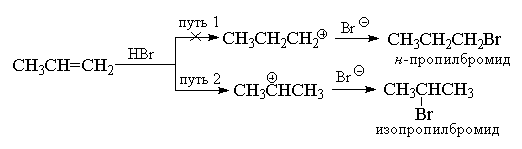
Еще в 1870 г. Марковников сформулировал эмпирическое правило, согласно которому несимметричные алкены присоединяют НХ таким путем, что преимущественно образуется продукт, в котором водород присоединяется к наименее замещенному, а Х - к наиболее замещенному концу двойной связи.
Обычно правило Марковникова объясняют различием в стабильности двух альтернативных карбокатионов. Например, в приведенном выше примере нормальный н-пропильный катион значительно менее стабилен, чем изопропильный катион, и поэтому реакция идет по второму пути.
Правило Марковникова первоначально использовалось только для случаев присоединения НХ к углеводородным субстратам, но в принципе его можно распространить и на реакции других замещенных алкенов. Так, присоединение НCl к CF3CH=CH2 дает "анти-марковниковский" продукт CF3CH2CH2Cl. Этого и следовало ожидать, поскольку катион CF3CH+CH3 менее стабилен, чем катион CF3CH2CH2+ из-за сильного (-I)-эффекта CF3-группы. Преимущественно образуется катион CF3CH2CH2+ , но он тоже, хотя и в меньшей степени дестабилизирован индуктивным эффектом CF3-группы, вследствие чего присоединение HCl к трифторметилэтилену идет значительно медленнее, чем присоединение к незамещенному этилену.
По аналогичной причине катионы винилтриалкиламмония присоединяют HBr также против правила Марковникова:
![]()
Присоединение НХ к алкенам, имеющим сильные (-I) и (-M)-заместители, например, к акрилонитрилу или нитроэтилену также должно идти против правила Марковникова. Однако в этом случае двойная связь настолько сильно дезактивирована по отношению к электрофильным реагентам, что эти реакции идут лишь в очень жестких условиях. Хлористый винил СН2=СНСl всегда дает исключительно "марковниковские аддукты". Например, при его реакции с HCl образуется только 1,1-дихлорэтан (геминальный дихлорид) CH3CHCl2. Хлор, аналогично CF3-группе имеет сильный (-I)-эффект, и на первый взгляд, кажется, что по этой причине присоединение должно иметь антимарковниковскую ориентацию, т. к. катион +CH2CH2Cl должен быть более стабильным, чем катион СН3СН+Cl. Однако, в отличие от CF3-группы, хлор кроме (-I)-эффекта обладает также противодействующим ему (+М)-эффектом (т. к. имеет неподеленные пары). Опыт показывает, что величина мезомерного эффекта вполне достаточна, чтобы понизить энергию 1-хлорэтильного катиона ниже уровня энергии 2-хлорэтильного катиона, в котором +М-эффект не проявляется.
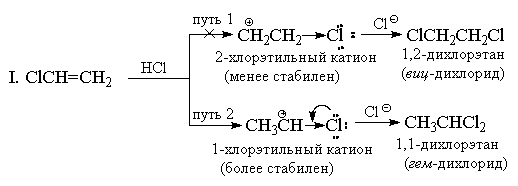
II. С позиций теории резонанса строение 1-хлорэтильного катиона может быть представлено следующим образом:
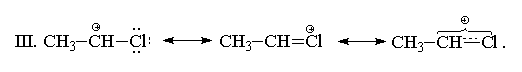
Тем не менее, присоединение к хлористому винилу происходит медленнее, чем к этилену в тех же условиях, т. е. по суммарному эффекту (-I > +M) хлор остается электроноакцепторным заместителем по сравнению с водородом, а 1-хлорэтильный катион менее стабилен, чем С2Н5+. Аналогичным образом реагируют с НХ и другие винилгалогениды.
Виниловые эфиры CH2=CHOR присоединяют НХ (X=Hal) по правилу Марковникова с гораздо большей скоростью, чем все перечисленные выше замещенные алкены. Это связано со значительным +М-эффектом RО-группы. В отличие от атома хлора, RО-группа по суммарному электронному эффекту (+М > -I) является сильным электронодонорным заместителем, эффективно стабилизирующим соседний карбокатионный центр. Строение карбокатиона в этом случае также может быть представлено в виде набора двух резонансных структур
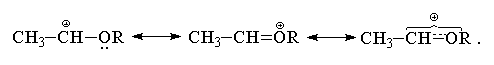
Атака оксониевого катиона галогенид-анионом приводит к образованию -галогенэфиров типа СН3СН(Hal)OR.
Реакции по аллильному положению
Стабильность аллил-радикала
Рассмотрим строение аллил-радикала CH2=CHCH2. . Все атомы углерода в аллил-радикале находятся в sp2 -гибридном состоянии, а не спаренный электрон располагается на р-орбитали, которая параллельна р-орбиталям двойной связи. Электронная структура незамещенного аллил-радикала характеризуется полной симметрией и р-орбиталь центрального атома углерода в равной степени перекрывается с р-орбиталями обоих соседних атомов углерода и длина связи С1-С2 равна длине связи С2-С3. Другими словами, стабильность аллил-радикала обусловлена резонансной делокализацией не спаренного электрона по единой -электронной системе.
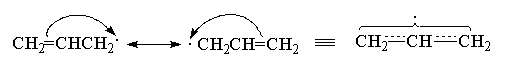
Радикальное присоединение бромистого водорода, катализируемое перекисями и родственные реакции
Присоединение бромистого водорода к алкенам резко отличается от присоединения остальных галогеноводородов - HF, HCl и HI. В зависимости от условий при присоединении HBr к несимметричным алкенам образуются продукты присоединения или в соответствии с правилом Марковникова, или против правила Марковникова. Было установлено, что при полном отсутствии кислорода или пероксидов гидробромирование алкенов строго подчиняется правилу Марковникова. Однако в присутствии кислорода или каталитических количеств пероксидов присоединение HBr осуществляется против правила Марковникова (анти-марковниковское присоединение). Наиболее эффективными инициаторами анти-марковниковского присоединения HBr к алкенам оказались пероксиды, такие как перекись бензоила (C6H5COO)2, трет-бутилгидропероксид (CH3)3COOH и др. Рациональное объяснение этого явления было дано Харашем (1933 г). Он показал, что механизм реакции изменяется с электрофильного на радикальный., что в свою очередь приводит к полному изменению региоселективности гидробромирования алкена.
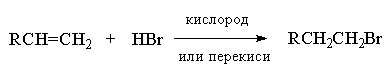
Присоединение бромистого водорода, инициируемое кислородом или перекисями, осуществляется по цепному радикальному механизму. Инициирование радикальной цепи заключается в образовании атома брома, который вызывает развитие радикальной цепи.
Зарождение цепи
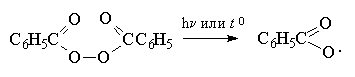

Развитие цепи
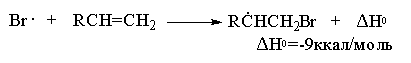
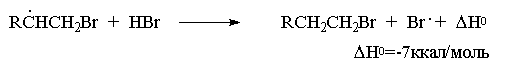
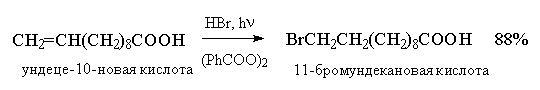
Образование радикала Br∙при зарождении цепи происходит в результате взаимодействия перекисного радикала или кислорода с бромистым водородом. С чисто энергетической точки зрения образование С6H5COOH и Br∙ гораздо выгоднее, чем образование С6H5COOBr и H∙ , поскольку энергия связи О-Н значительно превышает энергию связи О-Br и, следовательно, в радикальном процессе образование С6H5COOН и Br∙ предпочтительнее. Обе стадии развития цепи экзотермичны и характеризуются низкой энергией активации, что обеспечивает развитие цепного процесса. Атом брома присоединяется к концевому атому углерода алкена с образованием более замещенного вторичного радикала. Аналогично карбокатионам, вторичные алкильные радикалы стабильнее первичных. Поэтому на первой стадии развития цепи образуется только вторичный радикал RCH∙CH2Br, а не первичный радикал RCHBrСН2∙. В конечном итоге это приводит к анти-марковниковскому продукту радикального гидробромирования RCH2CH2Br.
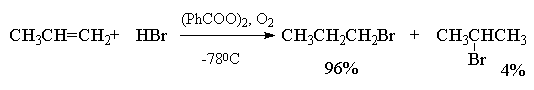
Аномальное гидрогалогенирование, инициируемое перекисями, характерно для присоединения НBr, но не HCl, HI или HF. Энергия связи С-I настолько мала, что присоединение радикала I∙ к двойной связи в первой стадии развития цепи эндотермично и требует высокой энергии активации:
![]()
хотя вторая стадия развития цепи экзотермична
![]()
При радикальном присоединении HCl и особенно HF к двойной связи, напротив, вторая стадия развития цепи характеризуется поглощением тепла, поскольку энергия связи HCl очень высока (103,1 ккал/моль).
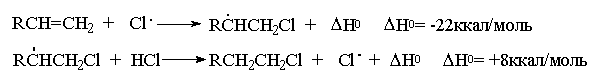
Цепные радикальные процессы осуществляются легко только в том случае, когда обе стадии развития цепи экзотермичны. Наличие эндотермичной стадии соответствует медленной реакции с быстрым обрывом цепи. Поэтому радикальное присоединение HF, HCl и HI к двойной связи не происходит.
Целый ряд других соединение с подходящей энергией связи могут присоединяться к двойной связи по радикальному механизму, подобному радикальному присоединению HBr к алкенам. Известны многочисленные примеры присоединения к алкенам сероводорода, тиолов, дисульфидов, четыреххлористого и четырехбромистого углерода, бромтрихлорметана:
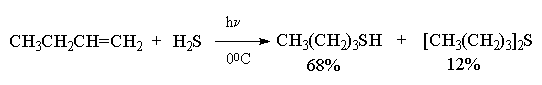
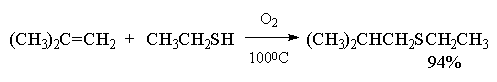
CCl4 и CBr4 легко реагируют с алкенами в присутствии перекисей, инициирующих радикальные процессы, с образованием аддуктов состава 1:1.