
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
Билет 10.
1.Силы Ван-дер-Ваальса. Водородная связь.
Хотя представление о ковалентной, ионной и металлической связи может быть использовано для объяснения строения молекул большого числа веществ в твердом, жидком и газообразном состояниях, все же есть немало систем, существование которых нельзя объяснить наличием этих связей. Наиболее наглядным примером служат инертные газы. Атомы этих элементов обладают сферической симметрией и не способны образовать ни одной из выше названных связей. Но поскольку при температуре вблизи абсолютного нуля инертные газы все-таки могут быть переведены в жидкое или твердое состояние, то должны быть и какие-то силы, стягивающие атомы этих элементов. Видимо, такие же силы имеют место при взаимодействии насыщенных молекул, например Н2, N2, СН4 и т. п. В этих молекулах валентные электроны использованы для образования связей между атомами, и у них, по-видимому, не осталось возможностей для связей друг с другом.
Силы притяжения между насыщенными атомами и молекулами крайне слабы по сравнению с ионными или ковалентными силами. Это видно из наблюдаемых на опыте свойств вещества, которые главным образом зависят от этих сил. Вещество, имеющее кристаллическую ионную структуру, в которой каждый атом удерживается ионным взаимодействием, будет обладать высокой температурой кипения. Вещества, в которых соседние молекулы удерживаются крайне слабыми силами, часто являются газами при комнатной температуре, и во многих случаях их точка кипения очень низка В частности, это верно и для инертных газов. Для сравнения с ковалентной связью возьмем энергию сублимации хлора: теплота сублимации С12 около 5 ккал/моль, тогда как Энергия связи CI—C1 равна 57 ккал/моль. Как видно, силы, связывающие одну молекулу CI 2 с другой молекулой, чрезвычайно слабы по сравнению с ковалентной связью, удерживающей один атом хлора около другого в молекуле С12.
Существование таких слабых сил притяжения было впервые обнаружено Ван-дер-Ваальсом, когда он ввел величину a/v2в уравнение состояния газа для учета этих сил, поэтому их называют ван-дер-ваальсовыми силами.
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями(постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул. Существует три типа вандерваальсовых сил, причем все они имеют электростатическую природу:
ориентационные силы,
дисперсионные (лондоновские) силы,
индукционные силы.
Ориентационные взаимодействия - слабые взаимодействия из группы вандерваальсовых взаимодействий, они обусловлены электростатическими взаимодействиями между постоянными диполями (мультиполями). Энергия такого взаимодействия равна:
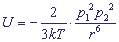 ,
,
где k - постоянная Больцмана,
T - абсолютная температура,
p1, p2 - дипольные моменты соответственно первого и второго диполей,
r - расстояние между диполями.
Дисперсионные (лондоновские) взаимодействия - слабые взаимодействия из группы вандерваальсовых взаимодействий, это взаимодействия между двумя наведенными диполями. Они проявляются на очень коротких расстояниях. В неполярной молекуле в отсутствие поля электроны не могут быть неподвижными, поэтому дипольный момент равняется нулю только в среднем. Диполи осциллируют, индуцируя друг друга, в результате чего между ними возникают силы притяжения. Дисперсионные силы имеют квантовомеханическую природу. Энергия такого взаимодействия равна:
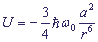 ,
,
где ħ - постоянная Планка,
ω0 - частота первоначального колебания осцилляторов,
r - расстояние между осцилляторами,
a - поляризуемость осциллятора.
Дисперсионные силы имеют значение для взаимодействий атомных групп и молекул с насыщенными валентными связями. Лондоновские дисперсионные силы действуют между любыми атомами и молекулами независимо от их строения. Наглядно можно представить, что дисперсионные силы возникают вследствие синхронизации мгновенных диполей взаимодействующих частиц.
Атом гелия имеет сферическую симметрию, поэтому не имеет дипольного момента. Однако такое представление основано на усреднении во времени. Если снять мгновенную фотографию атома гелия, то будет видно несимметричное распределение электронов вокруг ядра в данный момент. Следовательно, должен быть мгновенный диполь. Такой диполь вызовет также мгновенный диполь в другом атоме, что может привести к синхронному полю по всей системе. От этого произойдет уменьшение энергии системы, но взаимодействие будет очень слабым.
Индукционные взаимодействия - слабые взаимодействия из группы вандерваальсовых взаимодействий, они имеют электростатическую природу. Индукционный эффект состоит во взаимодействии диполя одной молекулы с диполем, индуцированным полем диполя первой молекулы в соседней молекуле. Эти диполи параллельны. Энергия индукционной силы равна:
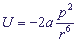 ,
,
где a - поляризуемость второй молекулы,
p - дипольный момент первой молекулы,
r - расстояние между диполями.
Эта формула верна только для точечных диполей, т.е. при условии малости размеров диполей по сравнению с расстоянием между ними. Если условие точечности диполей не выполняется, то необходимо проводить расчет взаимодействий монополей - точечных зарядов.
Водородная связь (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.
Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе.
В образовании Н-связи определяющую роль играет электроотрицательность участвующих в связи атомов – способность оттягивать на себя электроны химической связи от атома – партнера, участвующего в этой связи. В результате на атоме А с повышенной электроотрицательностью возникает частичный отрицательный заряд d- , а на атоме-партнере – положительный d+, химическая связь при этом поляризуется: Аd-–Нd+.
Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия.
В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Нd+–Аd- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк.
Важную роль играют водородные связи в полимерах и биополимерах. В целлюлозе – основном компоненте древесины – гидроксильные группы, расположены в виде боковых групп полимерной цепи, собранной из циклических фрагментов. Несмотря на сравнительно слабую энергию каждой отдельной Н-связи, их взаимодействие на всем протяжении полимерной молекулы приводит к столь мощному межмолекулярному взаимодействию, что растворение целлюлозы становится возможным лишь при использовании экзотического высокополярного растворителя – реактива Швейцера (аммиачный комплекс гидроксида меди).
