
- •Передмова
- •Тема 1. Комплексні сполуки
- •Контрольні запитання та задачі
- •Тема 2. Лужні метали
- •Контрольні запитання та задачі
- •Тема 3. Берилій. Магній. Лужноземельні метали
- •Контрольні запитання та задачі
- •Тема 4. Бор та алюміній
- •Контрольні запитання та задачі
- •Тема 5. Карбон силіцій та їх сполуки
- •Контрольні запитання та задачі
- •Тема 6. Станум, плюмбум та їх сполуки
- •Контрольні запитання та задачі
- •Тема 7. Нітроген та його сполуки
- •Контрольні запитання та задачі
- •Тема 8. Р-елементи VI групи
- •Контрольні запитання та задачі
- •Тема 9. Р-елементи vіі групи
- •Тема 10. Хром та його сполуки
- •Контрольні запитання та задачі
- •Тема 11. Манган та його сполуки
- •Контрольні запитання та задачі
- •Тема 12. Ферум. Кобальт. Нікель
- •Контрольні запитання та задачі
- •Тема 13. Купрум. Аргентум
- •Контрольні запитання та задачі
- •Тема 14. Цинк. Кадмій. Меркурій
- •Контрольні запитання і задачі
- •Список використаної літератури
МІНІСТЕРСТВО ОСВІТИ І НАУКИ,МОЛОДІ ТА СПОРТУ УКРАЇНИ
ХЕРСОНСЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ
КАФЕДРА ФІЗИЧНОЇ ТА НЕОРГАНІЧНОЇ ХІМІЇ
Реєстр. №
З.В. Друзяк, О.О. Венгер, М.В. Костина
ЛАБОРАТОРНИЙ ПРАКТИКУМ
З ДИСЦИПЛІНИ
„ЗАГАЛЬНА ТА НЕОРГАНІЧНА ХІМІЯ”
(Неорганічна хімія)
для студентів першого курсу
напряму підготовки – 6.051301 – хімічна технологія
галузі знань – 0513 – Хімічна технологія та інженерія
напряму підготовки – 6.051701 – харчові технології та інженерія
галузі знань – 0517 – Харчова промисловість та переробка сільськогосподарської продукції
Херсон 2011
Лабораторний практикум з дисципліни „Загальна та неорганічна хімія” (Неорганічна хімія) для студентів першого курсу напряму підготовки – 6.051301 – хімічна технологія; галузі знань – 0513 – Хімічна технологія та інженерія; напряму підготовки – 6.051701 – харчові технології та інженерія; галузі знань – 0517 – Харчова промисловість та переробка сільськогосподарської продукції / З.В. Друзяк, О.О. Венгер, М.В. Костина. – Херсон. – ХНТУ. – 2011. – с.
Затверджено на засіданні кафедри фізичної та неорганічної хімії
Протокол № _13_ від “_10_“__02__ 2011 р.
Рецензент: д.т.н., професор Г.В. Міщенко,
завідуючий кафедри фізичної та
неорганічної хімії, ХНТУ.
Передмова
Лабораторний практикум складено відповідно до типової програми дисципліни “Загальна і неорганічна хімія” (Неорганічна хімія) для студентів першого курсу, що навчаються за напрямком підготовки – 6.051301 – хімічна технологія; галузі знань – 0513 – Хімічна технологія та інженерія та напряму підготовки – 6.051701 – харчові технології та інженерія; галузі знань – 0517 – Харчова промисловість та переробка сільськогосподарської продукції.
У практикумі наведено лабораторні роботи з основних розділів дисципліни.
Мета практикуму – закріплення теоретичного матеріалу з вивчення властивостей елементів та їх сполук. Метою практикуму також є набуття студентами навичок роботи з хімічними речовинами, оволодіння методиками їх дослідження, прийомами роботи з приборами та обладнанням хімічних лабораторій.
Практикум складено таким чином, щоб навчити студента самостійно виконувати експеримент, формулювати і узагальнювати висновки.
Опису лабораторних завдань передують стислі теоретичні введення і умови виконання робіт. Закінчуються теми переліком контрольних питань і задачами для самостійного їх розв’язання.
Саме така структура практикуму на наш погляд є ефективною для оптимального засвоєння студентами теоретичного матеріалу.
Кількість лабораторних робіт і їх тематика розраховані на навчальні плани вказаних спеціальностей, але окремі роботи можуть бути використані при вивчені даної дисципліни та підготовці до іспиту .
Тема 1. Комплексні сполуки
Основні теоретичні відомості
Комплексні сполуки — це сполуки, здатні утворювати в твердому стані кристалічні ґратки, у вузлах яких розміщуються комплексні йони, здатні існувати також у розчині.
Найбільш вдало будову і властивості комплексних сполук пояснює координаційна теорія, розроблена швейцарським хіміком, лауреатом Нобелівської премії А. Вернером у 1893 р.
Згідно з координаційною теорією А. Вернера, молекула комплексної сполуки складається з йона-комплексоутворювача (займає центральне місце), лігандів, що перебувають у безпосередній близькості і разом з йоном-комплексоутворювачем становлять внутрішню сферу; комплексна сполука має також зовнішню сферу, якщо заряди у внутрішній сфері не скомпенсовані.
Атом (йон) металу (або неметалу, наприклад H[BF4], H2[SiF6]), який приєднує до себе протилежно заряджені йони або нейтральні молекули, утворюючи комплексний йон, називається комплексоутворювачем, або центральним йоном, а протилежно заряджені йони або молекули, які безпосередньо з ним сполучені, називаються адендами, або лігандами. Ліганди розміщуються навколо центрального йона по-різному залежно від його координаційного числа. Координаційне число атома-комплексоутворювача може дорівнювати від 2 до 12; найчастіше воно має значення 2, 4, 5 та 6. Число лігандів, безпосередньо сполучених з центральним атомом (йоном), визначається координаційним числом цього атома (йона). Оскільки координаційне число залежить від природи центрального атома (йона) і лігандів, природи розчинника, умов утворення комплексної сполуки, воно є змінною величиною.
Для одного й того самого йона-комплексоутворювача координаційні числа не є постійними; так для Al3+, Co2+, Zn2+ відомі координаційні числа 4 і 6.
Лігандами можуть бути електронейтральні молекули (Н2О, NH3, NO і т.д.), а також негативно заряджені йони (О2-, ОН-, NO2-, CN-, Cl-, Br-, I-, CO3- і т.д.).
Найважливішими комплексними сполуками з нейтральними лігандами є амінокомплекси та аквакомплекси.
Амінокомплекси — це комплексні сполуки, лігандами яких є молекули аміаку. Такі комплекси можуть утворювати йони Аргентуму (І), Купруму (ІІ), Кадмію, Цинку, Ніколу, Кобальту під час взаємодії з водним розчином NH3. Вони досить стійкі. Якщо на важкорозчинні сполуки цих металів, добутки розчинності яких більші, ніж константи нестійкості відповідних аміакатів, подіяти аміаком, то вони перейдуть у розчин у вигляді йонів: [Ag(NH3)2]+, [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Zn(NH3)4]2+, [Ni(NH3)6]3+, [Co(NH3)6]2+, [Co(NH3)6]3+.
Аквакомплекси — це комплексні сполуки, лігандами яких є молекули води.
До аквакомплексів належать: [А1(Н2О)6]С13; [Со(Н2О)6]С12; [Сr(Н2О)6]С13 тощо, які у розчині дисоціюють з утворенням комплексних катіонів: [А1(Н2О)6]3+; [Со(Н2О)6]2+; [Сr(Н2О)6]3+.
Комплексні сполуки, в яких центральний атом координує круг себе негативно заряджені кислотні залишки, називається ацидокомплексами. Це комплексні сполуки, лігандами яких є аніони, наприклад: K3[Co(NO2)6], K2[PtCl6], K3[FeF6], K4[Fe(CN)6], K2[CoCl4].
Заряд комплексного йона дорівнює алгебричній сумі зарядів простих йонів, що входять до його складу. На величину заряду комплексного йона не впливають електронейтральні молекули, що входять до його складу, наприклад:
Fe3+ + 6CN- = [Fe(CN)6]3- (+3 - 6 = -3);
Cu2+ + 4NH3 = [Cu(NH3)4]2+ (+2 + 0 = +2).
Дисоціація комплексних сполук відбувається за типом дисоціації сильних електролітів:
[Zn(NH3)4]Cl2 → [Zn(NH3)4]2+ + 2Сl-.
Це означає, що йони Хлору можна легко зв'язати реактивами, які утворюють з ними важкорозчинні солі.
Видалити молекули аміаку значно важче, оскільки дисоціація комплексних йонів відбувається незначною мірою:
[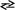 Zn(NH3)4]2+
Zn2+
+ 4NH3.
Zn(NH3)4]2+
Zn2+
+ 4NH3.
Дисоціація цих йонів підлягає закону дії мас і з кількісного боку оцінюється константою нестійкості або константою стійкості:
![]() .
.
Константою нестійкості комплексної сполуки називається константа рівноваги процесу дисоціації комплексних йонів:
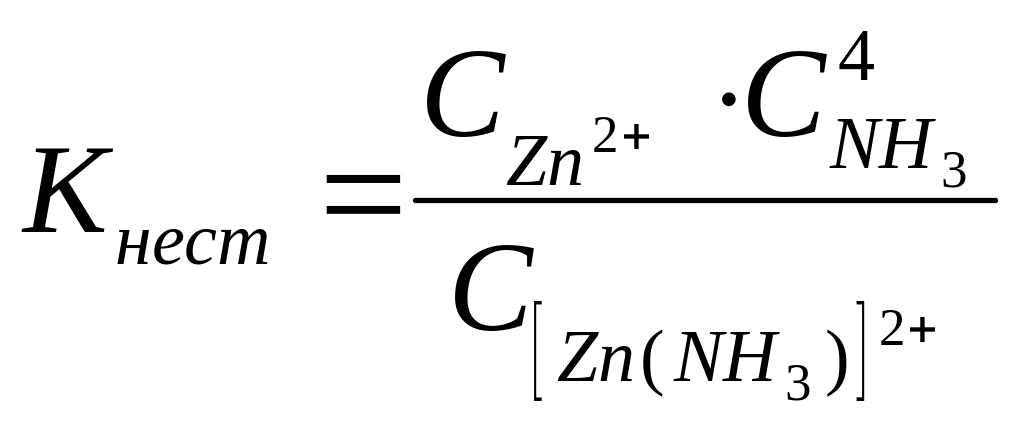 .
.
Величина константи нестійкості комплексної сполуки залежить від її природи і від температури. За сталої температури ця величина стала для даної сполуки і не залежить від її концентрації. Чим більша величина константи нестійкості комплексної сполуки, тим більшою мірою ця сполука дисоціює на йони у водних розчинах.
Пониження концентрації одного з компонентів, що входять до складу комплексу, може призвести до його руйнування. Візьмемо розчини двох солей нікелю: NiSO4, [Ni(NH3)6]SO4, в яких мають місце рівноваги:
N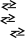 iSO4
Nі2+
+ SO42-
iSO4
Nі2+
+ SO42-
[Ni(NH3)6]SO4 [Ni(NH3)6]2+ + SO42-
[Ni(NH3)6]2+ Ni2+ + 6NH3
При додаванні розчину NаОН в першому розчині випаде осад Ni(ОH)2, а в другому осаду не утвориться.
Для утворення осаду необхідно, щоб добуток концентрації йонів СNi2+·С2ОН- перевищило величину добутку розчинності ДРNi(ОH)2. Комплексний йон [Ni(NH3)6]2+ хоч і дисоціює на йони Ni2+ і молекули NH3, але настільки мало, що концентрація СNi2+ недостатня для досягнення величини ДР, тому осаду не утворюється.
При додаванні до розчинів NiSO4 і [Ni(NH3)6]SO4 амоній сульфіду випадає осад NiS. Нікель сульфід значно менш розчинний (ДРNiS = 1,4·10-24), ніж гідрооксид нікелю (ДР Ni(ОH)2 = 7,0·10-14). Концентрація йонів Ni2+ навіть у розчині комплексної солі достатня для досягнення величини ДРNiS.
Якщо йони S2- зв’язують йони Ni2+, то в системі, що знаходиться у рівновазі:
[Ni(NH3)6]2+↔ Ni2+ + 6NH3
зміщується рівновага в бік дисоціації комплексного йону, що призводить до повного руйнування комплексного йону.
Лабораторна робота
Дослід 1.
Виявлення йонів, що входять до складу
подвійної солі
![]()
![]()
У три пробірки
налити по 5 крапель розчину![]() ,
в одну додати 3 каплі розчину
гексанітрокобальтат (Ш) натрію
,
в одну додати 3 каплі розчину
гексанітрокобальтат (Ш) натрію![]() ,
в другу – 3 каплі розчину
,
в другу – 3 каплі розчину
![]() ,
в третю – 3 краплі розчину
,
в третю – 3 краплі розчину
![]() . На підставі спостережень зробити
висновок про характер електролітичної
дисоціації
і скласти йонні рівняння усіх трьох
реакцій.
. На підставі спостережень зробити
висновок про характер електролітичної
дисоціації
і скласти йонні рівняння усіх трьох
реакцій.
Дослід 2. Йони комплексної солі
а) До 2 крапель
ферум (III)
хлориду
![]() прилити 2 краплі амоній роданіду
прилити 2 краплі амоній роданіду
![]()
![]() .
Напишіть рівняння відповідної реакції,
що є характерною для ферум (III) –йона
.
Напишіть рівняння відповідної реакції,
що є характерною для ферум (III) –йона
![]() і
тому при необхідності застосовується
для його виявлення у відповідній якісній
реакції.
і
тому при необхідності застосовується
для його виявлення у відповідній якісній
реакції.
б) до 2 крапель
розчину гексаціаноферат (III)
калію
![]() прилийте 2 краплі амоній роданіду
прилийте 2 краплі амоній роданіду
![]() .
З’являється чи ні червоне забарвлення?
В розчині
.
З’являється чи ні червоне забарвлення?
В розчині
![]() присутні йони
? Скласти рівняння електролітичної
дисоціації
.
присутні йони
? Скласти рівняння електролітичної
дисоціації
.
Дослід 3. Одержання сполук з комплексним катіоном
У дві пробірки взяти по 4-5 крапель розчину купрум (II) сульфату і ніколь (II) сульфату і додати в кожну краплями розчин амоніаку до утворення осадів основних солей. Далі додати надлишок амоніаку до повного розчинення осадів, що відбувається внаслідок утворення комплексних сполук. Порівняти забарвлення вихідних і одержаних розчинів. Наявність яких йонів обумовлює забарвлення розчинів? Скласти молекулярні і йоні рівняння реакцій утворення основних солей та їх розчинення у надлишку амоніаку. Назвати одержані комплексні сполуки.
Дослід 4. Одержання сполук з комплексним аніоном
а) У пробирку налити
3-5 крапель хром (III)
нітрату
![]() і додати по краплям розчин натрій
гідроксиду
до
утворення осаду. Відмітити колір осаду.
Далі додати надлишок розчину
до повного розчинення осаду. Відмітити
забарвлення розчину. Написати рівняння
реакцій утворення і дисоціації комплексної
сполуки, встановити її координаційну
формулу, враховуючи при цьому, що
координаційне число
і додати по краплям розчин натрій
гідроксиду
до
утворення осаду. Відмітити колір осаду.
Далі додати надлишок розчину
до повного розчинення осаду. Відмітити
забарвлення розчину. Написати рівняння
реакцій утворення і дисоціації комплексної
сполуки, встановити її координаційну
формулу, враховуючи при цьому, що
координаційне число
![]() дорівнює
6. Дати назву одержаній комплексній
сполуці.
дорівнює
6. Дати назву одержаній комплексній
сполуці.
б) У пробірку налити
по 3-4 краплі концентрованих розчинів
кобальт (II)
хлориду
![]() та
амоній роданіду
.
Розчин забарвлюється в синій колір,
який притаманний йонам
та
амоній роданіду
.
Розчин забарвлюється в синій колір,
який притаманний йонам
![]() .
Скласти рівняння реакцій. Розчин залишити
для досліду 8.
.
Скласти рівняння реакцій. Розчин залишити
для досліду 8.
Дослід 5. Комплексні сполуки в реакціях обміну.
а) До 2-3 крапель
розчину купрум (II)
сульфату додати стільки ж крапель
розчину гексаціаноферат (II)
калію
![]() .
Відмітьте колір утворенного осаду та
складіть рівняння реакції.
.
Відмітьте колір утворенного осаду та
складіть рівняння реакції.
б) До 2-3 крапель
розчину ферум (II)
сульфату додати такий же об’єм розчину
гексаціаноферат (III)
калію
![]() .
Спостерігати утворення синього осаду.
Скласти рівняння реакції.
.
Спостерігати утворення синього осаду.
Скласти рівняння реакції.
Дослід 6. Комплексні сполуки в окисно-відновних реакціях.
Налити у пробірку
2-3 краплі розчину
![]() і
подкислити його 2-3 краплями
2 н.
і
подкислити його 2-3 краплями
2 н.
![]() .
Далі додати 5 крапель розчину гексаціаноферат
(II)
калію. Знебарвлення
відбувається внаслідок його відновлення
до мангана (II).
При цьому відновник окислюється до
. Написати рівняння реакцій, підібрати
коефіцієнти електронно-йонним методом.
.
Далі додати 5 крапель розчину гексаціаноферат
(II)
калію. Знебарвлення
відбувається внаслідок його відновлення
до мангана (II).
При цьому відновник окислюється до
. Написати рівняння реакцій, підібрати
коефіцієнти електронно-йонним методом.
Дослід 7. Гідратна ізомерія комплексних сполук
Декілька темно-зелених
крісталів
![]() розчинити у 6-7 краплях води. Відмітити
забарвлення розчину. Нагріти розчин до
зміни його забарвлення. Визначити будову
комплексу до та після нагрівання.
Висновки зробити з урахуванням кольору
гідратних ізомерів:
розчинити у 6-7 краплях води. Відмітити
забарвлення розчину. Нагріти розчин до
зміни його забарвлення. Визначити будову
комплексу до та після нагрівання.
Висновки зробити з урахуванням кольору
гідратних ізомерів:
![]() -синьо-фіолетовий
-синьо-фіолетовий
![]() -темно-зелений
-темно-зелений
![]() -світло-зелений.
-світло-зелений.
Дати назву цим ізомерам.
Дослід 8. Стійкість і руйнування комплексних йонів
а) До розчину комплексної сполуки (дослід 4б) додавати по краплям воду та спостерігати зміну забарвлення. Скласти рівняння електролітичної дисоціації комплексних йонів. Як зміщується рівновага при додаванні води? Як впливає концентрація розчину на стійкість комплексних сполук?
б) У двох пробірках
одержати комплексну сполуку купруму(II)
з амоніаком ( див. дослід 3). В одну пробірку
додати 3-4 краплі розчину
,
а в другу – стільки ж крапель розчину
![]() . Відмітити, додавання якого реактиву
спричиняє утворення осаду. Користуючись
значеннями
. Відмітити, додавання якого реактиву
спричиняє утворення осаду. Користуючись
значеннями
![]() комплексів та ДР гідроксиду та сульфіду
купруму поясніть експериментальні
дані.
комплексів та ДР гідроксиду та сульфіду
купруму поясніть експериментальні
дані.
