
- •Передмова
- •Тема 1. Комплексні сполуки
- •Контрольні запитання та задачі
- •Тема 2. Лужні метали
- •Контрольні запитання та задачі
- •Тема 3. Берилій. Магній. Лужноземельні метали
- •Контрольні запитання та задачі
- •Тема 4. Бор та алюміній
- •Контрольні запитання та задачі
- •Тема 5. Карбон силіцій та їх сполуки
- •Контрольні запитання та задачі
- •Тема 6. Станум, плюмбум та їх сполуки
- •Контрольні запитання та задачі
- •Тема 7. Нітроген та його сполуки
- •Контрольні запитання та задачі
- •Тема 8. Р-елементи VI групи
- •Контрольні запитання та задачі
- •Тема 9. Р-елементи vіі групи
- •Тема 10. Хром та його сполуки
- •Контрольні запитання та задачі
- •Тема 11. Манган та його сполуки
- •Контрольні запитання та задачі
- •Тема 12. Ферум. Кобальт. Нікель
- •Контрольні запитання та задачі
- •Тема 13. Купрум. Аргентум
- •Контрольні запитання та задачі
- •Тема 14. Цинк. Кадмій. Меркурій
- •Контрольні запитання і задачі
- •Список використаної літератури
Контрольні запитання та задачі
У наведених комплексних сполуках
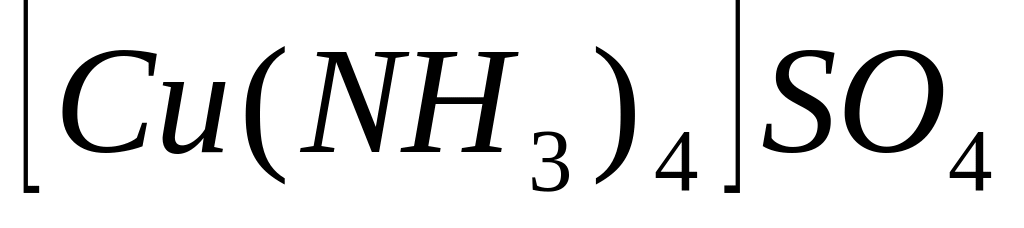 ;
;
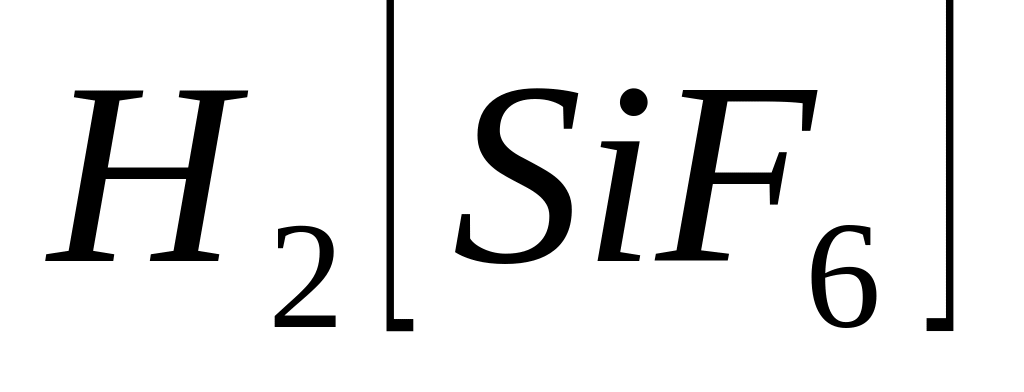 ;
;
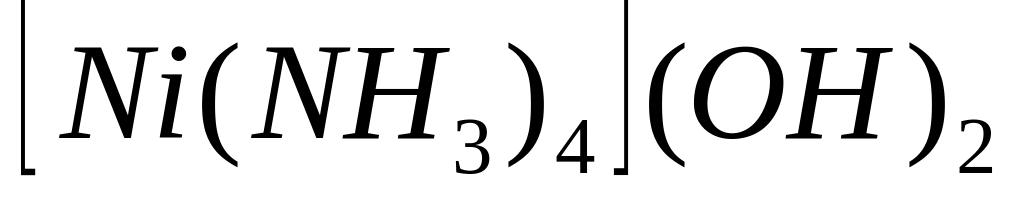 ;
;
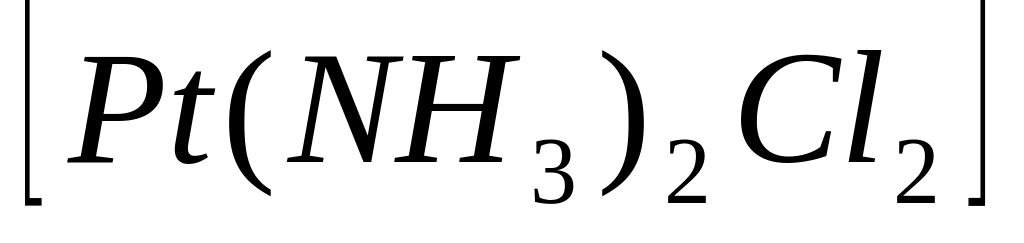 ;
;
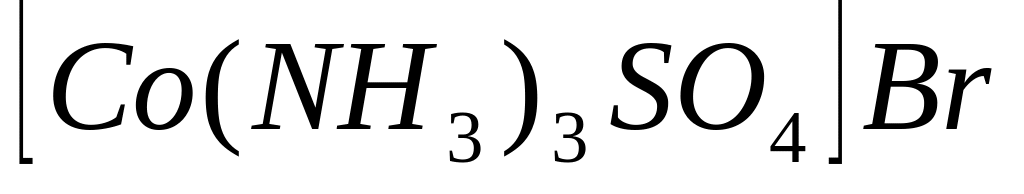 указати зовнішню та внутрішню сфери,
комплексоутворювач, ліганди, координаційне
число комплексоутворювача, заряд
комплексного йону та комплексоутворювача.
Указати до яких класів неорганічних
сполук належать ці комплекси. Записати
їх назви.
указати зовнішню та внутрішню сфери,
комплексоутворювач, ліганди, координаційне
число комплексоутворювача, заряд
комплексного йону та комплексоутворювача.
Указати до яких класів неорганічних
сполук належать ці комплекси. Записати
їх назви.Визначити заряд для комплексних йонів
 ;
;
 ;
;
 ,
якщо комплексоутворювачами є йони
,
якщо комплексоутворювачами є йони

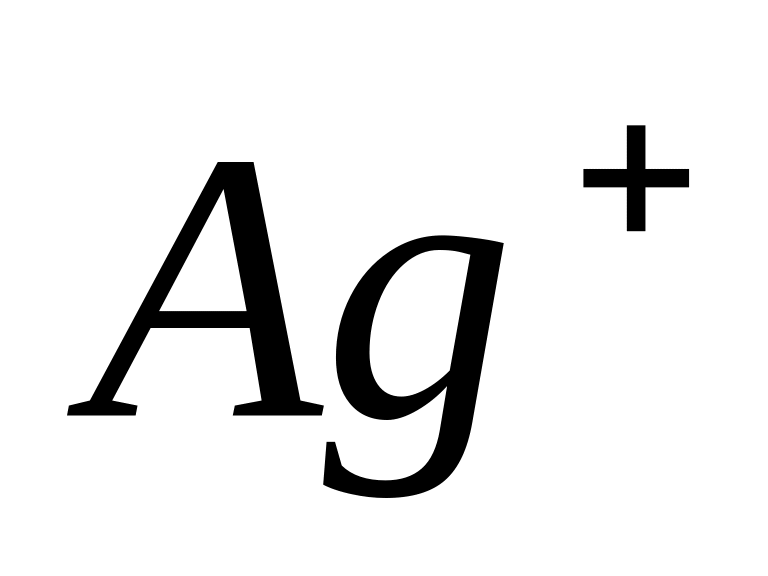 ;
;
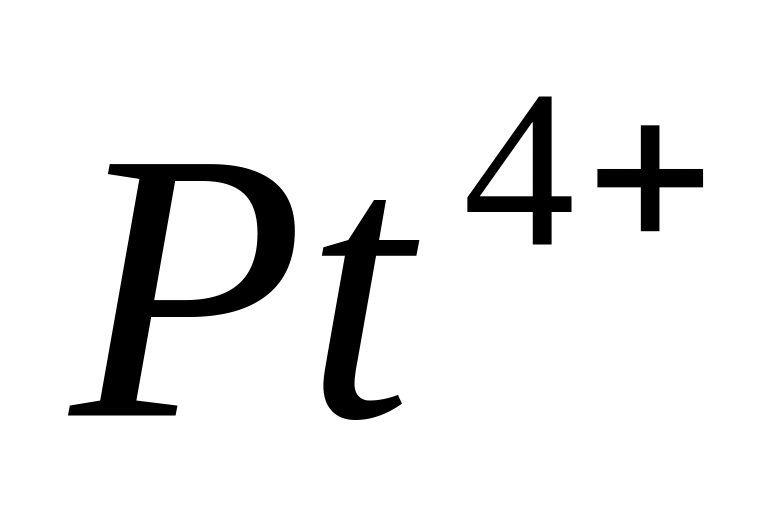 .
.Написати координаційні формули сполук з координаційним числом кобальту (III), що дорівнює 6:
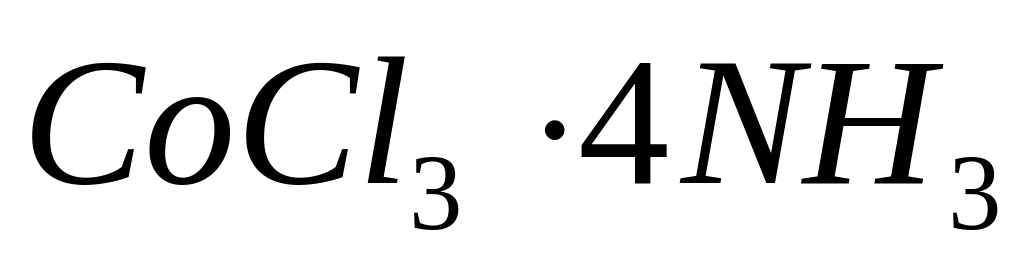 ;
;
 ;
;
 . Назвати одержані сполуки, написати
рівняння їх дисоціації.
. Назвати одержані сполуки, написати
рівняння їх дисоціації.Написати рівняння первинної та вторинної дисоціації комплексних сполук
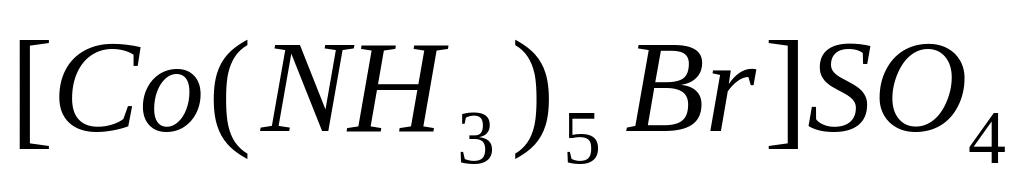 та
та
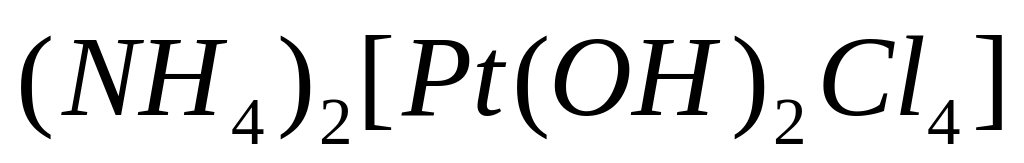 .
Написати вирази їх констант нестійкості.
.
Написати вирази їх констант нестійкості.
З позиції методу ВЗ визначити тип гібридизації АО комплексоутворювача та просторову будову комплексного йону
 .
.Користуючись константами нестійкості розмістити у послідовності зростання стійкості йони:
 ;
;
 ;
;
 .
Якщо:
.
Якщо:
Кнест =1,9·10-9;
Кнест =9,3·10-8;
Кнест =1,1·10-21
Написати рівняння реакцій, які перебігають з утворенням комплексних сполук з координаційним числом 6:
а)
![]() +
(надл.)
+
(надл.)
![]()
б)
![]() +
+
![]() (надл.)
(надл.)
в)
![]() +
+
![]() *
*
![]() (надл.)
(надл.)
Тема 2. Лужні метали
Основні теоретичні відомості
До головної підгрупи І групи елементів періодичної системи належать лужні метали: Літій Li, Натрій Na, Калій К, Рубідій Rb, Цезій Cs, Францій Fr. У зовнішньому електронному шарі атомів лужних металів розміщується по одному електрону, у передостанньому електронному шарі атома Літію міститься два електрони, а у решти атомів лужних металів по вісім електронів. Тому атоми цих елементів легко віддають один електрон, тобто мають низьку енергію йонізації, яка зменшується в підгрупі зверху вниз. Послаблення зв'язку електрона з ядром (зниження енергії йонізації) зумовлено зростанням радіусів атомів і екрануванням позитивно зарядженого ядра електронами внутрішніх шарів. Тому лужні метали легко утворюють катіони Ме+. по схемі: Ме – 1 е- = Ме+ . Всі лужні метали проявляють ступінь окиснення +1 та валентність 1. Радіуси атомів збільшуються зі збільшенням порядкового номеру елемента, і в цьому ж напрямку збільшуються їх відновна активність. Всі лужні метали дуже сильні відновники.
Зі збільшенням протонних чисел елементів радіуси їхніх атомів зростають, енергії йонізації зменшуються, а металічні властивості посилюються. Отже, найактивнішим з лужних металів є Францій.
Зберігаються лужні метали під шаром керосину, так як на повітрі вони досить швидко окислюються за рівнянням:
4Ме + О2 = 2 Ме2О
Лужні метали дуже м'які, легкоплавкі. Для літію, натрію, калію і рубідію характерний сріблясто-білий блиск, для цезію — золотистий. На повітрі лужні метали легко тьмяніють (Rb і Cs здатні самозайматися), реакція прискорюється під дією вологи. Лужні метали мають високі електро- і теплопровідність.
Робота з лужними металами потребує обережності, оскільки вони легко займаються, бурхливо реагують з водою та іншими речовинами.
Завдяки дуже високій активності лужні метали здатні реагувати з сухим воднем під час нагрівання з утворенням гідридів Ме, з азотом під час нагрівання з утворенням нітридів Ме3N.
Рубідій і цезій у кисні здатні самозайматися, натрій і літій займаються лише під час нагрівання. Тільки літій утворює оксид Li2O, а всі інші лужні метали — пероксиди або надпероксиди. Так, натрій внаслідок взаємодії з киснем утворює пероксид Na2O2, а К, Rb, Cs — надпероксиди МеО2.
Пероксиди і надпероксиди лужних металів — сильні окисники.
Оксиди натрію, калію, рубідію і цезію можна добути окисненням у разі нестачі кисню або під час взаємодії стехіометричних кількостей металу і пероксиду. Оксиди Li2O і Na2O — безбарвні, К2О і Rb2O — мають жовте забарвлення, Cs2O — оранжеве.
Пероксиди можна розглядати як солі пероксиду гідрогену Н2О2. Під час розчинення у воді пероксиди повністю гідролізують, оскільки кислотні властивості Н2О2 виражені дуже слабко:
Na2O2 + 2Н2О = 2NaOH + Н2О2.
Оксиди лужних металів дуже енергійно взаємодіють з водою з утворенням лугів:
К2О + Н2О = 2КОН.
Ще енергійніше з водою реагують самі лужні метали, причому зі збільшенням протонного числа елемента інтенсивність взаємодії його з водою зростає (Rb і Cs реагують з водою з вибухом):
2К + 2Н2О = 2КОН + Н2↑
Гідроксиди лужних металів, особливо літію, натрію і калію, дуже важливі сполуки.
Водні розчини гідрооксидів є сильними основами і виявляють сильно лужну реакцію внаслідок дисоціації їх на йони за загальною схемою:
М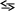 еОН
Ме+
+ ОН-
еОН
Ме+
+ ОН-
Гідроксиди лужних металів розчиняються у воді з виділенням великої кількості теплоти, що свідчить про утворення гідратів. Розчини МеОН у воді дуже агресивні відносно різних речовин, тому їх називають їдкими лугами.
Лужні метали енергійно взаємодіють з кислотами, наприклад:
2Li + 2HCl = 2LiCl + H2 ↑
Важливими солями лужних металів є нітрати, галогеніди, сульфати, карбонати. Всі вони розчинні у воді. Кристалізуючись, утворюють кристалогідрати, отже, вони гігроскопічні. Солі літію найбільш гігроскопічні, а солі цезію — найменш гігроскопічні.
Із солей лужних металів найбільше практичне значення мають: карбонат натрію, або кальцинована сода, Na2CO3, гідрогенкарбонат натрію, або питна сода, NaHCO3 та кристалогідрат Na2CO3·10Н2О, нітрати натрію NaNО3 та калію К NО3 (добрива), хлорид натрію NаCl (поварена сіль).
Якщо внести в полум'я пальника сіль лужного металу, воно набуде забарвлення, характерного для даного металу: літій забарвлює полум'я в кармінно-червоний колір, натрій — у жовтий, калій — у фіолетовий. За забарвленням полум'я можна виявляти ці елементи.
Лабораторна робота
Дослід 1. Взаємодія лужних металів з повітрям та водою.
(Роботу проводити за склом витяжної шафи).
а). Винути пінцетом із банки з керосином шматочок металічного літію, покласти його на фільтровальний папір і відрізати від нього ножем шматочок величиною з горошину. Звернути увагу на потускніння блискучої металічної поверхні свіжого надрізу. Добре просушити метал фільтровальним папіром і помістити у фарфорову чашку наповнену водою. Прикрити чашку склом. Спостерігайте за ходом реакції. Який газ виділяється?
б). Аналогічні досліди провести з металічним натрієм та калієм. Визначити, який з металів найбільш активно взаємодіє з водою. Чи узгоджується ций висновок з його положенням в ряді стандартних електродних потенціалів. Який газ при цьому виділяється? Дослідити реакцію розчинів фенолфталеіном. Написати рівняння відповідних реакцій.
Дослід 2. Взаємодія натрій пероксиду з волою.
В суху пробірку внести 1 мікрошпатель натрій пероксиду і додати 4-5 крапель води. Розчин підігріти і внести у пробірку тліючу скіпку. Який газ при цьому виділяється? Після закінчення реакції до розчину додати 1-2 краплі фенолфталеїну. У який колір забарвлюється розчин в пробірці? Скласти рівняння реакцій натрій пероксиду з водою.
Дослід 3 Гідроліз солей лужних металів.
У три пробірки помістити окремо декілька кристалів калій хлориду, натрій карбонату, натрій фосфату. Прилити по 2-3 мл дистильованої води і додати 1 краплю лакмусу. Які солі повинні підлягати гідролізу і чому? Написати рівняння відповідних реакцій гідролізу в молекулярній та йонній формах.
Дослід 4.
Якісні реакції на катіони натрію
![]() та калію
та калію
![]() .
.
а). У пробірку з
2-3 краплями розчину натрій хлориду
додати таку саму кількість розчину
гексагідроксостибіатат (V)
калію
![]() .
Реакцію проводити при охолодженні
розчину водою з під крана і потиранні
внутрішніх стінок паличкою. Спостерігати
утворення білого дрібнокристалічного
осаду. Скласти рівняння реакцій в
молекулярній та йонній формах.
.
Реакцію проводити при охолодженні
розчину водою з під крана і потиранні
внутрішніх стінок паличкою. Спостерігати
утворення білого дрібнокристалічного
осаду. Скласти рівняння реакцій в
молекулярній та йонній формах.
б). До 3-4 крапель
розчину калій хлориду додати 3 краплі
розчину комплексної солі гексанітрокобальтат
(III) натрію
і спостерігати за утворенням жовтого
кристалічного осаду гексанітрокобальтат
(III) калію-натрію
![]() .
.
Скласти рівняння в молекулярній та йонній формах.
Дослід 5. Забарвлення полум’я солями лужних металів.
Очищену шляхом промивання в хлоридній кислоті і прожарювання ніхромову проволоку внести у розчин солі Літію, а потім в полум’я пальника. Спостерігати забарвлення полум’я. Теж саме виконати з солями Натрію та Калію.
Ніхромову проволоку після кожної солі промити у хлоридній кислоті і прожарити до повного зникнення забарвлення полум’я.
