
- •1.Основные понятия и законы химии
- •2.Основные понятия и законы химии
- •3.Основные понятия и законы химии
- •4.Основные понятия и законы химии
- •5.Основные понятия и законы химии
- •6.Строение и св-ва атомов
- •7.Строение и св-ва атомов
- •8.Строение и св-ва атомов
- •9.Строение и св-ва атомов
- •10.Строение и св-ва атомов
- •11.Химическая связь и строение молекул
- •12.Химическая связь и строение молекул
- •13.Химическая связь и строение молекул
- •14.Химическая связь и строение молекул
- •15.Химическая связь и строение молекул
- •16.Энергетика химических процессов
- •17.Энергетика химических процессов
- •18.Энергетика химических процессов
- •19.Энергетика химических процессов
- •21.Химическая кинетика и химическое равновесие
- •23.Химическая кинетика и химическое равновесие
- •24.Химическая кинетика и химическое равновесие
- •25.Химическая кинетика и химическое равновесие
- •27.Растворы. Дисперсные системы.
- •28.Растворы. Дисперсные системы.
- •29.Вопрос: Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •30.Растворы. Дисперсные системы.
- •31.Растворы. Дисперсные системы.
- •32.Растворы. Дисперсные системы.
- •33.Растворы. Дисперсные системы.
- •34.Растворы. Дисперсные системы.
- •35.Растворы. Дисперсные системы.
- •36.Растворы. Дисперсные системы.
- •41.Окислительно-восстановительные реакции. Электрохимические системы.
- •42.Окислительно-восстановительные реакции. Электрохимические системы.
- •43.Окислительно-восстановительные реакции. Электрохимические системы.
- •44.Окислительно-восстановительные реакции. Электрохимические системы.
- •45.Окислительно-восстановительные реакции. Электрохимические системы.
- •46.Окислительно-восстановительные реакции. Электрохимические системы.
- •47.Окислительно-восстановительные реакции. Электрохимические системы.
- •48.Окислительно-восстановительные реакции. Электрохимические системы.
- •49.Окислительно-восстановительные реакции. Электрохимические системы.
- •50.Окислительно-восстановительные реакции. Электрохимические системы.
- •51.Полимерные органические материалы
- •52.Полимерные органические материалы
- •53.Полимерные органические материалы
- •54.Полимерные органические материалы
- •55.Полимерные органические материалы
- •56.Полимерные органические материалы
- •57.Полимерные органические материалы
- •58.Полимерные органические материалы
12.Химическая связь и строение молекул
Вопрос: Основные типы гибридизации АО. Теория локализованных электронных пар.
Для объяснения отличия валентных углов в молекулах H2O (104,5°) и NH3 (107,3°) от 90° следует принять во внимание, что устойчивому состоянию молекулы отвечает ее геометрическая структура с наименьшей потенциальной энергией. Поэтому при образовании молекулы форма и взаимное расположение атомных электронных облаков * изменяется по сравнению с их формой и расположением в свободных атомах. В результате достигается более полное перекрывание орбиталей * при образовании химической связи. Такая деформация электронных облаков требует затраты энергии, но более полное перекрывание приводит к образованию более прочной связи, и в целом получается выигрыш в энергии. Этим и объясняется возникновение гибридныхорбиталей.
Форма гибридной орбитали может быть определена математически путем сложения волновых функций * исходных орбиталей:
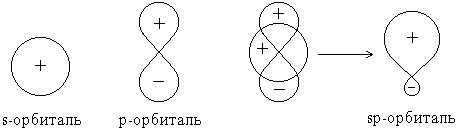
В результате сложения волновых функций s- и p-орбиталей с учетом их знаков оказывается, что плотность электронного облака (величина |y|2) по одну сторону от ядра повышена, а по другую – понижена.
В целом процесс гибридизации включает следующие этапы: возбуждение атома *, гибридизация орбиталей возбужденного атома, образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибриднымиорбиталями. Тип гибридизации определяется типом и количеством участвующих в ней орбиталей.
Ниже рассмотрены примеры различных видов гибридизации s- и p-орбиталей.
Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании галогенидов бериллия, цинка, кадмия и ртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон. При образовании химической связи * эти две различные орбитали преобразуются в две одинаковые гибридные орбитали (sp-орбитали), направленные под углом 180° друг к другу, – две связи имеют противоположное направление (рисунок 3.5).
![]()
Рисунок 3.5 – Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2
Экспериментальное определение структуры молекул BeГ2, ZnГ2, CdГ2, HgГ2 (Г–галоген) показало, что эти молекулы являются линейными, и обе связи металла с атомами галогена имеют одинаковую длину.
Гибридизация одной s- и двух p-орбиталей (sp2-гибридизация) имеет место, например, при образовании соединений бора. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя p-электронами. Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу (рисунок 3.6). Действительно, как показывают экспериментальные исследования, молекулы таких соединений бора, как BГ3 (Г-галоген), B(CH3)3 – триметилбор, B(OH)3 – борная кислота, имеют плоское строение. При этом три связи бора в указанных молекулах имеют одинаковую длину и расположены под углом 120°.
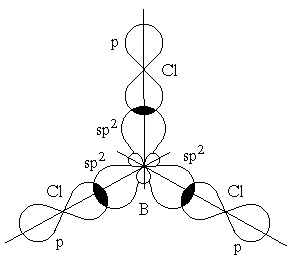 Рисунок
3.6 – Перекрывание sp2-орбиталей бора и
p-орбиталей хлора в молекуле BCl3
Рисунок
3.6 – Перекрывание sp2-орбиталей бора и
p-орбиталей хлора в молекуле BCl3
Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. В этом случае четыре гибридные sp3-орбитали расположены под углом 109°28¢ друг к другу; они направлены к вершинам тетраэдра (в молекулах CH4, CCl4, SiH4, GeBr4 и др.). Валентные углы в молекулах H2O (104,5°) и NH3 (107,3°) не точно соответствуют взаимному расположению “чистых” p-орбиталей (90°). Это обусловлено некоторым вкладом s-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация. Валентные электроны в этих молекулах занимают четыре орбитали, которые близки к sp3-гибридным. Незначительное отличие валентных углов от тетраэдрических 109°28¢ объясняется тем, что гибридизация в данном случае является неполной.
Во многих молекулах центральный атом не подвергается гибридизации. Так, валентные углы в молекулах H2S, PH3 и др. близки к 90°, т.е. образование связей происходит с участием “чистых” p-орбиталей, расположенных под прямым углом друг к другу.
Теория локализованных пар.
Теория локализованных пар ограничена в основном несопряжёнными органическими и простыми неорганич. соединениями. Так, в случае "электронно-избыточных" молекул типа PF5, SF6, IF7, XeF6 эта теория не может объяснить осуществления высших В. у атомов Р, S, I, Хе-без привлечения валентных состояний с большими целочисленными заселённос-тями внешних d-орбиталей (sp3d для Р, sp3d3 для I, s2p3d3 для Хе и т. д.); однако энергии возбуждения последних столь велики (200-400 ккал/моль и более), что затраты на их возбуждение вряд ли могут окупиться за счёт выигрыша в энергии при образовании связей. Аналогичные трудности возникают при рассмотрении комплексных соединений, координационных кристаллов и т. д. В "электронно-дефицитных" молекулах типа В2Нв (рис. 1,е) число связей, образуемых атомом Н, больше числа имеющихся у него валентных АО, так что связи мостиковых Н с двумя атомами В могут быть описаны только трёхцентровыми молекулярными орбиталями, охватывающими фрагменты В - Н - В. В случае ароматических и сопряжённых молекул типа С3H5, С6Н6, С7Н7 и др., их комплексов с металлами (рис. 3) и других производных валентные 2рл-электроны в равной степени принадлежат всем атомам С и могут быть описаны лишь с помощью делокализованных молекулярных орбиталей, охватывающих всё кольцо или углеродный остов в целом. Иными словами, представления о локализованных В. и связях оказались слишком узкими, чтобы вместить все известные типы соединений.ВАЛЕНТНОСТЬ в языкознании, потенциальная сочетаемость языковых элементов (фонемы, морфемы, слова и т. д. ), определяющая способность вступать в комбинации с другими языковыми элементами, преим. того же уровня. В. является категориальной или индивидуальной в зависимости от того, подразумевается ли сочетаемость целых классов слов (напр., глаголов-сказуемых с существительными-подлежащими) или отд. слов (напр., слова "знобит" с одушевлёнными существительными в винит, падеже). Если при функционировании элемента В. непременно реализуется, то она паз.обязательной. При простой В. элемент сочетается с одним элементом, при комплексной (многоместной) В. - одновременно с несколькими (напр., сказуемое употребляется одновременно с подлежащим, дополнением и обстоятельством). Тождество В. является одним из оснований для объединения элементов в один класс. Исчисление В. языковых элементов, особенно на синтаксич. уровне,- распространённый метод формального анализа языка.
