
- •1.Основные понятия и законы химии
- •2.Основные понятия и законы химии
- •3.Основные понятия и законы химии
- •4.Основные понятия и законы химии
- •5.Основные понятия и законы химии
- •6.Строение и св-ва атомов
- •7.Строение и св-ва атомов
- •8.Строение и св-ва атомов
- •9.Строение и св-ва атомов
- •10.Строение и св-ва атомов
- •11.Химическая связь и строение молекул
- •12.Химическая связь и строение молекул
- •13.Химическая связь и строение молекул
- •14.Химическая связь и строение молекул
- •15.Химическая связь и строение молекул
- •16.Энергетика химических процессов
- •17.Энергетика химических процессов
- •18.Энергетика химических процессов
- •19.Энергетика химических процессов
- •21.Химическая кинетика и химическое равновесие
- •23.Химическая кинетика и химическое равновесие
- •24.Химическая кинетика и химическое равновесие
- •25.Химическая кинетика и химическое равновесие
- •27.Растворы. Дисперсные системы.
- •28.Растворы. Дисперсные системы.
- •29.Вопрос: Осмос, осмотическое давление. Закон Вант-Гоффа для бесконечно разбавленных растворов неэлектролитов.
- •30.Растворы. Дисперсные системы.
- •31.Растворы. Дисперсные системы.
- •32.Растворы. Дисперсные системы.
- •33.Растворы. Дисперсные системы.
- •34.Растворы. Дисперсные системы.
- •35.Растворы. Дисперсные системы.
- •36.Растворы. Дисперсные системы.
- •41.Окислительно-восстановительные реакции. Электрохимические системы.
- •42.Окислительно-восстановительные реакции. Электрохимические системы.
- •43.Окислительно-восстановительные реакции. Электрохимические системы.
- •44.Окислительно-восстановительные реакции. Электрохимические системы.
- •45.Окислительно-восстановительные реакции. Электрохимические системы.
- •46.Окислительно-восстановительные реакции. Электрохимические системы.
- •47.Окислительно-восстановительные реакции. Электрохимические системы.
- •48.Окислительно-восстановительные реакции. Электрохимические системы.
- •49.Окислительно-восстановительные реакции. Электрохимические системы.
- •50.Окислительно-восстановительные реакции. Электрохимические системы.
- •51.Полимерные органические материалы
- •52.Полимерные органические материалы
- •53.Полимерные органические материалы
- •54.Полимерные органические материалы
- •55.Полимерные органические материалы
- •56.Полимерные органические материалы
- •57.Полимерные органические материалы
- •58.Полимерные органические материалы
44.Окислительно-восстановительные реакции. Электрохимические системы.
Вопрос: ЭДС окислительно-восстановительного процесса, направление протекания ОВР.
Измерение ЭДС цепи. Работа электрохимической цепи.
Электрический потенциал – работа внешних электростатических сил по перемещению единичного положительного заряда из точки с ϕ = 0 в данную точку (или: работа системы по перемещению единичного отрицательного заряда из точки с ϕ = 0 в данную точку).
Абсолютные потенциалыизмерить невозможно.
Разность потенциалов можно определить экспериментально, например, если включить в электрохимическую цепь вольтметр с очень высоким внутренним
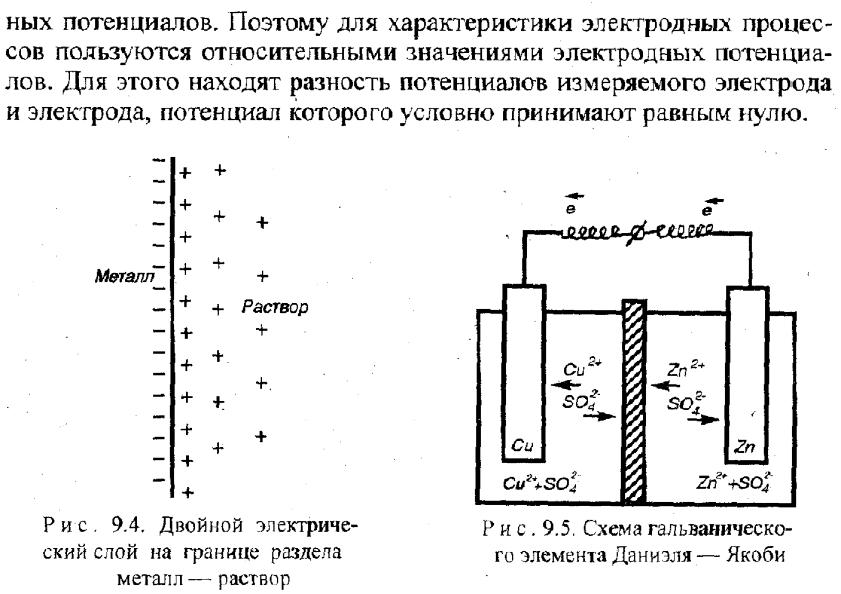
сопротивлением, R≥1012Ом. Так, электродвижущая сила (ЭДС) элемента Даниэля, измеренная при стандартных условиях:
E = ϕ CuСu+ - ϕ ZnZn+= 1.1 В.
Учитывая определение потенциала, данное выше, электродвижущая сила электрохимической ячейки E = ϕOx-ϕRedэто максимальная работа, совершаемая электрохимической цепью при перемещении единичного -заряда по внешней цепи от анода к катоду. (Например, в элементе Даниэля при стандартных условиях E=1.1 В – работа по перемещению единичного отрицательного заряда от Zn-анода к Cu-катоду.)
При взаимодействии 1 моль Zn и 1 моль CuSO4 переносится n = 2 моль электронов, система совершает работу Аэ/х= Q·E = n·e·NA·E (где Q= n·e·NA – общий заряд n моль электронов, прошедших от анода к катоду, e – заряд одного электрона, NA – число Авогадро) :
Аэ/х = n·F·E
Число Фарадея F - это фундаментальная постоянная, равная заряду одного моля электронов.
F = e·NA = 1.60218·10-19Кл·6.022045·1023моль-1 = 96484.6 Кл/моль ≈ ≈ 96500 Кл/моль
В нашем примере: Аэ/х = 2·96500·1.1 = 212300 Дж = 212.3 кДж.

45.Окислительно-восстановительные реакции. Электрохимические системы.
Вопрос: Электронный потенциал. Условные электродные потенциалы.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.



![]()

46.Окислительно-восстановительные реакции. Электрохимические системы.
Вопрос: Гальванические элементы. ЭДС гальванического элимента.



