
- •Хімічна термодинаміка
- •Внутрішня енергія і перший закон термодинаміки.
- •Робота термодинамічних процесів
- •Оборотне ізотермічне розширення газу ( ).
- •Теплоємність
- •Теплові ефекти хімічних реакцій. Ентальпія
- •Цикл карно
- •Другий закон термодинаміки
- •Ентропія
- •Обчислення ентропії
- •Ентропія суміші газів
- •Постулат Планка. Абсолютні значення ентропії
- •Статистична інтерпретація ентропії
- •Зміна ентропії в процесах, які протікають в ізольованих системах
- •Характеристичні функції у термодинаміці
- •Ізохорно - ізотермічний потенціал.
- •Проінтегруємо вираз :
- •Хімічний потенціал
- •Розглянемо перший закон термодинаміки для закритої системи, яка не обмінюється речовиною з навколишнім середовищем:
- •Хімічний потенціал ідеального газу
Робота термодинамічних процесів
Нехай
розширюючись в циліндрі, газ переміщує
поршень на віддаль
![]() ,
а із зовні на цей поршень діє тиск
,
а із зовні на цей поршень діє тиск
![]() .
Сила тиску
.
Сила тиску
![]() залежить від площі поверхні поршня:
залежить від площі поверхні поршня:
![]() .
Робота сили
при
переміщенні поршня із стану (1) до стану
(2) буде:
.
Робота сили
при
переміщенні поршня із стану (1) до стану
(2) буде:
![]() .
.
Тут
![]() - зміна об’єму газу під поршнем.
- зміна об’єму газу під поршнем.
Робота розширення газу в циліндрі матиме знак „+”, адже в цьому випадку напрям діячої сили співпадає з напрямом руху поршня.
Елементарну роботу
розширення газу можна виразити через
нескінченно малу зміну об’єму. Якщо
![]() , то
, то
![]() і елементарна робота розширення
запишеться так:
і елементарна робота розширення
запишеться так:
![]() .
.
Якщо
в процесі виконання роботи початковий
об’єм був
![]() ,
а кінцевий
,
а кінцевий
![]() ,
то виконана робота визначиться шляхом
інтегрування :
,
то виконана робота визначиться шляхом
інтегрування :
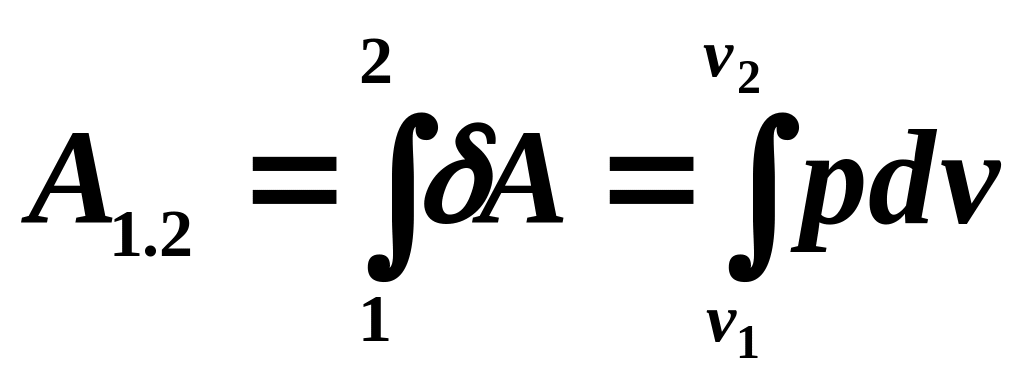 ,
наприклад:
,
наприклад:
1)
процес протікає при незмінному об’ємі
(ізохорний процес,
![]() ):
):
 ;
;
2)
процес здійснюється при постійному
тиску (ізобарний процес,
![]() ):
):
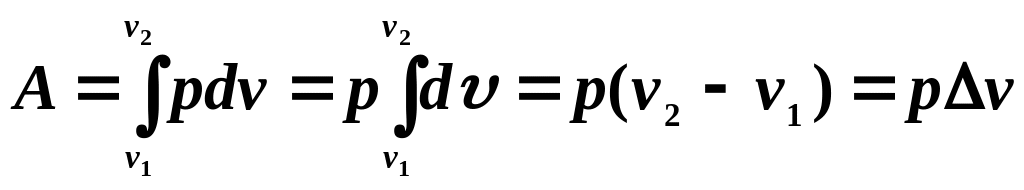 .
.
Зауваження:
Домовимося позначати об’єм одного
моля газу при заданих умовах (![]() )
буквою
)
буквою
![]() ,
а об’єм
,
а об’єм
![]() молів газу – буквою
молів газу – буквою
![]() .
Отже, за однакових умов:
.
Отже, за однакових умов:
![]() .
.
Оборотне ізотермічне розширення газу ( ).
Для
ідеального газу
![]() ,
звідки
,
звідки
![]() ;
тут
,
;
тут
,
![]() ,
,
![]() є константи.
є константи.
При ізотермічному переході системи із стану (1) до стану (2) виконана робота дорівнює:
 ;
;
![]() .
.
Максимальну роботу, що виконується при оборотному ізотермічному розширенні можна записати через тиски:
![]()
![]()
Враховуючи,
що тиск пропорційний концентрації
атомів
![]() ,
одержимо:
,
одержимо:
![]() .
.
Теплоємність
Середню питому
(с) або мольну теплоємність (С)
можна визначити експериментально як
відношення кількості теплоти
![]() ,
що поглинається при нагріванні відповідно
1кілограму або 1 моля речовини на
,
що поглинається при нагріванні відповідно
1кілограму або 1 моля речовини на
![]() градусів при заданих умовах. Розрізняють
теплоємність при сталому тиску
градусів при заданих умовах. Розрізняють
теплоємність при сталому тиску
![]() або сталому об’ємі
або сталому об’ємі
![]() .
Середня теплоємність
.
Середня теплоємність
![]() в температурному інтервалі
в температурному інтервалі
![]() визначається відношенням переданого
тепла
до величини температурного інтервалу
визначається відношенням переданого
тепла
до величини температурного інтервалу
![]() :
:
![]()
Щоб знайти істинні
значення теплоємностей, необхідною
умовою є
![]() ,
тобто,
,
тобто,
![]() :
:
![]() .
.
При низьких температурах (нижче 15К) теплоємність можна пояснити лише з позицій квантової теорії. У спрощеній формі ця теорія дає такий вираз для низькотемпературної теплоємності:
![]() ( формула Дебая)
( формула Дебая)
![]() – температура
Дебая. Вона знаходиться емпірично для
кожної речовини і дається в довідниках.
– температура
Дебая. Вона знаходиться емпірично для
кожної речовини і дається в довідниках.
Теплові ефекти хімічних реакцій. Ентальпія
Запишемо
перший закон термодинаміки для процесу
в якому виконується лише ізобарична
робота розширення
![]()
![]() ;
;
![]() .
.
Якщо
,
то можна записати, що
![]() ,
де
і
є термодинамічними параметрами стану,
а
-
функція стану термодинамічної системи.
Отже, сума
,
де
і
є термодинамічними параметрами стану,
а
-
функція стану термодинамічної системи.
Отже, сума
![]() теж є функцією стану і її зміна не
залежить від шляху перебігу процесу, а
лише залежить від початкового та
кінцевого станів термодинамічної
системи. Цю функцію називають ентальпією
теж є функцією стану і її зміна не
залежить від шляху перебігу процесу, а
лише залежить від початкового та
кінцевого станів термодинамічної
системи. Цю функцію називають ентальпією
![]() .
Якщо система переходить від стану (1) до
стану (2), то після інтегрування виразу
.
Якщо система переходить від стану (1) до
стану (2), то після інтегрування виразу
![]() знайдемо:
знайдемо:
 ,
,
![]() ,
,
або
згрупувавши за станами системи, одержимо
значення
![]() :
:
![]() ,
,
Висновок:
теплота, що передається в ізобаричному
процесі, дорівнює приросту ентальпії
,
або
![]() .
Абсолютне значення ентальпії
.
Абсолютне значення ентальпії
![]() не можна обчислити за допомогою рівнянь
термодинаміки тому, що до нього входить
абсолютна величина внутрішньої енергії
.
не можна обчислити за допомогою рівнянь
термодинаміки тому, що до нього входить
абсолютна величина внутрішньої енергії
.
Якщо
реакції протікають без участі газової
фази, то для рідин і твердих тіл зміна
об’єму з температурою є незначною
![]() і цією величиною можна знехтувати. Тоді
і цією величиною можна знехтувати. Тоді
![]() .
.
Розглянемо
термохімічний процес з участю газової
фази при
![]() для ідеального газу, що переходить із
початкового стану (1) до кінцевого (2).
для ідеального газу, що переходить із
початкового стану (1) до кінцевого (2).
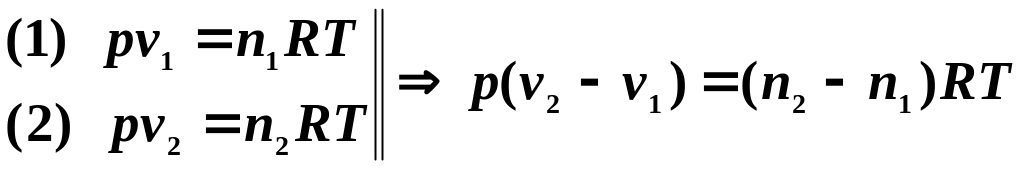 ,
,
або
![]() ,
,
де
![]() ‑ зміна числа молів газоподібних
речовин в процесі реакції. Враховуючи,
що
‑ зміна числа молів газоподібних
речовин в процесі реакції. Враховуючи,
що
![]() де
де
![]() ,
знайдемо передану теплоту при сталому
тиску:
,
знайдемо передану теплоту при сталому
тиску:
![]()
Для
ідеального газу
![]() .
Виходячи з цього, одержимо формулу для
обчислення зміни ентальпії ідеального
газу в ізобаричному та ізотермічному
процесах:
.
Виходячи з цього, одержимо формулу для
обчислення зміни ентальпії ідеального
газу в ізобаричному та ізотермічному
процесах:
![]()
![]() .
.
Властивості
ентальпії враховує закон Гесса: якщо
термодинамічний процес складається з
декількох етапів, то загальний тепловий
ефект цього процесу дорівнює алгебраїчній
сумі теплових ефектів всіх етапів.
Покажемо це. Нехай поцес складається
із
![]() етапів. Для
етапів. Для
![]() -го
етапу
-го
етапу
![]() .
Знаходимо суму ентальпій всіх етапів:
.
Знаходимо суму ентальпій всіх етапів:
![]()
