
- •1.Основные химические законы и понятия.
- •2. Строение атомов. Модель атома по Резерфорду, по Бору.
- •3.Волновые свойства электрона.Принцип неопределенности Гейзенберга.
- •4. Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5.Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами
- •6. Периодический закон д.И.Менделеева. Структура периодической системы.
- •8.Химическая связь и валентность
- •9. Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10.Ионная связь. Типы ковалентных молекул.
- •11.Межмолекулярные взаимодействия, их типы, характеристика.
- •12. Донорно-акцепторная связь. Водородная связь.
- •13. Металлическая связь. Структура твердых тел.
- •14.Элементы химической термодинамики. Первое начало термодинамики.
- •15.Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствие из него.
- •16. Элементы второго начала термодинамики. Энтропия.
- •17.Энергия Гиббса. Направленность химических процессов.
- •18. Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19. Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20. Цепные реакции. Гомогенный катализ.
- •21. Скорость гетерогенных реакций. Гетерогенный катализ
- •22.Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твердых тел, жидкостей в жидкостях
- •23.Первый и второй закон Рауля.Осмотическое давление. Закон Ван-Гоффа.
- •24. Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25. Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26. Диссоциация воды. Водородный показатель
- •27. Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28. Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29. Теория гальванического элементов.
- •Избыточные электроны перейдут с электрода
- •30. Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31. Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея
- •32. Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33.Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34. Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35. Топливные элементы.
- •36. Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37. Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38. Методы защиты металлов от коррозии
- •39. Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40. Получение металлов из руд.Способы получения металлов высокой чистоты.
- •2.Термическое разложение йодидов металлов.
- •41. Общие химические свойства металлов.
- •3.Взаимодействие с растворами кислот.
- •4.Взаимодействие с концентрированной серной кислотой.
- •5. Взаимодействие с азотной кислотой
- •6. Взаимодействие со смесями кислот.
- •42.Легкие конструкционные материалы. Алюминей. Свойства, получение, применение в технике, важнейшие соединения.
- •43 Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44. Олово.Железо. Свойства, получение, применение, важнейшие соединения.
- •45.Высокомолекулярные соединения, их виды, способы получения вмс.
- •46. Получение вмв с помощью поликонденсации
- •47. Применение полимеров. Основные полимеры,получаемые полимеризацией.
- •48. Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
9. Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
Теория ковалентной связи, основанная Г.Н.Льюисом в 1916 году, заключалась в том, что химическая связь возникает в результате образования общей электронной пары между взаимодействующими атомами.
Характеризуется
увеличение электронной плотности между
ядрами связанных атомов. Каждый атом
предоставляет один или несколько
электронов для образования химической
связи. Происходит образование общих
электронных пар, достраивающих электронные
уровни обоих атомов. В зависимости от
того, сколько электронов способен
предоставить каждый атом происходит
образование одной (одинарная) или
нескольких (кратная) электронных пар.
В результате на прямой, соединяющей два
атомных ядра происходит увеличение
электронной плотности, к которой
притягиваются атомные ядра. Идеальная
ковалентная связь характерна только
для двух одинаковых атомов. Например
Cl2, N2. В случае Cl2, каждый из атомов хлора,
имеющих на внешней электронной оболочке
семь электронов и которым для образования
завершенной электронной оболочки не
хватает одного электрона, предоставляет
один неспаренный электрон для образования
электронной пары, которая равномерно
распределена между этими двумя атомами.
У атома азота на внешнем электронном
уровне находится 5 электронов, из которых
три неспаренных, и ему не хватает 3
электронов для получения завершенной
октетной оболочки. Каждый атом азота
предоставляет по три электрона для
образования трех электронных пар,
которые также равномерно распределены
между атомами и происходит образование
тройной связи (кратная ковалентная
связь). В случае разных атомов электронная
плотность смещена в сторону более
электроотрицательного атома, то есть
к тому атому, который более сильно
притягивает к себе электроны. В таком
случае говорят о поляризации химической
связи. В этом случае на одном из атомов,
который более электроотрицателен,
возникает частично отрицательный заряд,
а на другом атоме - частично положительный
заряд. Наглядным примером поляризованной
ковалентной связи может служить молекула
монооксида углерода - CO. Углерод и
кислород предоставляют по 2 электрона
для образования связи реализуя таким
образом двойную связь. В то же время
электронная плотность смещена в сторону
атома кислорода как к более
электроотрицательному атому и на нем
формируется частичный отрицательный
заряд. Соответственно на атоме углерода
образуется частичный положительный
заряд.При взаимодействии двух атомов
водорода между ними образуется одна
общая электронная пара:
![]()
Свойства ковалентной связи.
Насыщаемость. Молекула водорода Н2, образованная двумя атомами, не может присоединить еще атом водорода, так как валентные силы взаимно насыщены. Не присоединяют атомов водорода или другого элемента и некоторые более сложные молекулы, например, молекулы метана, в которых насыщены все четыре валентности углерода и валентности четырех атомов водорода. Очевидно, если бы не было насыщаемости ковалентной связи, то элементы не обладали бы целочисленными значениями валентности.
Направленность. Ковалентным связям присуще определенное пространственное направление относительно друг друга. Две связи могут быть вытянуты в одну линию или могут образовать между собой некоторый угол. Например, в молекуле Н2О две связи, Н — О образуют угол равный 104,50°.
Из квантово-механического расчета следует, что если в атоме имеются два или три 2р-электрона, то их облака направлены под прямым углом друг к другу. Учитывая, что облака s-электронов не имеют направленности, можно сделать вывод о том, что в молекулах воды и аммиака s-p-связи должны быть направлены под прямом углом. Однако эти углы различны и больше 900. Отклонение расчетных данных от опытных объясняют смешиванием и выравниванием электронных облаков, в результате чего возникает новое облако связи, поэтому истинный угол между связями не соответствует расчетному. Такие связи называются гибридными. Своеобразная перестройка формы электронного облака называется гибридизацией.
Электронная
формула возбужденного атома углерода
![]() . В молекуле метана химические связи
между атомом углерода и атомами водорода
образуются за счет трех р-электронов и
одного s-электрона атома углерода и
четырех s-электронов атомов водорода.
Но при образовании связей происходит
их гибридизация, что ведет к образованию
равноценных и прочных связей. Новые
связи не являются s-p- или s-s-связями, а
представляют гибриды тех и других.
Гибридные связи направлены под одинаковыми
углами 109°28', поэтому молекула метана
имеет форму тетраэдра.
. В молекуле метана химические связи
между атомом углерода и атомами водорода
образуются за счет трех р-электронов и
одного s-электрона атома углерода и
четырех s-электронов атомов водорода.
Но при образовании связей происходит
их гибридизация, что ведет к образованию
равноценных и прочных связей. Новые
связи не являются s-p- или s-s-связями, а
представляют гибриды тех и других.
Гибридные связи направлены под одинаковыми
углами 109°28', поэтому молекула метана
имеет форму тетраэдра.

Схематическое изображение облаков σ-связи (горизонтальной линией обозначена ось симметрии).
В σ- и π- связи. Ковалентная связь может возникнуть в результате наложения облаков; либо s и s-, либо s и р-, либо р и р электронов, причем наибольшая плотность облака достигается между ядрами атомов по оси симметрии облака (линии, соединяющей ядра). Такую ковалентную связь называют сигма-связью и обозначают греческой буквой σ.
В молекуле этана семь σ-связей.
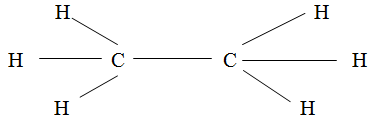
В тех случаях, когда между двумя атомами возникают две или три ковалентные связи, при образовании второй и третьей связи возможно частичное перекрывание облаков двух р- или d-электронов. В этом случае образуются связи отличные от σ-СВЯЗИ. Например, в молекуле этилена С2Н4 только одна связь между атомами углерода имеет максимальную плотность облака по оси симметрии, т. е. является σ-связью. Вторая связь между атомами углерода возникает в результате частичного перекрывания своими боковыми частями облаков р-электронов. Такая связь называется (пи) π-связью.
Ковалентная полярная связь.
При соединении атомов, имеющих различные значения электроотрицательности, возникает ковалентная полярная связь. В этом случае общая электронная пара смещена в сторону ядра того атома, у которого электроотрицательность больше. Например, в молекуле хлористого водорода общая электронная пара смещена к ядру атома хлора, электронное облако неравномерно распределено в поле обоих ядер. В результате электрические центры положительных и отрицательных зарядов обоих атомов не совпадают в одной точке, что ведет к полярности связи.
Полярность
связи характеризуют дипольным моментом
μ, который равен произведению заряда
электрона е на расстояние l между
электрическими центрами положительных
и отрицательных зарядов:
![]() Дипольный
момент выражают в дебаях D. Так как
Дипольный
момент выражают в дебаях D. Так как
![]() , а l
имеет величину порядка расстояния между
ядрами в молекуле 10-8
см, то D=10-18
эл. сm. ед. см . Дипольный момент есть
величина направленная — вектор; его
изображают стрелкой, имеющей направление
от минуса к плюсу.
, а l
имеет величину порядка расстояния между
ядрами в молекуле 10-8
см, то D=10-18
эл. сm. ед. см . Дипольный момент есть
величина направленная — вектор; его
изображают стрелкой, имеющей направление
от минуса к плюсу.
Чем больше различаются электроотрицательности двух атомов, образующих молекулу, тем больше дипольный момент связи, тем больше ее полярность.
