
- •1.Основные химические законы и понятия.
- •2. Строение атомов. Модель атома по Резерфорду, по Бору.
- •3.Волновые свойства электрона.Принцип неопределенности Гейзенберга.
- •4. Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5.Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами
- •6. Периодический закон д.И.Менделеева. Структура периодической системы.
- •8.Химическая связь и валентность
- •9. Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10.Ионная связь. Типы ковалентных молекул.
- •11.Межмолекулярные взаимодействия, их типы, характеристика.
- •12. Донорно-акцепторная связь. Водородная связь.
- •13. Металлическая связь. Структура твердых тел.
- •14.Элементы химической термодинамики. Первое начало термодинамики.
- •15.Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствие из него.
- •16. Элементы второго начала термодинамики. Энтропия.
- •17.Энергия Гиббса. Направленность химических процессов.
- •18. Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19. Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20. Цепные реакции. Гомогенный катализ.
- •21. Скорость гетерогенных реакций. Гетерогенный катализ
- •22.Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твердых тел, жидкостей в жидкостях
- •23.Первый и второй закон Рауля.Осмотическое давление. Закон Ван-Гоффа.
- •24. Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25. Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26. Диссоциация воды. Водородный показатель
- •27. Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28. Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29. Теория гальванического элементов.
- •Избыточные электроны перейдут с электрода
- •30. Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31. Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея
- •32. Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33.Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34. Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35. Топливные элементы.
- •36. Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37. Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38. Методы защиты металлов от коррозии
- •39. Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40. Получение металлов из руд.Способы получения металлов высокой чистоты.
- •2.Термическое разложение йодидов металлов.
- •41. Общие химические свойства металлов.
- •3.Взаимодействие с растворами кислот.
- •4.Взаимодействие с концентрированной серной кислотой.
- •5. Взаимодействие с азотной кислотой
- •6. Взаимодействие со смесями кислот.
- •42.Легкие конструкционные материалы. Алюминей. Свойства, получение, применение в технике, важнейшие соединения.
- •43 Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44. Олово.Железо. Свойства, получение, применение, важнейшие соединения.
- •45.Высокомолекулярные соединения, их виды, способы получения вмс.
- •46. Получение вмв с помощью поликонденсации
- •47. Применение полимеров. Основные полимеры,получаемые полимеризацией.
- •48. Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
14.Элементы химической термодинамики. Первое начало термодинамики.
Элементы химической термодинамики
Химическая термодинамика – наука о зависимости направления и пределов превращений веществ от условий, в которых эти вещества находятся [ 2].
Термин “термодинамика” предложил в 1851 г. англ. Уильям Томсон , когда сформулировал ее второе начало.
В отличие от других разделов физической химии (строение вещества и химическая кинетика), химическую термодинамику можно применять, ничего не зная о молекулярном строении вещества. Такое описание требует значительно меньше исходных данных.
Конкретный объект термодинамического исследования называют термодинамической системой или просто системой , выделенной из окружающего мира реально существующими или воображаемыми поверхностями. Системой может быть газ в сосуде, раствор реагентов в колбе, кристалл вещества или даже мысленно выделенная часть этих объектов.
По уровням взаимодействия с окружающей средой термодинамические системы принято делить на:
открытые – обмениваются с окружающей средой веществом и энергией (например, живые объекты);
закрытые – обмениваются только энергией (например, реакция в закрытой колбе или колбе с обратным холодильником), наиболее частый объект химической термодинамики;
изолированные – не обмениваются ни веществом, ни энергией и сохраняют постоянный объем (приближение – реакция в термостате).
Очевидно, что из трех типов систем в реальности не существуют системы полностью изолированные, однако именно в них действительны приведенные ниже законы термодинамики.
Для того, чтобы систему можно было описать термодинамически, она должна состоять из большого числа частиц – соответствовать законам статистики.
Если в системе есть реальные поверхности раздела , отделяющие друг от друга части системы, различающиеся по свойствам, то система называется гетерогенной (насыщенный раствор с осадком), если таких поверхностей нет, система называется гомогенной (истинный раствор). Гетерогенные системы содержат не менее двух фаз.
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем физическим и химическим свойствам (не зависящим от количества вещества) и отграниченных от других частей системы поверхностью раздела. Внутри одной фазы свойства могут изменяться непрерывно, но на поверхности раздела между фазами свойства меняются скачком. Пример двухфазной системы – поверхность реки в ледоход.
Компонентами называют вещества, минимально необходимые для составления данной системы (минимум один). Число компонентов в системе равно числу веществ в ней присутствующих, минус число связывающих эти вещества независимых уравнений.
Классическая термодинамика - это область физики, которая занимается изучением общих свойств макроскопических систем в равновесии, а также общих закономерностей при установлении равновесия . В этом кратком определении дважды повторяется слово "равновесие", но ничего не говорится о развитии процессов во времени.
Равновесным состоянием называется такое термодинамическое состояние системы, которое не изменяется во времени , причем эта неизменяемость не обусловлена протеканием какого-либо внешнего процесса.
При устойчивом равновесии любые состояния, смежные с ним, являются менее устойчивыми, и переход к ним из состояния устойчивого равновесия всегда связан с необходимость затраты работы извне.
К устойчивому равновесию принципиально можно подойти с двух противоположных направлений. Общие условия осуществления и свойства равновесных процессов :
-Бесконечно малая разность действующих и противодействующих сил.
-Совершение в прямом процессе наибольшей максимальной работы.
-Бесконечно медленное течение процесса , связанное с бесконечно малой разностью действующих сил и бесконечно большим числом промежуточных состояний.
-Абсолютные значения работ прямого и обратного процессов одинаковы.
- Изменение внешней силы на бесконечно малую величину меняет направление процесса на обратный.
-Пути прямого и обратного процессов совпадают.
Внутренняя
энергия U термодинамической системы
может быть изменена двумя способами:
при совершении механической работы и
при помощи теплообмена. Если оба способа
задействованы одновременно, то можно
записать
![]() или
или
![]() --Эта
формула выражает первое начало
термодинамики.
--Эта
формула выражает первое начало
термодинамики.
Количество теплоты, сообщенное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил.
Если вместо работы A системы над внешними телами ввести работу внешних сил A ' (А = –A '), то первое начало термодинамики можно переписать так:
![]()
Изменение внутренней энергии термодинамической системы равно сумме работы, произведенной над системой внешними силами, и количеству теплоты, переданному системе в процессе теплообмена.
Первое начало термодинамики является обобщением закона сохранения энергии для механических и тепловых процессов.
Применение первого начала к различным тепловым процессам
Изохорный
процессОбъем
не изменяется: V = const. Следовательно, ΔV
= 0 и А = –A ' = 0, т.е. никакой механической
работа не совершается. Первое начало
термодинамики будет иметь вид:
![]()
При изохорном процессе вся энергия, сообщаемая газу путем теплообмена, расходуется целиком на увеличение его внутренней энергии.
Изотермический
процесс:Температура
газа не изменяется: Τ = const. Следовательно,
ΔT = 0 и ΔU = 0. Первое начало термодинамики
будет имеет вид:
![]()
При изотермическом процессе вся энергия, сообщаемая газу путем теплообмена, идет на совершение газом работы.
Изобарный процесс:Давление не изменяется: p = const. При расширении газ совершает работу Α = p⋅ΔV и нагревается, т.е. изменяется его внутренняя энергия.
Первое
начало термодинамики будет имеет вид:
![]()
При изобарном процессе количество теплоты, сообщенное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение работы системой против внешних сил.
Адиабатный процесс— это процесс, происходящий без теплообмена системы с окружающей средой, т.е. Q = 0.
Такие процессы происходят при хорошей теплоизоляции системы либо при быстрых процессах, когда теплообмен практически не успевает произойти. Первое начало термодинамики будет имеет вид:
или
![]()
Если А > 0 (ΔV > 0 газ расширяется), то ΔU < 0 (газ охлаждается), т.е.
при адиабатном расширении газ совершает работу и сам охлаждается.
Охлаждение воздуха при адиабатном расширении вызывает, например, образование облаков.
Если А < 0 (ΔV < 0 газ сжимается), то ΔU > 0 (газ нагревается), т.е.
при адиабатном сжатии над газом совершается работа и газ нагревается.
Это используется, например, в дизельных двигателях, где при резком сжатии воздуха температура повышается настолько, что воспламеняются пары топлива в двигателе.
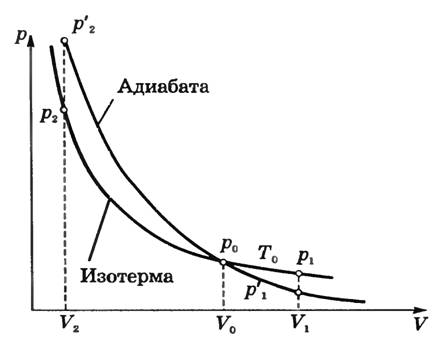
Адиабатное изменение состояния газа можно выразить графически. График этого процесса называют адиабатой. При одних и тех же начальных условиях (p0, V0) при адиабатном расширении давление газа уменьшается быстрее, чем при изотермическом (рис. 1), так как падение давления вызвано не только увеличением объема (как при изотермическом расширении), но и понижением температуры. Поэтому адиабата идет ниже изотермы и газ при адиабатном расширении совершает меньшую работу, чем при изотермическом расширении.
Из первого начала термодинамики вытекает невозможность создания вечного двигателя первого рода, т.е. такого двигателя, который совершал бы работу без затраты энергии извне.
Действительно, если к системе не подводится энергия (Q = 0), то A = –ΔU и работа может быть совершена только за счет убыли внутренней энергии системы. После того как запас энергии окажется исчерпанным, двигатель перестанет работать.
