
- •1.Основные химические законы и понятия.
- •2. Строение атомов. Модель атома по Резерфорду, по Бору.
- •3.Волновые свойства электрона.Принцип неопределенности Гейзенберга.
- •4. Квантовые числа. Главное, орбитальное, магнитное, спиновое числа.
- •5.Принцип Паули. Принцип наименьшей энергии. Правило Гунда. Порядок заполнения атомных орбиталей электронами
- •6. Периодический закон д.И.Менделеева. Структура периодической системы.
- •8.Химическая связь и валентность
- •9. Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации.
- •10.Ионная связь. Типы ковалентных молекул.
- •11.Межмолекулярные взаимодействия, их типы, характеристика.
- •12. Донорно-акцепторная связь. Водородная связь.
- •13. Металлическая связь. Структура твердых тел.
- •14.Элементы химической термодинамики. Первое начало термодинамики.
- •15.Внутренняя энергия и энтальпия. Термохимические уравнения. Теплоты образования и разложения веществ. Закон Гесса и следствие из него.
- •16. Элементы второго начала термодинамики. Энтропия.
- •17.Энергия Гиббса. Направленность химических процессов.
- •18. Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции.
- •19. Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье.
- •20. Цепные реакции. Гомогенный катализ.
- •21. Скорость гетерогенных реакций. Гетерогенный катализ
- •22.Общая характеристика растворов. Способы выражения концентрации растворов. Растворимость газов, твердых тел, жидкостей в жидкостях
- •23.Первый и второй закон Рауля.Осмотическое давление. Закон Ван-Гоффа.
- •24. Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации.
- •25. Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов.
- •26. Диссоциация воды. Водородный показатель
- •27. Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей.
- •28. Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов.
- •29. Теория гальванического элементов.
- •Избыточные электроны перейдут с электрода
- •30. Уравнение Нернста. Концентрационные гальванические элементы. Поляризация и деполяризация. Элемент Лекланше.
- •31. Электролиз. Процессы, протекающие на аноде и катоде. Закон Фарадея
- •32. Электролиз растворов с нерастворимыми электродами. Электролиз расплавов.
- •33.Электролиз растворов с растворимым анодом, его применение: гальваностегия, гальванопластика, электролитическое рафинирование.
- •34. Аккумуляторы. Устройство, принцип действия свинцового аккумулятора.
- •35. Топливные элементы.
- •36. Коррозия металлов. Виды коррозионных разрушений. Электрохимическая коррозия.
- •37. Химическая коррозия. Электрокоррозия. Скорость коррозии.
- •38. Методы защиты металлов от коррозии
- •39. Классификация металлов. Кристаллическая структура, физические свойства металлов.
- •40. Получение металлов из руд.Способы получения металлов высокой чистоты.
- •2.Термическое разложение йодидов металлов.
- •41. Общие химические свойства металлов.
- •3.Взаимодействие с растворами кислот.
- •4.Взаимодействие с концентрированной серной кислотой.
- •5. Взаимодействие с азотной кислотой
- •6. Взаимодействие со смесями кислот.
- •42.Легкие конструкционные материалы. Алюминей. Свойства, получение, применение в технике, важнейшие соединения.
- •43 Медь. Свойства, получение, применение в технике, важнейшие соединения.
- •44. Олово.Железо. Свойства, получение, применение, важнейшие соединения.
- •45.Высокомолекулярные соединения, их виды, способы получения вмс.
- •46. Получение вмв с помощью поликонденсации
- •47. Применение полимеров. Основные полимеры,получаемые полимеризацией.
- •48. Основные полимеры, получаемые поликонденсацией. Фенолоформальдегидные смолы, полиамиды, полиэфирные смолы.
1.Основные химические законы и понятия.
Закон сохранения массы и энергии (Ломоносов М.В., 1748 г.):
а) "масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции".
б) "в изолированной системе сумма масс и энергий постоянна".
Закон постоянства состава (Пруст Ж., 1801 г.):
"каждое химически чистое соединение всегда имеет один и тот же количественный состав независимо от способа его получения".
Закон эквивалентов (Рихтер И., 1793 г.):
а) "все вещества реагируют в эквивалентных отношениях"
б) "моль эквивалентов одного вещества реагирует с одним моль эквивалентов другого вещества".
Эквивалент - реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному протону Н+ в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях.
Эквивалентные массы для химических соединений определяются по следующим формулам:

Закон Авогадро (1811 г.):
В равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул". Т.е. 1 моль любого газа занимает один и тот же объем (молярный объем): vm = 22,4 л/моль.
Относительная атомная масса элемента Ar - отношение массы атома элемента к 1/12 части массы атома 12С.
Относительная молекулярная масса вещества Mr - отношение массы молекулы вещества к 1/12 части массы атома 12С.
Mr = ∑Ar
Mr = М, где М - молярная масса вещества.
Моль - количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г. изотопа 12С.
Число структурных единиц в 1 моль вещества Nа = 6,02 · 1023 моль-1 - число Авогадро.
![]()
Из закона Авогадро следует, что
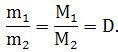
D - относительная плотность одного газа по другому: D = ρ1/ρ2.
Закон кратных отношений (Дальтон, 1803 г.):
"если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа".
Основные газовые законы.
Закон Бойля-Мариотта (1676 г.):
"при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа р2/р1 = v1/v2 или pV = const".
Закон Гей-Люссака (1802 г.):
"при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре v1/T1 = v2/T2 или v/T = const".
Зависимость между v, p и Т можно выразить общим уравнением, объединяющим эти два закона:
![]()
где р0, v0, Т0 - давление, объем и температура при н.у. Уравнение используется при решении задач для приведения газа к н.у.
Молярную массу газа вычисляют по уравнению Менделеева-Клапейрона: pv=nRT.
pv=![]() RT.
RT.
Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Атом - наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом - это электронейтральная частица, состоящая из положительно заряженного ядра атома и отрицательно заряженных электронов.
Вещество - это определенная совокупность атомных и молекулярных частиц, их ассоциатов и агрегатов, находящихся в любом из трех агрегатных состояний.
Простые вещества - это вещества, состоящие из атомов одного и того же химического элемента.
Сложные вещества состоят не из простых веществ, а из элементов
Важнейшими характеристиками химического вещества являются его атомная масса, а для молекул - молекулярная масса.
Атомная масса - это число, которое показывает, во сколько раз мacca данного атома больше 1/12 массы самого легкого изотопа углерода.
Молекулярная масса - это число, показывающее, во сколько раз молекула вещества тяжелее 1/12 атома изотопа . Молекулярная масса химического соединения равна сумме атомных масс всех атомов, составляющих молекулу соединения.
