
1.Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
Молекула - наименьшая частица вещества, сохраняющая все его химические свойства. Атом - мельчайшая частица химического элемента.
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основными доказательствами этих положений считались:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
Основное уравнение МКТ:
![]() ,
где k
является постоянной
Больцмана
(отношение универсальной
газовой постоянной
R
к числу
Авогадро
NA),
i
— число степеней свободы молекул (i
= 3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T
- абсолютная температура.
,
где k
является постоянной
Больцмана
(отношение универсальной
газовой постоянной
R
к числу
Авогадро
NA),
i
— число степеней свободы молекул (i
= 3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T
- абсолютная температура.
Одним из наиболее важных параметров, характеризующих равновесные свойства макроскопической системы, является температура. Введем этот параметр, для чего рассмотрим два тела, которые могут взаимодействовать и обмениваться энергией. Этот тип взаимодействия, который называется тепловым, приводит к тому, что в результате столкновений молекул в области контакта двух тел происходит передача энергии от быстрых молекул к медленным. Это означает, что энергия движения атомов в одном теле уменьшается, в другом – увеличивается. Тело, которое теряет энергию, называют более нагретым, а тело, к которому энергия переходит – менее нагретым. Такой переход энергии продолжается до тех пор, пока не установится состояние теплового равновесия. В состоянии теплового равновесия степени нагретости тел одинаковы. Для характеристики степени нагретости тела вводят параметр, называемый температурой.
Из опыта известно, что при изменении температуры изменяются размеры тел, электрическое сопротивление и другие свойства. Таким образом, температуру можно определить по изменению какого-либо удобного для измерения физического свойства данного вещества.
Эмпирические газовые законы:
Бойля — Мариотта закон, один из основных газовых законов, согласно которому при постоянной температуре объём V данной массы идеального газа обратно пропорционален его давлению р, т. е. pV = C = const (рис. 1). Постоянная С пропорциональна массе газа (числу молей) и его абсолютной температуре.
Закон Гей-Люссака - закон идеальных газов, согласно которому объем данного количества газа при постоянном давлении прямо пропорционален абсолютной температуре. V/t=const
Закон Шарля - закон идеальных газов, согласно которому давление данной массы идеального газа при постоянном объеме прямо пропорционально абсолютной температуре. p/t=const
2.Кинетическая теория идеальных газов
В
1 см3
газа при нормальных условиях содержится
![]() молекул.
Теоретическое изучение молекулярных
систем, основанное на законах механики,
требует учета всех сил, действующих на
каждую молекулу со стороны всех остальных
молекул. Это значит, что нам нужно было
бы написать
молекул.
Теоретическое изучение молекулярных
систем, основанное на законах механики,
требует учета всех сил, действующих на
каждую молекулу со стороны всех остальных
молекул. Это значит, что нам нужно было
бы написать
![]() дифференциальных
уравнений (по степеням свободы) и решить
эту систему, что невозможно технически.
Однако именно огромное число частиц
позволяет не делать этого, а рассматривать
средние значения характеристик движения:
скорости, энергии и т. д., т. е. использовать
статистический
подход.
дифференциальных
уравнений (по степеням свободы) и решить
эту систему, что невозможно технически.
Однако именно огромное число частиц
позволяет не делать этого, а рассматривать
средние значения характеристик движения:
скорости, энергии и т. д., т. е. использовать
статистический
подход.
В газе силы притяжения молекул малы, т. к. велики расстояния между молекулами. Пренебрегая силами притяжения и размерами молекул, мы существенно упрощаем задачу.
Идеальный газ-теоретическая модель газа, в которой пренебрегается взаимодействием частиц газа (средняя кинетическая энергия частиц много больше энергии их взаимодействия).
Молекулы, приближаясь друг к другу либо к стенкам сосуда (т. е. к молекулам, их образующим), изменяют направление своего движения под воздействием сил отталкивания электрической природы. Изменение направления движения молекул называется столкновениями.
Уравнение Клапейрона — Менделеева
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
Как уже указывалось, состояние некоторой массы газа определяется
тремя термодинамическими параметрами: давлением р, объемом V и темпе-
ратурой Т. Между этими параметрами существует определенная связь, назы-
ваемая уравнением состояния, которое в общем виде
дается выражением
f(p, V, T)=0,
где каждая из переменных является функцией двух
других.
Уравнение
состояния идеалного газа: ![]() =const
=const
Закон Авогадро (итальянский физик и химик): моли любых газов при
одинаковых температуре и давлении занимают одинаковые объемы. При
нормальных
условиях этот объем равен 22,41
10-3 м3/моль.
Отсюда следует, что в случае, когда
количество газа равно одному молю,
величина константы будет одинакова для
всех газов. Обозначим соответствующую
молю величину константы буквой R, напишем
уравнение следующим образом:
![]()
где
![]() —
давление,
—
давление,
![]() —
молярный
объём,
—
молярный
объём,
![]() —
универсальная
газовая постоянная
—
универсальная
газовая постоянная
![]() —
абсолютная
температура,К.
—
абсолютная
температура,К.
Так
как
![]() ,
где
,
где
![]() —
количество
вещества,
а
—
количество
вещества,
а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса,
уравнение состояния можно записать:
—
молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Часто пользуются несколько иной формой уравнения состояния иде-
ального газа, вводя постоянную Больцмана:
k=R/NA=1,38·10-23 Дж/К.
Исходя из этого уравнение состояния (5.10) запишем в виде
р=RT/Vm=kNАT/Vm=nkT,
где NA/Vm — концентрация молекул (число молекул в единице объема). Та-
ким образом, из уравнения
p=nkT (11)
следует, что давление идеального газа при данной температуре прямо про-
порционально концентрации его молекул (или плотности газа).
Закон Дальтона (английский химик и физик): давление смеси идеаль-
ных газов равно сумме парциальных давлений p1, р2,…, pn входящих в нее га-
зов:
p=p1+p2+…+pn.
Парциальное давление — давление, которое производил бы газ, входящий в
состав газовой смеси, если бы он один занимал объем, равный объему смеси
при той же температуре.
3.Рассмотрим,
например, газ (воздух), находящийся под
действием силы тяжести. Если бы
отсутствовало тепловое движение молекул,
то все они под действием силы тяжести
«упали» бы на Землю, и весь воздух
собрался бы тончайшим слоем у поверхности
Земли. Если бы отсутствовала сила
тяжести, но существовали бы молекулярные
движения, молекулы разлетелись бы по
всему мировому пространству. Атмосфера,
воздушная оболочка Земли, обязана своим
существованием в ее теперешнем виде
наличию одновременно и теплового
движения молекул, и силы притяжения к
Земле. При этом в атмосфере устанавливается
вполне определенное распределение
молекул по высоте. Соответственно этому
распределению молекул устанавливается
и определенный закон изменения давления
газа с высотой, который нетрудно
найти.
Рассмотрим вертикальный столб
воздуха.
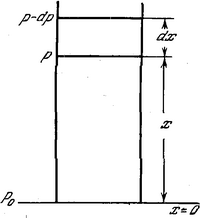 Пусть
у поверхности Земли, где х = 0, давление
равно р0, а на высоте x равно р. При
изменении высоты на dx давление изменяется
на dp. Давление воздуха на некоторой
высоте равно, как известно, весу
вертикального столба воздуха, находящегося
на этой высоте над площадью, равной
единице. Поэтому dp равно разности весов
столбов воздуха над площадью, равной
единице, на высотах х и х + dx, т. е. равно
весу столба воздуха высотой dx с площадью
основания в одну единицу:
Пусть
у поверхности Земли, где х = 0, давление
равно р0, а на высоте x равно р. При
изменении высоты на dx давление изменяется
на dp. Давление воздуха на некоторой
высоте равно, как известно, весу
вертикального столба воздуха, находящегося
на этой высоте над площадью, равной
единице. Поэтому dp равно разности весов
столбов воздуха над площадью, равной
единице, на высотах х и х + dx, т. е. равно
весу столба воздуха высотой dx с площадью
основания в одну единицу:
![]() где
ро - плотность воздуха (массы единицы
объёма) и g — ускорение силы тяжести.
Плотность р газа равна, очевидно,
произведению массы т молекулы на их
число п в единице объема:
где
ро - плотность воздуха (массы единицы
объёма) и g — ускорение силы тяжести.
Плотность р газа равна, очевидно,
произведению массы т молекулы на их
число п в единице объема:
![]() Из
кинетической теории известно, что
Из
кинетической теории известно, что
![]() Следовательно,
Следовательно,
![]()
![]() Это
уравнение можно (для разделения
переменных) переписать в виде:
Это
уравнение можно (для разделения
переменных) переписать в виде:
![]() Если
считать, что температура на всех высотах
одна и та же (что, вообще говоря, неверно),
то, интегрируя это уравнение, получим:
Если
считать, что температура на всех высотах
одна и та же (что, вообще говоря, неверно),
то, интегрируя это уравнение, получим:
![]() где
С — постоянная интегрирования.
Отсюда
где
С — постоянная интегрирования.
Отсюда
![]() Постоянная
С определяется из условия, что при х=0
давление р=р0. Подставив в уравнение эти
значения х и р, получим: С=p0
Следовательно,
интересующая нас зависимость давления
воздуха от высоты над поверхностью
Земли имеет вид:
Постоянная
С определяется из условия, что при х=0
давление р=р0. Подставив в уравнение эти
значения х и р, получим: С=p0
Следовательно,
интересующая нас зависимость давления
воздуха от высоты над поверхностью
Земли имеет вид:
![]() или
или
![]() Уравнение
(8.2), устанавливающее закон убывания
давления с высотой, называется
барометрической формулой. Барометрическую
формулу можно преобразовать, если
воспользоваться выражением
Уравнение
(8.2), устанавливающее закон убывания
давления с высотой, называется
барометрической формулой. Барометрическую
формулу можно преобразовать, если
воспользоваться выражением
![]()
![]() где
n — концентрация молекул на высоте x, n0
— то же на высоте h = 0.
где
n — концентрация молекул на высоте x, n0
— то же на высоте h = 0.
![]() где
m0gx = E — потенциальная энергия молекулы
в поле тяготения, т. е.
где
m0gx = E — потенциальная энергия молекулы
в поле тяготения, т. е.
![]() Выражение
называется распределением Больцмана
во внешнем потенциальном поле. Из него
следует, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если
частицы имеют одинаковую массу и
находятся в состоянии хаотического
теплового движения, то распределение
Больцмана справедливо в любом внешнем
потенциальном поле, а не только в поле
сил тяжести.
Выражение
называется распределением Больцмана
во внешнем потенциальном поле. Из него
следует, что при постоянной температуре
плотность газа больше там, где меньше
потенциальная энергия его молекул.
Если
частицы имеют одинаковую массу и
находятся в состоянии хаотического
теплового движения, то распределение
Больцмана справедливо в любом внешнем
потенциальном поле, а не только в поле
сил тяжести.
4.Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе. О нём обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул. Также оно может быть выражено как дискретное распределение по множеству дискретных уровней энергии, или как непрерывное распределение по некоторому континууму энергии.
Распределение по вектору скорости
Учитывая,
что плотность распределения по скоростям
![]() пропорциональна
плотности распределения по импульсам:
пропорциональна
плотности распределения по импульсам:
![]()
и
используя
![]() мы
получим:
мы
получим:
![]() ,
,
что
является распределением Максвелла по
скоростям. Вероятность обнаружения
частицы в бесконечно малом элементе
![]() около
скорости
около
скорости
![]() равна
равна
![]()
Получим
теперь формулу распределения так, как
это делал сам Джеймс
Клерк Максвелл[источник не указан 523 дня].
Рассмотрим
пространство скоростных точек (каждую
молекулу представляем как точку в
системе координат
![]() )
в стационарном
состоянии
газа. Выберем бесконечно
малый элемент объема
)
в стационарном
состоянии
газа. Выберем бесконечно
малый элемент объема
![]() .
Так как газ стационарный, количество
скоростных точек в
остается
неизменным с течением времени. Пространство
скоростей изотропно,
поэтому функции плотности
вероятности
для всех направлений одинаковы.
.
Так как газ стационарный, количество
скоростных точек в
остается
неизменным с течением времени. Пространство
скоростей изотропно,
поэтому функции плотности
вероятности
для всех направлений одинаковы.
![]()
Максвелл
предположил, что распределения скоростей
по направлениям статистически независимы,
то есть компонента
![]() скорости
молекулы не зависит от
скорости
молекулы не зависит от
![]() и
и
![]() компонент.
компонент.
![]() -
фактически вероятность нахождения
скоростной точки в объеме
.
-
фактически вероятность нахождения
скоростной точки в объеме
.
![]()
![]()
![]()
![]()
Правая
часть не зависит от
![]() и
и
![]() ,
значит и левая от
и
не
зависит. Но
и
равноправны,
значит левая часть не зависит также и
от
.
Значит, это константа.
,
значит и левая от
и
не
зависит. Но
и
равноправны,
значит левая часть не зависит также и
от
.
Значит, это константа.
![]()
![]()
![]()
![]()
![]()
Теперь нужно сделать принципиальный шаг - ввести температуру. Кинетическое определение температуры (как меры средней кинетической энергии движения молекул):
![]()
где
![]() Дж/К
- постоянная
Больцмана.
Дж/К
- постоянная
Больцмана.
![]()
Все направления равноправны:
![]()
Чтобы
найти среднее значение
![]() ,
проинтегрируем её вместе с функцией
плотности вероятности от минус до плюс
бесконечности:
,
проинтегрируем её вместе с функцией
плотности вероятности от минус до плюс
бесконечности:
![]()
Отсюда
найдём
![]() :
:
![]()
Функция распределения плотности вероятности для (для и аналогично):
![]()
Рассмотрим
теперь распределение по величине
скорости. Вернемся в пространство
скоростных точек. Все точки с модулем
скорости
![]() лежат
в шаровом слое радиуса
лежат
в шаровом слое радиуса
![]() и
толщины
и
толщины
![]() ,
и
-
объем этого шарового слоя.
,
и
-
объем этого шарового слоя.
![]()
![]()
Так,
мы получили
![]() -
функцию плотности вероятности, которая
и называется распределением Максвелла.
-
функцию плотности вероятности, которая
и называется распределением Максвелла.
