
- •2. Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •3. Многоэлектронные атомы. Последовательность энергетических уровней и подуровней. Правила Клечковского. Правило Гунда.
- •4. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на энергетических уровнях и подуровнях.
- •5. Периодический закон д.И. Менделеева. Структура Периодической системы. Связь Периодической системы со строением атома.
- •6. Атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность; их связь с Периодической системой д.И. Менделеева.
- •7. Виды химической связи. Ковалентная связь. Механизмы её образования.
- •8. Характеристика ковалентной связи: длина, энергия, полярность. Свойства ковалентной связи: направленность, насыщаемость; валентные углы.
- •9. Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекул.
- •10. Образование кратных ковалентных связей. Их особенности. Делокализованные п-связи.
- •11. Полярная и неполярная ковалентные связи. Эффективные заряды атомов в молекулах. Ионная связь как крайний случай поляризации ковалентной связи.
- •12.Виды химической связи. Ионная связь, её свойства, отличие от ковалентной связи. Металлическая связь.
- •13.Межмолекулярное взаимодействие. Природа межмолекулярных сил. Виды межмолекулярного взаимодействия. Водородная связь.
- •14.Конденсированное состояние вещества. Кристаллическое состояние; ионная, атомная, молекулярная, металлическая кристаллические решётки.
1. Строение атома. Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.Строение атома:Атом - химически неделимая единица вещества и представляет собой сложную электронейтральную микросистему находящихся в движении элементарных частиц – протона, нейтрона и электрона.В 1911 г. Э.Резерфорд предложил модель атома, согласно которой атом состоит из положительно заряженного ядра, в котором находится почти вся масса атома, и располагающихся вокруг ядра электронов. Ядро состоит из протонов и нейтронов. Число электронов равно числу протонов, и поэтому атом электронейтрален. Химический элемент - определенный вид атомов с одинаковым зарядом ядра. Атомы – наименьшие частицы химических элементов, являющихся носителями их химических свойств. Заряд ядра (сумма протонов) численно равен порядковому номеру элемента в периодической системе.
Пример: Атом водорода — атом, ядром которого является протон,
а электронная оболочка состоит из единственного электрона.
Соответствует
химическому элементу водород:Ква́нтовая
меха́ника
— раздел теоретической физики, описывающий
основные свойства и поведение атомов
и других систем с электронно-ядерным
строением.В
основе квантово-механической теории
строения атомов лежит представление
о двойственности природы электронов
и других микрочастиц, то есть их
корпускулярно-волновые свойства.
Двойственность свойств электрона
проявляется в том, что он, с одной стороны,
обладает свойствами частицы (имеет
определенную массу покоя), а с другой -
его движение напоминает волну и может
быть описано определенной амплитудой,
длиной волны, частотой колебаний и
др.Корпускулярные свойства е выражаются
в его способности проявлять свое действие
как целое, волновые свойства e выражаются
в особенностях движения e, в дифракции
и интерференции электронов.Корпускулярные
свойства в уравнении планка E=hv,
согласно которым электрон неделим и
существует в виде дискретного образования.
Волновые свойства λv=c.Соотношение,
связывающее корпускулярную характеристику
электрона с его волновой характеристикой
E=hc/ λ, в
соответствии с уравнением Эйнштейна E
= mc2
= hν = hc / λ С
движущимся электроном ассоциируется
волна, длина которой определяется
уравнением
Де-Бройля:
![]() где λ
- длина волны, (м); m
- масса электрона; V-скорость
движения частицы (≈108
м/с), h
- постоянная Планка. Вторым фундаментальным
принципом квантовой механики является
принцип
неопределенности Гейзенберга:
невозможно описать с высокой степенью
точности местонахождение электрона
(координаты), и его энергию (импульс) в
один и тот же момент времени. В квантовой
механике электрон представляют как
«облако отрицательного заряда», имеющее
определенные размеры и форму. Уравнение
Шрёдингера
(1926 г.) описывает волновые и корпускулярные
свойства электрона в атоме водорода.
Решениями уравнения Шредингера являются
энергии электрона и волновая функция
ψ(пси). Решения его возможны только при
определенных дискретных
значениях энергии электрона.
Волновая функция ψ зависит от координат
(x,
y,
z),
и энергии E электрона и не имеет
определенного физического толкования.
Квадрат волновой функции ψ2
определяет плотность вероятности
нахождения электрона в точке с координатами
(x,
y,
z).
ψ2·ΔV
–вероятность нахождения электрона в
данном объеме атома ΔV.
Чем больше ψ2·ΔV,
тем плотнее электронное облако в данном
объеме атома. Каждой волновой функции
соответствует набор из трех
где λ
- длина волны, (м); m
- масса электрона; V-скорость
движения частицы (≈108
м/с), h
- постоянная Планка. Вторым фундаментальным
принципом квантовой механики является
принцип
неопределенности Гейзенберга:
невозможно описать с высокой степенью
точности местонахождение электрона
(координаты), и его энергию (импульс) в
один и тот же момент времени. В квантовой
механике электрон представляют как
«облако отрицательного заряда», имеющее
определенные размеры и форму. Уравнение
Шрёдингера
(1926 г.) описывает волновые и корпускулярные
свойства электрона в атоме водорода.
Решениями уравнения Шредингера являются
энергии электрона и волновая функция
ψ(пси). Решения его возможны только при
определенных дискретных
значениях энергии электрона.
Волновая функция ψ зависит от координат
(x,
y,
z),
и энергии E электрона и не имеет
определенного физического толкования.
Квадрат волновой функции ψ2
определяет плотность вероятности
нахождения электрона в точке с координатами
(x,
y,
z).
ψ2·ΔV
–вероятность нахождения электрона в
данном объеме атома ΔV.
Чем больше ψ2·ΔV,
тем плотнее электронное облако в данном
объеме атома. Каждой волновой функции
соответствует набор из трех
2. Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
Энергия
АО – энергия электрона, находящегося
на этой орбитали (то есть в этом состоянии).
Квантовая ячейка – символическое
изображение орбитали на энергетической
диаграмме. Электронный уровень –
совокупность орбиталей с одинаковыми
значениями главного квантового числа.
Электронный подуровень – совокупность
орбиталей одного уровня с одинаковыми
значениями орбитального квантового
числа.Квадрат
волновой функции ψ2
определяет плотность вероятности
нахождения электрона в точке с координатами
(x,
y,
z).
ψ2·ΔV
–вероятность нахождения электрона в
данном объеме атома ΔV.
Чем больше ψ2·ΔV,
тем плотнее электронное облако в данном
объеме атома. Каждой волновой функции
соответствует набор из трех целочисленных
параметров - квантовых чисел – n,
l,
ml.
Область пространства, в которой
вероятность нахождения электрона
составляет не менее 90%, называют атомной
орбиталью.
Атомные орбитали различаются по энергии,
размерам, форме, ориентации в пространстве
и могут быть охарактеризованы квантовыми
числами.Квантовые
числа – это
энергетические параметры, определяющие
состояние е-
и тип АО (атомн орбитали), на которой он
находится.Главное
квантовое число
– n
- принимает только целые положительные
значения n
= 1, 2, 3…∞. С
увеличением n
энергия и размер электронного облака
(атомной орбитали) возрастает. Совокупность
атомных орбиталей с одинаковым значением
n
называют уровнем, или электронным слоем.
Максимально возможные числа орбиталей
и электронов на уровне соответственно
равны n2
и 2n2.Орбитальное
квантовое число
l
определяет значения орбитального
момента количества движения электрона
и принимает значения от 0 до (n-1),
например, при n
= 3: l
= 0, 1, 2.
Характеризует форму атомных орбиталей
(электронных облаков), для которых в
зависимости от l
приняты соответствующие обозначения:
l
0, 1, 2, 3, 4, 5… обозначение
s,
p,
d,
f,
g,
h…s
- Орбиталь (s
– электронное облако) имеет шарообразную
форму. При l=1
зона вероятностного распределения
электронов представляет собой
гантелеобразное облако с центром в ядре
(р-орбиталь). У d
- орбитали (l
= 2) и f
- орбитали (l=
3) форма электронных облаков еще более
сложная. Совокупность атомных орбиталей
с одинаковым значением n
и l
называют подуровнем или электронной
подоболочкой. Число возможных орбиталей
и электронов в пределах подуровня
соответственно равны (2l+1)
и 2(2l+1).Каждому
значению
![]() соответствует определённая форма
орбитали (например, при
соответствует определённая форма
орбитали (например, при
![]() – это сфера, центр которой совпадает с
ядром).
– это сфера, центр которой совпадает с
ядром).
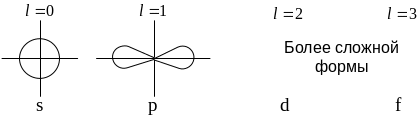
Магнитное квантовое число ml может принимать положительные и отрицательные целочисленные значения от минус l до плюс l через нуль. В зависимости от значений ml определяются возможные ориентации орбиталей одной формы и их число, которое равно количеству значений ml. Так, для s - орбиталей (l = 0, ml = 0), возможна одна ориентация, поскольку шар симметричен относительно трех осей ординат. Для р - орбиталей (l=1, ml = -1, 0, +1), что соответствует трем ориентациям р - орбиталей относительно трех осей. Для d - орбиталей (l=2, ml = -2, -1, 0, +1, +2) число возможных ориентаций – пять, для f – орбиталей - семь.Спиновое (ms) квантовое число характеризует сложное движение электрона вокруг собственной оси и принимает значения +1/2 или –1/2.
Четыре квантовых числа n, l, ml и ms - полностю определяют состояние электрона в атоме
