
- •Пособие по химии
- •Поступающих в Военно-медицинскую академию
- •Предисловие
- •Раздел I. Общая химия
- •Глава 1. Основные понятия и законы химии
- •Обучающие задачи Моль. Молярная масса
- •Расчеты по химическим формулам. Массовая доля. Вывод формул соединений
- •Законы идеальных газов
- •Расчеты по химическим уравнениям
- •1) Из 80 г оксида меди образуется 64 г меди,
- •2) C 80 г оксида меди реагирует 1 моль водорода,
- •56 Г Fe (1 моль) выделяют 2 г h2
- •24 Г Mg (1 моль) выделяют 2 г h2
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 2. Строение атома. Периодический закон и периодическая система д.И. Менделеева
- •2.1. Строение атома
- •2) В случае равных сумм сначала заполняются орбитали с меньшим значением n.
- •2.2. Периодический закон и периодическая система элементов
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Глава 3. Химическая связь
- •3.1. Ковалентная связь
- •Обучающие задачи
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4.Водородная связь
- •Задания для самостоятельной работы
- •Глава 4. Валентность и степень окисления
- •4.1. Понятие валентности
- •4.2. Степень окисления
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 5. Классификация химических реакций
- •Задания для самостоятельной работы
- •Глава 6. Окислительно-восстановительные реакции
- •6.1. Основные понятия и определения
- •6.2. Методы составления уравнений окислительно-восстановительных реакций
- •6.3. Реакции электролиза
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 7. Растворы. Теория электролитической диссоциации
- •7.1. Основные понятия
- •7.2. Ионные уравнения реакций
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 8. Химическая кинетика
- •8.1. Понятие скорости химической реакции
- •8.2. Влияние концентрации на скорость реакции
- •8.3. Влияние температуры на скорость реакции
- •8.4. Энергия активации
- •8.5. Влияние катализатора на скорость реакции
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 9. Химическое равновесие
- •9.1. Понятие о химическом равновесии
- •9.2. Способы смещения химического равновесия
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 10. Классификация неорганических соединений
- •10.1. Оксиды
- •10.2. Гидроксиды
- •10.2.1. Основания
- •I. Получение щелочей.
- •10.2.2. Кислоты
- •10.2.3. Амфотерные гидроксиды
- •10.3. Соли
- •Обучающие задачи
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел II. Неорганическая химия
- •Часть I. Химия металлов
- •Глава 11. Общая характеристика металлов
- •I. Взаимодействие с неметаллами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 12. Химия щелочных металлов
- •I. Взаимодействие с неметаллами.
- •II. Взаимодействие со сложными веществами.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 13. Химия щелочноземельных металлов
- •13.1. Общая характеристика элементов главной подгруппы II группы
- •13.2. Кальций
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения кальция
- •Ca(oh)2 - гидроксид кальция(II), гашеная известь
- •Гидрид кальция CaH2 и карбид кальция СаС2
- •13.3. Жесткость воды и способы ее устранения
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 14. Химия алюминия Простое вещество
- •II. Взаимодействие cо сложными веществами.
- •Оксид алюминия Al2o3
- •Гидроксид алюминия Al(oh)3
- •Cоли алюминия
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 15. Химия железа Простое вещество
- •II. Взаимодействие со сложными веществами.
- •Соединения железа(II) Оксид железа(II)
- •Гидроксид железа(II)
- •Соединения железа(III) Оксид железа(III)
- •Гидроксид железа(III)
- •Cоли железа(III)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 16. Химия хрома и марганца
- •16.1. Хром
- •Простое вещество
- •Cоли хрома(III)
- •Соединения хрома(VI) Оксид хрома(VI), хромовый ангидрид
- •Кислоты и соли хрома(VI)
- •16.2. Марганец
- •Простое вещество
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 17. Химия меди и цинка
- •17.1. Медь
- •Простое вещество
- •I. Взаимодействие с простыми веществами.
- •II. Взаимодействие со сложными веществами.
- •Cоединения меди(I)
- •Соединения меди(II) Оксид меди(II)
- •Гидроксид меди(II)
- •Cоли меди(II)
- •17.2. Цинк
- •Простое вещество
- •Соединения цинка Оксид цинка ZnO
- •Гидроксид цинка Zn(oh)2
- •Соли цинка
- •Задания для самостоятельной работы
- •Ответы:
- •Часть II. Химия неметаллов
- •Глава 18. Химия водорода
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы:
- •Соединения водорода
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 19. Химия галогенов
- •19.1. Общая характеристика галогенов
- •Водородные соединения галогенов
- •19.2. Хлор
- •Хлороводород и соляная кислота
- •Кислородные кислоты хлора
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 20. Химия элементов подгруппы кислорода
- •20.1. Общая характеристика элементов подгруппы
- •Кислорода
- •20.2. Кислород
- •Простое вещество о2
- •I. Промышленные методы.
- •Простое вещество о3 (озон)
- •Соединения кислорода (с.О. 1) Пероксиды
- •Задания для самостоятельной работы
- •Ответы:
- •20.3. Вода
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •20.4. Сера
- •Простое вещество
- •Соединения серы Сероводород н2s
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Oксид серы(IV), cернистый газ
- •Сернистая кислота h2so3
- •I. Кислотные свойства.
- •II. Окислительно-восстановительные свойства.
- •Оксид серы(VI), cерный газ
- •Серная кислота
- •II. Окислительно-восстановительные свойства.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 21. Химия элементов подгруппы азота
- •21.1. Общая характеристика элементов подгруппы азота
- •21.2. Азот
- •Простое вещество
- •I. Промышленные способы.
- •II. Лабораторные способы.
- •Соединения азота Аммиак
- •II. Лабораторные способы.
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли аммония
- •Оксиды азота
- •Азотистая кислота и ее соли
- •Азотная кислота
- •I. Кислотно-основные свойства.
- •II. Окислительно-восстановительные свойства.
- •Соли азотной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •21.3. Фосфор
- •Простое вещество
- •Фосфорные кислоты
- •I. В промышленности.
- •II. В лаборатории.
- •Соли ортофосфорной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 22. Химия элементов подгруппы углерода
- •22.1 Общая характеристика элементов подгруппы углерода
- •22.2. Углерод
- •Простое вещество
- •Неорганические соединения углерода с отрицательными степенями окисления (карбиды металлов)
- •Оксид углерода(II)
- •Оксид углерода(IV)
- •Угольная кислота
- •Соли угольной кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •22.3. Кремний
- •Простое вещество
- •I. Промышленный способ:
- •II. Лабораторные способы:
- •Соединения кремния (с.О.4) Водородные соединения (силаны)
- •Оксид кремния(IV)
- •Кремниевые кислоты
- •Cоли кремниевых кислот (силикаты)
- •Задания для самостоятельной работы
- •Ответы:
- •Раздел III. Органическая химия
- •Глава 23. Строение и номенклатура органических соединений
- •23.1 Теория строения органических соединений
- •23.2. Номенклатура органических соединений
- •Задания для самостоятельной подготовки
- •Глава 24. Химия углеводородов
- •24.1. Алканы
- •II. Лабораторные методы.
- •24.2. Циклоалканы
- •24.3. Алкены
- •24.4. Диеновые углеводороды
- •24.5. Алкины
- •24.6. Арены
- •I. Реакции электрофильного замещения.
- •III. Реакции окисления.
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 25. Кислородсодержащие органические соединения
- •25.1. Спирты и фенолы
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.2. Альдегиды. Кетоны
- •I. Реакции присоединения.
- •II. Реакции полимеризации.
- •III. Реакция поликонденсации.
- •Задания для самостоятельной работы
- •Ответы:
- •25.3. Карбоновые кислоты
- •I. Кислотные свойства.
- •II. Реакции с разрывом связи со (замещение он-группы).
- •III. Реакции с разрывом сн связи у -углеродного атома.
- •Обучающая задача
- •Задания для самостоятельной работы
- •Ответы:
- •25.4. Сложные эфиры. Жиры
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 26. Химия углеводов
- •26.1. Моносахариды
- •Глюкоза
- •Другие моносахариды
- •26.2. Дисахариды Мальтоза
- •Сахароза
- •26.3. Полисахариды Крахмал
- •Целлюлоза (клетчатка)
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 27. Азотсодержащие органические соединения
- •27.1. Амины
- •27.2. Аминокислоты
- •Задания для самостоятельной работы
- •Ответы:
- •Глава 28. Гетероциклические соединения. Нуклеиновые кислоты
- •28.1. Гетероциклические соединения
- •Пиридин
- •28.3. Нуклеиновые кислоты
- •Задания для самостоятельной работы
- •Ответы:
- •1. Таблица растворимости
8.3. Влияние температуры на скорость реакции
При повышении температуры скорость химических реакций обычно возрастает. Для реакций, протекающих при температурах, близких к комнатной, зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа (1879): скорость большинства химических реакций увеличивается в 2-4 раза при повышении температуры на каждые 10 градусов.
Математически эта зависимость может быть выражена формулой:
![]() (17)
(17)
где v2
и v1
- cкорости реакции при температурах
![]() и
и
![]() ,
соответственно,
- температурный (термический) коэффициент
Вант-Гоффа (
2-4).
,
соответственно,
- температурный (термический) коэффициент
Вант-Гоффа (
2-4).
8.4. Энергия активации
Не всякое соударение молекул приводит к взаимодействию. Реагируют только так называемые “активные” молекулы, обладающие энергией активации (Еа), смысл которой иллюстрирует нижеприведенная схема:
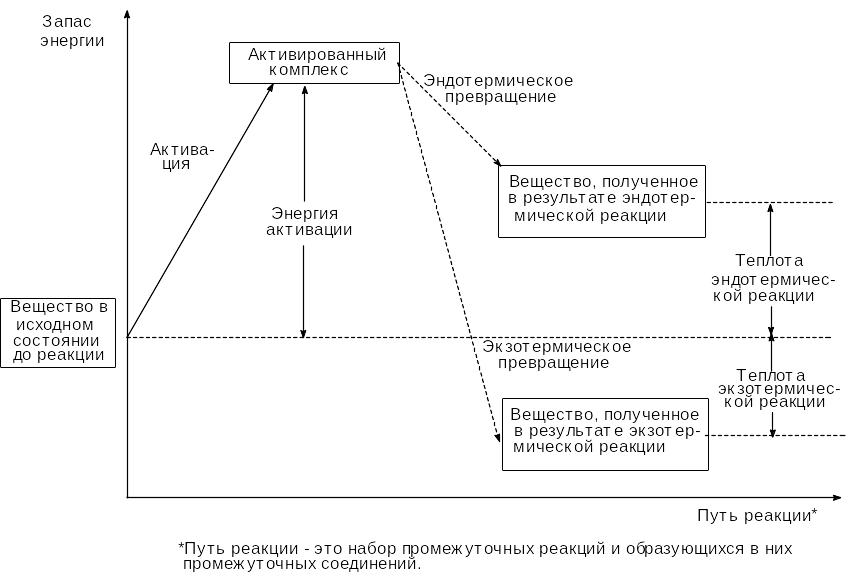
Энергия активации - это энергия, которая необходима молекуле для разрыва старых связей и образования новых, т.е. для образования активированного комплекса.
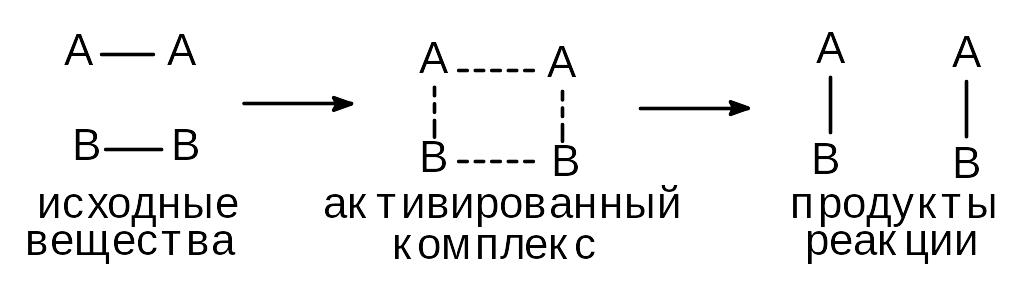
Энергия активации зависит от природы реагирующих веществ и является характеристикой каждой реакции. С повышением температуры число “активных” молекул растет, скорость реакции увеличивается.
8.5. Влияние катализатора на скорость реакции
Катализатор - это вещество, которое, участвуя в химической реакции, изменяет ее скорость, оставаясь неизменным.
Все сложные реакции в живых организмах осуществляются с помощью биологических катализаторов - ферментов. Помимо изменения скорости реакции катализатор способен изменять ее направление:
![]()
Катализаторы бывают положительные и отрицательные. Положительные катализаторы увеличивают скорость реакций; отрицательные (ингибиторы) - замедляют. К ингибиторам относятся различные консерванты, антиоксиданты. Их используют в тех случаях, когда хотят уменьшить скорость таких процессов, как коррозия, гниение, замедлить протекание реакций, идущих со взрывом.
Изменение скорости реакции в присутствии катализаторов называется катализом. Катализ подразделяется на:
а) гомогенный - реагирующие вещества и катализатор находятся в одном и том же агрегатном состоянии:
2SO2 + O2
![]() 2SO3
2SO3
б) гетерогенный - реагирующие вещества и катализатор представляют систему, состоящую из разных фаз, между которыми существует поверхность раздела:
C2H4 + H2
![]() C2H6
C2H6
в) микрогетерогенный, когда частицы катализатора имеют размеры, большие, чем у обычных молекул, но недостаточные для того, чтобы создать поверхность раздела фаз (биокаталитические процессы):
C6H12O6
![]() 2СO2
+ 2C2H5OH
2СO2
+ 2C2H5OH
В соответствии с теорией промежуточных соединений механизм действия катализаторов объясняется образованием промежуточных соединений (молекул, ионов, адсорбционных соединений):
A + K AK; AK + B AB + K
Суммарный процесс: А + В АВ
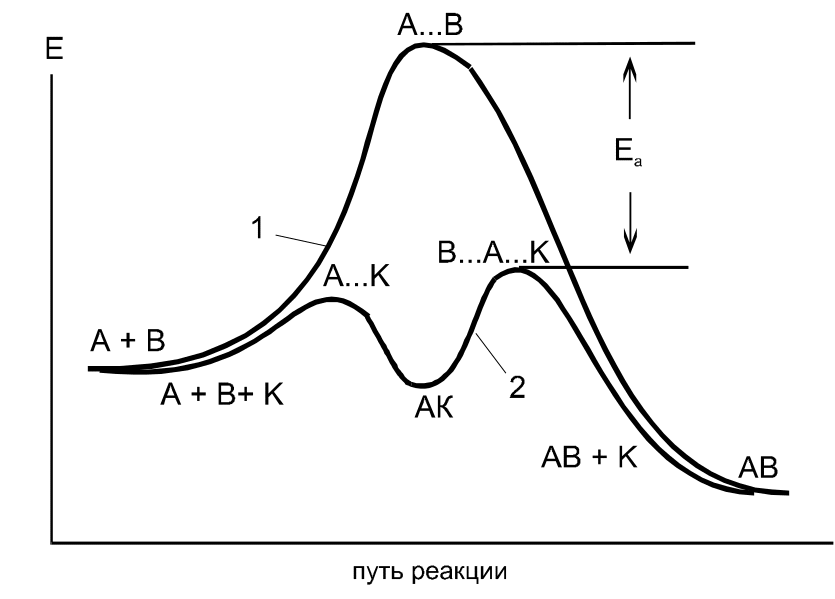
Кривая 1 показывает изменение потенциальной энергии в системе при протекании реакции без катализатора, кривая 2 - в процессе каталитической реакции.
Эта кривая имеет два энергетических барьера. Первый отвечает энергии активации, необходимой для образования активированного комплекса А...К, второй - для образования активированного комплекса В...АК. Минимум на кривой соответствует образованию промежуточного соединения АК.
Энергия активации каталитического процесса значительно меньше, чем некаталитического, что объясняет более высокую скорость реакции с участием катализатора. Ингибиторы увеличивают энергию активации и тем самым уменьшают скорость реакции.
Кроме изменения энергии активации катализатор также увеличивает вероятность благоприятной ориентации молекул в момент соударения, разворачивая молекулы нужным образом.
Избирательность действия катализаторов можно продемонстрировать следующими примерами:
C2H5OH![]() C2H4
+ H2O,
но! С2H5OH
C2H4
+ H2O,
но! С2H5OH![]() CH3CHO
+ H2
CH3CHO
+ H2
Каталитические яды снижают или уничтожают активность катализатора. Так, соединения мышьяка, ртути, свинца оказывают отравляющее действие на платиновые катализаторы.
Промоторы, наоборот, усиливают действие катализаторов. Например, железо и алюминий промотируют платину.
