
- •1. Гранулометрический состав горных пород и методы его определения.
- •2. Седиментационный анализ механического состава горных пород.
- •3. Пористость горных пород. Коэффициент пористости.
- •4. Экстрагирование кернов. Принцип работы аппаратов Сокслета.
- •5. Определение коэффициента открытой пористости методом Преображенского.
- •26. Плотность природного газа и отдельных компонентов смеси.
- •6. Понятие насыщенности. Определение коэффициентов водо-, нефте- и газонасыщенности горных пород.
- •7. Проницаемость горных пород. Коэффициент абсолютной проницаемости.
- •8. Определение коэффициента абсолютной проницаемости по газу.
- •9 . Проницаемость горных пород. Явление проскальзывания газа.
- •8. Фазовые и относительные проницаемости горной породы.
- •9 . Графики относительных проницаемостей для системы «нефть-газ». Капиллярное число.
- •12. Движение смеси нефти, газа и воды в пористой среде.
- •13. Распределение пор по размерам. Функция Леверетта.
- •1 3. Зависимость проницаемости от пористости и размера пор.
- •14. Удельная поверхность горных пород. Связь с проницаемостью, пористостью и размером пор.
- •15. Деформационные свойства горных пород.
- •16. Деформация коллекторов при разработке нефтяных и газовых месторождений.
- •18. Поверхностное натяжение на границе раздела фаз. (17)
- •19. Смачивание и краевой угол смачивания.
- •22. Состав и классификация нефтей.
- •23. Состав и классификация природных газов.
- •24. Смеси газов. Мольная, массовая и объемная концентрации компонентов. Связь между ними.
- •25. Уравнение состояния реальных газов. Коэффициент сверхсжимаемости. (9,8)
- •38. Влагосодержание природных газов.
- •24. Закон соответственных состояний. Монограмма сверхсжимаемости.
- •26. Средняя молекулярная масса природного газа.
- •27. Парциальные давления и объём компонентов в смеси идеальных газов.
- •28. Упругость насыщенных паров.
- •29. Растворимость газов в нефти. Закон Генри.(11)
- •30. Плотность нефти. Зависимость от давления, температуры и состава.
- •34.Схема фазовых превращений бинарной смеси.
- •3 1. Вязкость нефти. Зависимость от давления, температуры и состава.
- •32. Структурно механические свойства аномальновязких нефтей.
- •33. Схема фазовых превращений индивидуальных компонентов углеводородов.(18)
- •35. Закон Рауля-Дальтона.
- •36. Особенности фазовых превращений газоконденсатных углеводородных систем.
- •36. Критическая температура и давление реальных углеводородных систем.
- •38. Уравнения фазовых концентраций и компонентов в смеси углеводородов.
35. Закон Рауля-Дальтона.
Фазовые переходы подчиняются определённым закономерностям, в основе которых лежит понятие равновесия фаз. Равновесие фаз характеризуется константой равновесия, которая зависит от температуры и давления.
Константа фазового
равновесия i-го компонента характеризуется
отношением мольной доли компонента в
газовой фазе (уi или Nyi) к мольной доле
этого компонента в жидкой фазе (хi или
Nxi), находящейся в равновесном состоянии
с газовой фазой:
![]()
Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля.
Согласно закону
Дальтона каждый компонент, входящий в
газовую фазу имеет своё парциальное
давление Pi, а общее давление в газовой
системе равно сумме парциальных давлений:
![]()
Согласно закону
Рауля, парциальное давление компонента
над жидкостью (нефтью) равно давлению
насыщенного пара (Рнас. пара) или упругости
пара (Qi) и этого компонента, умноженному
на его мольную долю в нефти:
![]() или
или
![]()
где Qi – упругость паров компонента;
Nxi – мольная доля компонента;
piнас. пара – давление насыщенного пара i-го компонента.
В момент равновесия
парциальное давление i-го компонента в
газовой фазе равно парциальному давлению
компонента над жидкостью. И это описывается
законом Дальтона-Рауля для равновесного
состояния газовой и нефтяной фазы:
![]() ,
,
![]()
где Кi – константа равновесия i-го компонента при данной температуре и давлении смеси.
Оценить состав
газовой (Nyi) и жидкой (Nxi) фаз можно на
основе уравнения материального баланса,
записанного для одного моля нефтегазовой
смеси (Nzi):
![]()
где L – мольная доля жидкой фазы;
V – мольная доля паровой фазы;
Nzi – мольные доли компонентов в нефтегазовой смеси.
По условию сумма мольной доли жидкой и паровой фаз равна единице. Отсюда: V=1–L
Используя уравнения
получим выражение для мольной доли
компонента жидкой фазы:
![]() или
или
![]() и для мольной доли компонента газовой
фазы:
и для мольной доли компонента газовой
фазы:
![]() .
Величины: V и L оцениваются и уточняются
методом последовательных проб и
приближений.
.
Величины: V и L оцениваются и уточняются
методом последовательных проб и
приближений.
36. Особенности фазовых превращений газоконденсатных углеводородных систем.
В связи с преобладанием метана в смеси закономерности фазовых переходов для упрощения изучают на бинарных смесях. При этом многокомпонентная смесь приводится к бинарной, основным компонентом которой является метан, а вторым – остальные компоненты.
Б![]()
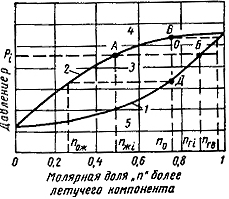
![]()
![]() инарная
система с молярной долей летучего
компонента n0
начнет
конденсироваться в точке Д. При этом в
жидкой фазе молярная доля легкого
компонента nож.
При давлении рi
содержание легкого компонента в газовой
фазе будет nri,
а в жидкой – nж.
В точке В,
соответствующей концу процесса
конденсации, в последних
следах газовой фазы молярная доля
легкого компонента составит
nгв.
Относительное количество углеводородов
в газовой V
ижидкой L
фазах при давлениир, составит:
инарная
система с молярной долей летучего
компонента n0
начнет
конденсироваться в точке Д. При этом в
жидкой фазе молярная доля легкого
компонента nож.
При давлении рi
содержание легкого компонента в газовой
фазе будет nri,
а в жидкой – nж.
В точке В,
соответствующей концу процесса
конденсации, в последних
следах газовой фазы молярная доля
легкого компонента составит
nгв.
Относительное количество углеводородов
в газовой V
ижидкой L
фазах при давлениир, составит:
![]()
36. Критическая температура и давление реальных углеводородных систем.
Левая точка со знаком СН4 соответствует критическим параметрам чистого метана. Каждая кривая справа оканчивается точкой с критическими параметрами второго Более тяжелого углеводорода. Между ними находятся критические точки смесей с различным содержанием метана и второго компонента.
По методу г. С. Степановой сначала определяется средняя эквивалентная молекулярная масса сложного компонента С2+:
![]()
где gi — массовые концентрации углеводородов сложного компонента.
По эквивалентной молекулярной массе наносится критическая кривая исследуемой смеси.
К![]() ритическая
температура Ткр
смеси
ритическая
температура Ткр
смеси
![]() где
где
![]() а
поправку ΔT
находят по средней молекулярной массе:
а
поправку ΔT
находят по средней молекулярной массе:
и молярного содержания метана в смеси по эмпирическим графикам.
