
- •2 Билет.
- •3 Билет.
- •Электромагнитное взаимодействие
- •Сильное взаимодействие
- •Слабое взаимодействие
- •4 Билет.
- •5 Билет.
- •6 Билет.
- •7 Билет.
- •8 Билет.
- •9 Билет.
- •4. Релятивистский закон сложения скоростей.
- •10 Билет.
- •Функции состояния
- •11 Билет.
- •[Править]Примеры равновесных процессов
- •12 Билет.
- •13 Билет.
- •14 Билет.
- •15 Билет.
10 Билет.
Молекулярная физика – раздел курса общей физики, в котором изучаются макроскопические свойства вещества, обусловленные его молекулярным строением, характером движения молекул и силами, действующими между ними.
В статистическом методе микроскопические величины, характеризующие движение молекулы (к примеру, ее импульс в данный момент времени), являются непредсказуемыми, случайными. Для построения теории создается гипотетическая модель механизма молекулярного движения и пространственного строения вещества. Затем в этой модели разрабатываются методы нахождения плотности вероятностей тех или иных величин, зная которые вычисляют средние значения этих величин.
В термодинамическом методе исследования вещества, в отличие от статистического, не вводятся в рассмотрение какие-либо модельные представления об атомно-молекулярном строении тела, а ставится своей задачей установление зависимости между непосредственно наблюдаемыми макроскопическими (измеряемыми в опыте) величинами, такими как давление, температура, объем, концентрация, напряженность электрического или магнитного поля и т. п. Термодинамика как теоретическая дисциплина строится на трех фундаментальных законах (началах), установленных на основании огромного опытного знания, относящегося к поведению макроскопических систем. Выводы термодинамики имеют весьма общий характер, независимый от выбора гипотетической модели структуры вещества, независимо от характера движения молекул, взаимодействия между ними. Результаты, получаемые в статистической теории, существенным образом зависят от выбора этой гипотетической модели. Недостатком термодинамического метода является невозможность с помощью его вскрыть молекулярную сущность изучаемых явлений.
Функции состояния
Функции состояния зависят только от текущего состояния системы и не зависят от пути, по которому система пришла в это состояние.
Функции состояния в термодинамике включают:
температуру,
давление,
объём,
энтропию,
а также термодинамические потенциалы.
В зависимости от выбранной модели некоторые из этих величин, строго говоря, могут быть не функциями, а независимыми переменными.
Эти величины не являются независимыми. Связь между термодинамическими параметрами для конкретной системы называется уравнением состояния.
В случае, если известно каноническое уравнение состояния, задание любой пары параметров из следующих:
энтропия и объём,
энтропия и давление,
температура и объём,
температура и давление,
позволяет вычислить остальные два параметра.
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
Давле́ние (P) — физическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:
![]()
Среднее давление по всей поверхности есть отношение силы к площади поверхности:
![]()
Давление характеризует состояние сплошной среды и является диагональной компонентой тензора напряжений. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации. Давление можно считать также мерой запасённой в сплошной среде потенциальной энергии на единицу объёма и измерять в единицах энергии, отнесённых к единице объёма.
Объём — количественная характеристика пространства, занимаемого телом или веществом. Объём тела или вместимость сосуда определяется его формой и линейными размерами. С понятием объёма тесно связано понятие вместимость, то есть объём внутреннего пространства сосуда, упаковочного ящика и т. п. Синонимом вместимости частично является ёмкость, но словом ёмкость обозначают также сосуды.
Энтропи́я (от др.-греч. ἐντροπία «поворот», «превращение») в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит и количество информации; в исторической науке, дляэкспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота, подведенная к системе; T — абсолютная температура процесса.
Уравне́ние состоя́ния — уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура,давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
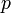 — давление,
— давление,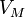 — молярный
объём,
— молярный
объём,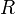 — универсальная
газовая постоянная
— универсальная
газовая постоянная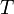 — абсолютная
температура,К.
— абсолютная
температура,К.
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
