
- •1. Общая характеристика металлов. Атомно-кристаллическое строение металлов. Дефекты кристаллического строения.
- •5.Сплавы. Фазы в металлических сплавах. Виды твердых растворов. Химические соединения. Механические смеси.
- •10 Разрушение металлов. Виды разрушения (вязкое, хрупкое, усталостное). Строение изломов.
- •11.Фрактография как метод технической экспертизы.
- •17 Белые чугуны. Виды, свойства, микроструктура, маркировка чугунов
- •6 )Диаграммы состояния сплавов
- •12.Механические свойства, определяемые при статических испытаниях. Испытания на растяжение, сжатие, изгиб.
- •32. Алюминиевые сплавы
- •44 Композиционные материалы
- •13.Испытания на твердость.
- •17.Углеродистые стали.
- •43 Термореактивные пластмассы
- •45 Резиновые материалы
- •45 Проделжение
6 )Диаграммы состояния сплавов
Диаграммы состояния представляют собой графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия, т. е. такого состояния сплава, которое достигается при очень малых скоростях охлаждения или длительном нагреве. Диаграммы состояния сплавов в равновесном состоянии являются теоретическими диаграммами, так как истинное равновесие в практических условиях достигается редко. В большинстве случаев сплавы находятся в метастабильном состоянии, т. е. в состоянии с ограниченной устойчивостью. Диаграмма состояния сплавов для случая неограниченной растворимости компонентов в твердом состоянии. Рассмотрим диаграмму состояния сплавов системы медь - никель (рис. 14). Медь и никель, соединяясь в любых пропорциях, образуют непрерывный ряд твердых растворов, так как атомы никеля способны заместить в кристаллической решетке все атомы меди. Температура плавления меди составляет 1083°С, никеля 1445°С. Рассмотрим кривые охлаждения (рис. 14, а) сплавов системы медь-никель для пяти составов следующей концентрации, %: lOOCu, 80Cu+20Ni, 60Cu+40Ni, 20Cu+80Ni, lOONi. Чистые металлы (кривые 1 и 5) имеют одну критическую точку - температуру затвердевания (кристаллизации), а сплавы (кривые 2, 3, 4) - две, т. е. сплавы в отличие от чистых металлов кристаллизуются в интервале температур. Например, кристаллизация сплава 3 начинается при температуре t1 (точка a1), при этой температуре из жидкого сплава начинают выпадать первые кристаллы твердого α-раствора, а заканчивается кристаллизация при температуре t3 (точка b1). При этой температуре затвердевает последняя капля жидкого сплава. Разная температура конца кристаллизации сплавов свидетельствует о том, что состав твердой фазы непрерывно изменяется.
 Рис.
14. Диаграмма состояния сплавов медь-никель
Рис.
14. Диаграмма состояния сплавов медь-никель
Для построения диаграммы состояния (рис. 14, 6) на оси абсцисс сетки в координатах температура - концентрация откладывают (отмечают точками) составы пяти сплавов и восстанавливают из каждой точки вертикальные линии. После этого переносят на эти вертикальные линии с кривых охлаждения сплавов критические точки, а на левой и правой ординатах температур отмечают температуры кристаллизации чистых металлов - меди (100%) и никеля (100%). Соединив плавными кривыми температуры начала и конца кристаллизации всех сплавов, получают диаграмму состояния сплавов системы медь-никель с неограниченной растворимостью компонентов в твердом состоянии. Сплавы меди и никеля кристаллизуются и затвердевают в некотором температурном интервале. В пределах этого температурного интервала одновременно существуют две фазы: жидкий сплав и кристаллы твердого раствора - меди и никеля. На диаграмме этот интервал ограничен двумя линиями, соединяющими точки плавления чистых меди и никеля. Верхняя линия обозначает начало затвердевания при охлаждении или конец расплавления при нагреве, нижняя соответственно конец затвердевания или начало плавления. Рассмотренная диаграмма состояния сплава меди и никеля имеет три области. Область существования жидкого расплава лежит выше верхней линии, соединяющей точки плавления меди и никеля, а область существования кристаллических твердых растворов - ниже нижней линии. Между этими линиями находится двухфазная область, в которой одновременно существуют расплав и кристаллы твердого раствора. Верхнюю границу этой области называют линией ликвидус, а нижнюю - солидус («ликвидус» в переводе с латинского означает жидкий, «солидус» - твердый). По этой же диаграмме состояния можно определить концентрации твердой и жидкой фаз в сплаве при его кристаллизации. Например, для сплава 3 при температуре t2 концентрация фаз определяется горизонтальной линией mn1, проведенной до пересечения с линиями солидус и ликвидус. Точка n1 показывает концентрацию твердой фазы, а точка m - концентрацию жидкой фазы. При температуре t3 концентрация твердой фазы определяется точкой b1 на диаграмме состояния, а концентрация жидкой фазы – точкой m1. Из сказанного следует, что в процессе кристаллизации непрерывно изменяется состав фаз: жидкой по линии ликвидус и твердой по линии солидус. Кристаллы твердого раствора, выпадающие из жидкого при разной температуре, имеют переменный состав. Выросшие в первый момент кристаллизации, оси кристаллов обычно обогащаются тугоплавким компонентом (никелем), а междуосные пространства заполняются позже и обогащаются более легкоплавким компонентом (медью). Такую неоднородность отдельных кристаллов какого-либо сплава называют внутрикристаллической, или дендритной ликвацией. Дендритная ликвация тем больше, чем больше расстояние между линиями ликвидус и солидус. Обычно это явление нежелательно и дендритную ликвацию предотвращают последующим длительным нагревом для выравнивания состава сплава, вследствие происходящего в нем диффузионного процесса. К твердым растворам относят также сплавы систем Си-Аи, Ag-Аи, Ni-Аи, Fe-Cr, Fe-Va, Bi-Sb и др., кристаллизующиеся по рассмотренному типу диаграммы состояния, когда оба компонента неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
Диаграмма состояния сплавов, образующих механические смеси из чистых компонентов. Рассмотрим, например, диаграмму состояния сплавов системы висмут-кадмий (рис. 15). Область существования жидкого расплава ограничена сверху ломаной линией, соединяющей точки плавления висмута и кадмия через точку Е. В точке Е сплав (40% висмута и 60% кадмия) имеет одинаковые температуры ликвидуса и солидуса. Все остальные сплавы системы затвердевают и плавятся в пределах температурного интервала, который снизу ограничен горизонтальной линией солидуса. Сплав в точке Е имеет очень мелкие кристаллы висмута и кадмия, находящиеся в определенном взаимном расположении. Этот сплав называется эвтектикой («эвтектика » в переводе с греческого означает легкоплавкая). Эвтектикой называют механическую смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкого сплава. Твердые сплавы, лежащие левее эвтектической точки Е, и сплавы, содержащие до 40% висмута, называют доэвтектическими, а лежащие правее точки Е и содержащие более 40% висмута - заэвтектическими. Доэвтектические сплавы состоят из смеси кристаллов висмута и эвтектики (кристаллы висмута + кристаллы кадмия), а заэвтектические - из смеси кристаллов кадмия с эвтектикой. По этому типу диаграммы состояния кристаллизуются также сплавы систем Zn-Sn, Pb-Ag, Ni-Cr, Cr-Mn, Cu–Bi, Al-Si.
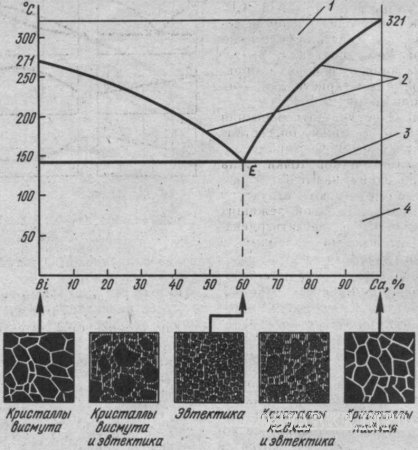 Рис.
15. Диаграмма состояния сплавов
висмут-кадмий:
1 – жидкий сплав, 2 –
линия ликвидуса, 3 – линия солидуса, 4 –
механическая смесь кристаллов висмута
и кадмия, Е – эвтектика
Рис.
15. Диаграмма состояния сплавов
висмут-кадмий:
1 – жидкий сплав, 2 –
линия ликвидуса, 3 – линия солидуса, 4 –
механическая смесь кристаллов висмута
и кадмия, Е – эвтектика
Диаграмма состояния сплавов для случая ограниченной растворимости компонентов в твердом состоянии.Одна из таких диаграмм показана на рис. 16, а. Система содержит три фазы - жидкий раствор, твердый раствор компонента В в компоненте А (назовем его α) и твердый раствор компонента А в компоненте В (назовем его β). Линия диаграммы KCD - линия ликвидуса, линия KECFD - линия солидуса. Кристаллы α выделяются из жидкого сплава по линии ликвидуса КС, а кристаллы β - по линии CD. Затвердевание сплавов происходит по линии солидуса КЕ с образованием кристаллов α и по линии DF - с образованием кристаллов β. Одновременная кристаллизация α- и β-фаз с образованием механической смеси кристаллов этих фаз происходит на линии солидуса ECF. Сплав состава точки С после затвердевания называется эвтектическим, поскольку он состоит только из одной эвтектики α+β. Составы сплавов, лежащих левее эвтектической точки С на линии ЕС после затвердевания, называются доэвтектическими сплавами и имеют структуру α+эвтектика (α+β). Составы сплавов, лежащих правее точки С на линии CF после затвердевания, называются заэвтектическими сплавами и имеют структуру β+эвтектика (α+β).
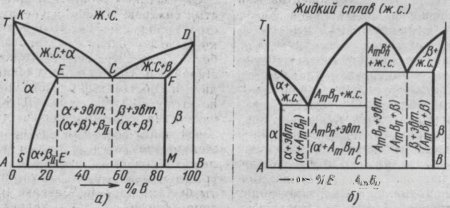 Рис.
16. Диаграмма состояния сплавов для
случаев ограниченной растворимости
компонентов в твердом состоянии (а) и
для случаев образования компонентами
А и В химического соединения (б)
Рис.
16. Диаграмма состояния сплавов для
случаев ограниченной растворимости
компонентов в твердом состоянии (а) и
для случаев образования компонентами
А и В химического соединения (б)
Линия ES показывает ограниченную растворимость в твердом состоянии компонента В в компоненте А, уменьшающуюся с понижением температуры. Линия FM показывает растворимость компонента А в В, не изменяющуюся с понижением температуры. Предельная растворимость компонента В в А характеризуется точкой Е, а А в В - точкой F. При кристаллизации сплавов, состав которых находится левее точки S (или правее точки М), при любой температуре в твердом состоянии все количество компонента В (или А) находится в твердом растворе и структура таких сплавов состоит из зерен α (или β). В сплавах, состав которых находится между точками S и Е (за пределами растворимости В в А), образовавшиеся при затвердевании кристаллы α при понижении температуры ниже линии ES пересыщены компонентом В и поэтому из них происходит выделение избыточных кристаллов. Этими кристаллами являются кристаллы β концентрации точки М, называемые вторичными (βII). Такие сплавы после полного охлаждения имеют структуру, состоящую из кристаллов α состава точки S и кристаллов βII, т. е. α+βII. В сплавах состава линии ЕС, имеющих после затвердевания структуру α+эвтектика (α+β), из кристаллов α выделяются кристаллы β и после полного охлаждения структура будет α+эвтектика (α+β)+βII. Диаграммы состояния сплавов, образующих химические соединения. Сплавы, имеющие химическое соединение (рис. 16, б) компонентов А и В, имеют сложную диаграмму состояния. Химическое соединение обозначают АmВn. Это указывает на то, что в данном соединении на m атомов компонента А приходится n атомов компонента В. Число фаз в данной системе три - жидкий раствор, твердый раствор компонента В в компоненте А (фаза α) и твердый раствор компонента А в компоненте В (фаза β). Данная диаграмма как бы составлена из диаграмм для двух систем: компонент А – химическое соединение АmВn, и компонент В – химическое соединение АmВn. В сплавах левее точки С компонента А имеется больше, чем входит в химическое соединение АmВn. Следовательно, в этих сплавах левее точки С образуется эвтектика α+АmВn. В сплавах правее точки С компонента В больше, чем может входить в химическое соединение АmВn. Следовательно, в этих сплавах образуется эвтектика АmВn+β.
7.Упругая и пластическая деформации.
Под воздействием приложенных из вне нагрузок металлы могут деформироваться в упругой области (без остаточных явлений), а именно без изменения размеров и деформироваться пластически, когда изменяется форма и размеры деформируемого металла.
Упругая деформация характеризуется двумя модулями: модуль Гука (модуль нормальной упругости) и модуль Юнга (модуль касательной упругости). В модуле Гука атомы стремятся по нормали, во втором случае – по касательной.Естественно, учитывая силы межатомного взаимодействия, модуль Гука будет в несколько раз больше модуля Юнга и они не являются структурно-чувствительными свойствами.Пластическая деформация может проходить по двум механизмам: скольжения и двойникования.При реализации механизма скольжения часть кристалла смещается по отношению к другой под воздействием напряжений, превышающих критическую величину.При чем это скольжение осуществляется по так называемым плоскостям скольжения. Каковыми являются плоскости наиболее упакованные атомами. Деформация по механизму двойникования заключается в смещении одной части кристаллов в зеркальное отражение по отношению к другой по, так называемым, плоскостям двойникования. Точнее в этом случае смещение происходит за счет разворота части кристаллической решетки. деформация двойникования также как и скольжения осуществляется при прохождении дислокации через кристалл. Практически любой металл деформируется сразу по двум механизмам с преобладанием какого-либо одного.
8. Влияние нагрева на строение и свойства деформированного металла.
Деформированный металл находится в неравновесном состоянии. Переход к равновесному состоянию связан с уменьшением искажений в кристаллической решетке, снятием напряжений, что определяется возможностью перемещения атомов.При низких температурах подвижность атомов мала, поэтому состояние наклепа может сохраняться неограниченно долго.При повышении температуры металла в процессе нагрева после пластической деформации диффузия атомовувеличивается и начинают действовать процессы разупрочнения, приводящие металл в более равновесное состояние – возврати рекристаллизация.Возврат. Небольшой нагрев вызывает ускорение движения атомов, снижение плотности дислокаций, устранение внутренних напряжений и восстановление кристаллической решеткиПроцесс частичного разупрочнения и восстановления свойств называется отдыхом (первая стадия возврата). Имеет место при температуре Т=(0.25…0,3)Т..Возврат уменьшает искажение кристаллической решетки, но не влияет на размеры и форму зерен и не препятствует образованию текстуры деформации.Полигонизация – процесс деления зерен на части: фрагменты, полигоны в результате скольжения и переползания дислокаций.При температурах возврата возможна группировка дислокаций одинаковых знаков в стенки, деление зерна малоугловыми границами При нагреве до достаточно высоких температур подвижность атомов возрастает и происходит рекристаллизация.Рекристаллизация – процесс зарождения и роста новых недеформированных зерен при нагреве наклепанного металла до определенной температуры.Нагрев металла до температур рекристаллизации сопровождается резким изменением микроструктуры и свойств. Нагрев приводит к резкому снижению прочности при одновременном возрастании пластичности. Также снижается электросопротивление и повышается теплопроводность.1 стадия – первичная рекристаллизация (обработки) заключается в образовании центров кристаллизации и росте новых равновесных зерен с неискаженной кристаллической решеткой. Новые зерна возникают у границ старых зерен и блоков, где решетка была наиболее искажена. Количество новых зерен постепенно увеличивается и в структуре не остается старых деформированных зерен.Движущей силой первичной рекристаллизации является энергия, аккумулированная в наклепанном металле. Система стремится перейти в устойчивое состояние с неискаженной кристаллической решеткой.2 стадия – собирательная рекристаллизация заключается в росте образовавшихся новых зерен.Движущей силой является поверхностная энергия зерен. При мелких зернах поверхность раздела большая,поэтому имеется большой запас поверхностной энергии.
9/Холодная и горячая пластическая деформация В зависимости от соотношения температуры деформации и температуры рекристаллизации различают холодную и горячую деформации. Холодной деформацией называют такую, которую проводят при температуре ниже температуры рекристаллизации. Поэтому холодная деформация сопровождается упрочнением (наклепом) металла.Деформацию называют горячей, если ее проводят при температуре выше температуры рекристаллизации дляполучения полностью рекристаллизованной структуры.При этих температурах деформация также вызывает упрочнение «горячий наклеп», которое полностью или частично снимается рекристаллизацией, протекающей при температурах обработки и при последующем охлаждении. В отличие от статической полигонизации и рекристаллизации, процессыполигонизации и рекристаллизации, происходящие в период деформации, называют динамическими.При горячей обработке давлением (прокатке, прессовании, ковке, штамповке и т. д.) упрочнение в результате наклепа (повышение плотности дислокаций) непосредственно в процессе деформации непрерывно чередуется с процессом разупрочнения (уменьшением плотности дислокаций) при динамической полигонизации и рекристаллизации во время деформации и охлаждения. В этом основное отличие динамической полигонизации и рекристаллизации от статической.Горячую деформацию в зависимости от состава сплава и скорости деформации обычно проводят при температурах (0,7-0,75) Тпл.Когда металл после деформации имеет частично рекристаллизованную рекристаллизованную структуру, то такую обработку правильнее называть неполной горячей, или теплой, деформацией.
