
- •Часть I
- •1. Свойства и строение металлов
- •Свойства металлов
- •Кристаллическое строение металлов
- •Типы кристаллических решеток важнейших металлических элементов
- •1.3. Дефекты строения кристаллических тел
- •1.3.1. Точечные дефекты
- •1.3.2. Линейные дефекты
- •1.3.3. Теоретическая и фактическая прочность
- •1.3.4. Поверхностные дефекты
- •2. Кристаллизация металлов
- •2.1. Энергетические условия кристаллизации
- •2.2. Механизм процесса кристаллизации
- •3. Механические свойства металлов
- •3.1. Общая характеристика механических свойств
- •3.2. Механические свойства, определяемые при статических испытаниях
- •3.3 Порог хладноломкости
- •3.4. Основные направления повышения прочности металлов. Конструктивная прочность
- •4. Деформация и разрушение металлов
- •4.1. Виды напряжений
- •4.2. Упругая и пластическая деформации металлов
- •4.3. Сверхпластичность металлов и сплавов
- •4.4. Разрушение металлов
- •5. Влияние нагрева на структуру и свойства деформированного металла
- •5.1. Возврат и полигонизация
- •5.2. Рекристаллизация
- •5.3. Холодная и горячая деформации
- •6. Строение и свойства типовых двухкомпонентных сплавов
- •6.1. Понятие о физико-химическом анализе
- •6.2. Диаграмма состояния систем с полной растворимостью компонентов в твердом состоянии
- •6.3. Применение правила отрезков
- •6.5. Внутрикристаллическая ликвация
- •6.5. Диаграммы состояния систем с ограниченной растворимостью компонентов в твердом состоянии с эвтектическими и перитектическими превращениями
- •6.6. Понятие об эвтектоидном и перитектоидном превращениях.
- •6.7. Диаграммы состояния системы, образующей химическое соединение.
- •7. Железо и сплавы на его основе
- •7.1. Компоненты и фазы в системе железо-углерод
- •7.2. Диаграмма состояния железо-цементит (метастабильное равновесие)
- •7.3. Диаграмма состояния железо-графит
- •7.4. Углеродистые стали
- •8. Углеродистые стали
- •8.1. Влияние углерода на свойства стали
- •8.2. Влияние примесей на свойства стали
- •8.3. Классификация углеродистых сталей
- •8.4. Стали обыкновенного качества
- •8.5. Качественные углеродистые стали
- •9. Чугуны
- •9.1. Виды чугунов
- •9.2. Факторы, способствующие графитизации
- •9.3. Микроструктура и свойства чугуна
Кристаллическое строение металлов
Вещество в твердом состоянии может иметь кристаллическое или аморфное строение. В аморфном веществе, например стекле, атомы расположены беспорядочно, а в кристаллическом – по геометрически правильной схеме, на определенном расстоянии друг от друга.
Общим свойством металлов и сплавов является их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена изображением не ряда периодически повторяющихся объемов, а одной элементарной ячейкой. Элементарной ячейкой называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла.
Наиболее часто металлы имеют кристаллические решетки следующих типов: объемноцентрированный куб или сокращенно ОЦК; гранецентрированный куб (ГЦК); гексагональная плотно-упакованная (ГП).
Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки атомов приведены на рис. 2. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния между центрами атомов, находящихся в соседних узлах решетки, называют параметрами или периодами решетки.
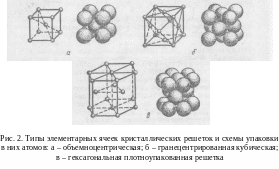
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары, то нетрудно видеть, что в решетке, помимо атомов, имеется значительное свободное пространство. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется координационным числом и коэффициентом компактности.
Координационным числом называется число атомов, находящихся на наиболее близком равном расстоянии от данного атома. Для ОЦК-решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП. В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП – 12.
Коэффициент компактности Q равен отношению суммарного объема атомов, входящих в решетку, к объему решетки.
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом (Feα) при более высокой β, затем γ и т. д.
Известны полиморфные превращения железа: Feα ↔ Feγ, титана Tiα ↔ Tiγ и других элементов.
Температура превращения одной кристаллической модификации в другую называется температурой полиморфного превращения.
При полиморфном превращении меняется форма и тип кристаллической решетки. Это явление называется перекристаллизацией. Так при температурах ниже 911°С устойчиво Feα, имеющее кристаллическую решетку ОЦК. Выше 911°С до 1392°С устойчиво Feγ, имеющее решетку ГЦК. При нагреве выше 911°С атомы решетки ОЦК перестраиваются, образуя решетку ГЦК. На явлении полиморфизма основана термическая обработка.
При переходе из одной полиморфной формы в другую меняются свойства, в частности плотность и соответственно объем вещества. Так, например плотность Feγ на 3 % больше плотности Feα, а удельный объем соответственно меньше. Эти изменения объема необходимо учитывать при термообработке.
Полиморфизм олова явился одной из причин гибели полярной экспедиции английского исследователя. Р. Скотта. Оловом были запаяны канистры с керосином. При низкой температуре произошло полиморфное превращение пластичного белого олова с образованием хрупкого порошка серого олова. Горючее вылилось и испарилось, и на обратном пути экспедиция осталась без топлива. Превращение белого олова в серое называют «оловянной чумой».
Типы кристаллических решеток важнейших металлических элементов приведены в табл. 1.
Таблица 1
