
- •Часть I
- •1. Свойства и строение металлов
- •Свойства металлов
- •Кристаллическое строение металлов
- •Типы кристаллических решеток важнейших металлических элементов
- •1.3. Дефекты строения кристаллических тел
- •1.3.1. Точечные дефекты
- •1.3.2. Линейные дефекты
- •1.3.3. Теоретическая и фактическая прочность
- •1.3.4. Поверхностные дефекты
- •2. Кристаллизация металлов
- •2.1. Энергетические условия кристаллизации
- •2.2. Механизм процесса кристаллизации
- •3. Механические свойства металлов
- •3.1. Общая характеристика механических свойств
- •3.2. Механические свойства, определяемые при статических испытаниях
- •3.3 Порог хладноломкости
- •3.4. Основные направления повышения прочности металлов. Конструктивная прочность
- •4. Деформация и разрушение металлов
- •4.1. Виды напряжений
- •4.2. Упругая и пластическая деформации металлов
- •4.3. Сверхпластичность металлов и сплавов
- •4.4. Разрушение металлов
- •5. Влияние нагрева на структуру и свойства деформированного металла
- •5.1. Возврат и полигонизация
- •5.2. Рекристаллизация
- •5.3. Холодная и горячая деформации
- •6. Строение и свойства типовых двухкомпонентных сплавов
- •6.1. Понятие о физико-химическом анализе
- •6.2. Диаграмма состояния систем с полной растворимостью компонентов в твердом состоянии
- •6.3. Применение правила отрезков
- •6.5. Внутрикристаллическая ликвация
- •6.5. Диаграммы состояния систем с ограниченной растворимостью компонентов в твердом состоянии с эвтектическими и перитектическими превращениями
- •6.6. Понятие об эвтектоидном и перитектоидном превращениях.
- •6.7. Диаграммы состояния системы, образующей химическое соединение.
- •7. Железо и сплавы на его основе
- •7.1. Компоненты и фазы в системе железо-углерод
- •7.2. Диаграмма состояния железо-цементит (метастабильное равновесие)
- •7.3. Диаграмма состояния железо-графит
- •7.4. Углеродистые стали
- •8. Углеродистые стали
- •8.1. Влияние углерода на свойства стали
- •8.2. Влияние примесей на свойства стали
- •8.3. Классификация углеродистых сталей
- •8.4. Стали обыкновенного качества
- •8.5. Качественные углеродистые стали
- •9. Чугуны
- •9.1. Виды чугунов
- •9.2. Факторы, способствующие графитизации
- •9.3. Микроструктура и свойства чугуна
Письменные лекции
«Материаловедение. ТКМ»
Часть I
Козлов Г.С.
Содержание
стр.
Свойства и строение металлов 3
Кристаллизация металлов 13
Механические свойства металлов 17
Деформация и разрушение металлов 26
Влияние нагрева на структуру и свойства деформированного металла 36
Строение и свойства типовых двухкомпонентных сплавов 41
Железо и сплавы на его основе 49
Углеродистые стали 58
Чугуны 62
1. Свойства и строение металлов
Свойства металлов
Металловедение это наука, изучающая связь состава, строения и свойств металлов и сплавов в различных термодинамических условиях.
Основы научного металловедения были заложены великими русскими металлургами П. П. Аносовым (1799 – 1851) и Д. К. Черновым (1839 – 1921). П. П. Аносов впервые применил микроскоп для исследования структуры металлов, установил связь строения и свойств стали, разработал научные принципы получения стали высокого качества, раскрыл секрет производства булата. Д.К. Чернов, работавший в Петербурге на Обуховском заводе, открыл существование критических температур фазовых превращений в стали (критических точек) и их связь с содержанием углерода. Он заложил основы создания диаграммы сплавов железо – углерод, являющейся важнейшей в металловедении. Им была разработана теория кристаллизации металлов и термической обработки стали. По словам академика А.А. Байкова, значение Д.К. Чернова для металлургии соизмеримо со значением Менделеева Д. И. для химии.
Большое значение для развития металловедения имели труды Н.Н. Курнакова (1860 – 1941), разработавшего методы физико-химического анализа сплавов и построения диаграмм состояния, А.А. Байкова (1870 – 1946), предложившего физико-химическую интерпретацию металлургических процессов, С.С. Штейнберга (1872 – 1940) и Н.И. Минкевича (1883 – 1942), внесших существенный вклад в развитие теории и технологии термической обработки. Использование методов рентгеновского анализа для исследования металлов позволило немецким ученым М. Лауэ и П. Дебаю, а также У.Г. Брэггу и У.Л. Брэггу (Англия) установить их кристаллическое строение и изучить изменения структуры сплавов при разных способах обработки. Для развития современного металловедения важную роль сыграли работы Г.В. Курдюмова, В.Д. Садовского (СССР), Юм-Розери и Н. Мотта (Англия), Ф. Зейтца (США) и др.
Металлы делятся на две большие группы: железо и сплавы на основе железа (сталь, чугун) называют черными металлами, а остальные металлы (Al, Mg, Cu, Ni, V, Zn, Ti, W, Mo и др.) и их сплавы – цветными.
Помимо черных и цветных металлов и сплавов различают;
легкие металлы (Mg, Be, Al, Ti), обладающие малой плотностью;
легкоплавкие металлы (Zn, Sn, Pb) с температурой плавления соответственно 419,5; 232; 327 °С;
тугоплавкие металлы (W, Mo, Nb, Та) с температурой плавления выше, чем у железа;
благородные металлы (Ag, Au, Pt) с высокой устойчивостью против коррозии;
урановые металлы (актиниды), используемые для атомной техники;
редкоземельные металлы (РЗМ) – лантаноиды;
щелочноземельные металлы (Na, К, Zn) – в свободном состоянии почти не применяются (исключение – теплоносители в атомных реакторах)
76 элементов периодической системы Д. И. Менделеева из 106, известных в настоящее время, являются металлами. Такие элементы, как Si, Ge, As, Se, Те являются промежуточными между металлами и неметаллами.
Свойства металлов разнообразны. Ртуть не замерзает при температурах ниже 0°С, вольфрам выдерживает рабочие температуры выше 2000°С, литий легче воды, а осмий во много раз тяжелее. Вместе с тем металлы имеют характерные общие свойства. К ним относятся:
высокая пластичность;
высокая тепло- и электропроводность;
хорошая отражательная способность (металлы непрозрачны и имеют характерный металлический блеск);
термоэлектронная эмиссия, т. е. способность к испусканию электронов при нагреве; кристаллическое строение.
Общность первых четырех свойств металлов обусловлена особым типом межатомной связи, называемой металлической связью.
Известно, что атом состоит из положительного ядра и отрицательных частиц – электронов. Внешние (валентные) электроны металлов в отличие от неметаллов слабо связаны с ядром. Поэтому атомы металлов легко теряют валентные электроны, превращаясь в ионы, в освободившиеся электроны образуют так называемый электронный газ.
Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными атомами, а в одинаковой степени принадлежат всем ионам металла. Металл состоит из правильно расположенных в пространстве ионов и легко перемещающихся среди них обобщенных электронов.
Наличие металлической связи и легкоподвижных коллективизированных электронов объясняет характерные свойства металлов.
Благодаря ненаправленному характеру связи при пластической деформации, т. е. при смещении отдельных объемов металла, связь между ионами не нарушается и разрушения не происходит. Ионы как бы плавают в облаке электронного газа, что обусловливает высокую пластичность металлов.
Из рис. 1 видно, что при новом расположении ионов металла характер связи между ними сохраняется прежним.
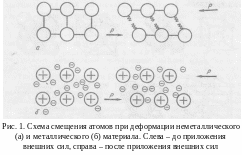
Наличие электронного газа объясняет высокую электро- и теплопроводность металлов. Под влиянием электрического поля свободные электроны имеют возможность ускоряться, что объясняет высокую электропроводность.
С увеличением температуры усиливаются колебания ионов и снижается электропроводность. Наоборот, при понижении температуры электропроводность растет и в ряде случаев может наблюдаться явление сверхпроводимости.
Высокая теплопроводность металлов объясняется участием свободных электронов, наряду с ионами, в передаче тепла.
Характерный металлический блеск обусловлен взаимодействием электромагнитных световых волн со свободными электронами,
