
- •И. И. Матвеенко, е. С. Лен
- •Часть I
- •Часть II
- •22. Основные термины и определения 81
- •Выбросы загрязняющих веществ в атмосферу
- •Характеристика приоритетных загрязнителей атмосферы
- •Загрязнение гидросферы
- •Методы и средства защиты водных объектов от загрязнения сточными водами
- •Физико-химические методы очистки сточных вод
- •Химические методы очистки сточных вод
- •Биохимические методы очистки сточных вод
- •Сооружения для искусственной биологической очистки
- •Характеристика приоритетных загрязнителей и охрана почв Пестициды и охрана почв
- •Загрязнение тяжелыми металлами и охрана почв
- •Отбор проб
- •Экологический паспорт промышленного предприятия
- •Физико-химические методы анализа, применяемые в экологическом мониторинге Абсорбционная спектроскопия
- •Основы хроматографии
- •Основные термины и определения
- •14 Июля 2003 г. № 949
- •Положение о порядке проведения в составе Национальной системы мониторинга окружающей среды в Республике Беларусь радиационного мониторинга и использования его данных
Физико-химические методы анализа, применяемые в экологическом мониторинге Абсорбционная спектроскопия
Методы анализа, основанные на измерении уменьшения интенсивности (или мощности) потока электромагнитного излучения составляют группу абсорбционных спектроскопических методов.
Поглощая электромагнитные излучения, молекулы и атомы вещества переходят в энергетически возбужденное состояние. Поглощенная атомами или молекулами избыточная энергия расходуется на повышение их колебательной, вращательной или поступательной энергии, в некоторых случаях выделяется вторичное излучение или проходят фотохимические процессы.
В спектрофотометрии и колориметрии используют избирательное поглощение молекулами вещества, полученного в результате предварительно проведенной химической реакции с определяемым компонентом (иногда без предварительного проведения реакции, например при определении веществ по собственному поглощению). Молекулы поглощающего вещества при поглощении энергии переходят из основного в возбужденное состояние, т.е. из состояния с минимальной энергией Е0 в состояние с большей энергией Е1. В возбужденном состоянии молекулы или атомы, как правило, находятся, находятся короткое время (10-9 – 10-8с); затем электроны самопроизвольно (спонтанно) переходят на более низкий энергетический уровень или на уровень основного состояния. Этот процесс сопровождается выделением энергии в виде тепла или электромагнитного излучения, или одновременно того и другого. Вызванные поглощением определенных квантов электромагнитного излучения электронные переходы характеризуются строго определенными полосами поглощения в электронных спектрах поглощающих молекул. Поглощение квантов электромагнитного колебания происходит только в том случае, если энергия поглощаемого кванта совпадает с разностью энергий ΔЕ между квантованными энергетическими уровнями в возбужденном Е1 и основном Е0 состояниях поглощающей молекулы:
ΔЕ = Е1-Е0 = hν,
где h- постоянная Планка, равная 6,625·10-34 Дж·с; ν - частота поглощаемого излучения, (с-1), герцах (Гц).
В зависимости от типа поглощаемого излучения и способа преобразования избыточной энергии веществом различают следующие абсорбционные методы анализа:
Молекулярный абсорбционный анализ основан на поглощении электромагнитных излучений молекулами или сложными ионами в ультрафиолетовой, видимой или инфракрасной областях спектра. К этой группе методов относят спектрофотометрию, колориметрию и ИК-спектроскопию.
Нефелометрический и турбидиметрический методы анализа основаны на измерении рассеянного или поглощенного света взвешенными частицами анализируемого вещества.
Люминесцентный (флуориметрический) анализ основан на измерении излучения (интенсивности или суммы света), возникающего в результате выделения избыточной энергии возбужденными молекулами анализируемого вещества.
Атомно-абсорбционный анализ основан на поглощении световой энергии атомами определяемого вещества.
Между этими методами имеются различия, однако их часто объединяют в одну группу спектроскопических или спектрохимических методов анализа.
В фотометрическом анализе применяют вещества практически всех известных классов. Основные требования анализа – это достаточная интенсивность окраски, обеспечивающая надежное определение микрокомпонентов, т.е. низкий предел обнаружения вещества и контрастность реакции. Последнее свойство определяется разностью положения полос поглощения исходных веществ и продуктов реакции.
Для количественного определения вещества фотометрическим методом после переведения определяемого компонента в соединение, поглощающее электромагнитные излучения, необходимо определить ослабление мощности (интенсивности) потока излучения при прохождении его через поглощающую среду определенной толщины, т.е. необходимо количественно определить абсорбцию электромагнитного излучения полученным раствором (газом или твердыми прозрачными веществами).
Проходя через прозрачный слой газа, жидкости или твердого тела часть электромагнитного излучения будет селективно поглощаться. Интенсивность электромагнитного излучения при этом уменьшается. При прохождении монохроматического пучка электромагнитного излучения через слой прозрачного вещества, помещенного в кювету, часть этого излучения поглощается веществом, небольшая часть излучения отражается, а часть проходит через раствор. Обозначим интенсивность падающего излучения І0, прошедшего через раствор – І, поглощенного раствором – Iп, и отраженного через Iот, тогда интенсивность падающего излучения равна сумме составляющих: І0 = І + Iп + Iот. Интенсивность отраженного излучения достаточно мала по сравнению с интенсивностью излучения, поглощенного веществом и прошедшего через раствор. Кроме того, в фотометрическом анализе сравнивают интенсивности излучения, прошедшего через исследуемый раствор и растворитель (или раствор сравнения), в которых интенсивности отраженного излучения будут равны. Поэтому интенсивностью отраженного излучения можно пренебречь.
Разделим длину твердого тела, раствора или газа, через которые проходит излучение на l единиц. Когда излучение пройдет через первый участок поглощающего вещества, его интенсивность ослабится в n раз и в конце первого участка будет равна
І1=І0/n, (1)
где n – число, большее единицы, которое характеризует поглощение данного вещества.
Конец первого участка является в то же время началом второго. Во второй участок раствора попадает таким образом потом света с интенсивностью І1. При прохождении через второй участок снова произойдет ослабление излучения в такой же степени, т.е. в п раз. Таким образом, в конце второго участка интенсивность потока излучения равна
І2=І1/п, (2)
Из уравнения (1), получим
І2=І1/п=Іо/п2. (3)
После прохождения третьего участка интенсивность излучения
І3=І2/п=Іо/п3 и т.д.
Таким образом, когда поток излучения пройдет через всю толщу l (т.е. согласно условию через l участков), интенсивность выходящего потока равна
І=Іо/пl (4)
Интенсивность поглощения раствора может быть охарактеризована отношением Іо/І: чем больше поглощает раствор, тем меньше І по сравнению с Іо и тем больше отношение Іо/І. Это отношение (ослабление излучения) зависит от толщины слоя раствора; согласно уравнению (4) эту зависимость можно выразить уравнением
Іо/І=пl (5)
Или логарифмируя lgІо/І=llgп. (6)
Величину lg (Іо/І) называют оптической плотностью А раствора (газа или твердого тела):
А= lg Іо/І. (7)
Это же выражение называют также поглощением или экстинкцией раствора. Величина п в уравнениях (1) - (6) зависит от свойств поглощающего свет вещества и для каждого данного вещества остается постоянной. Обозначим постоянную величину lgп через ε, тогда можно записать
А=εl=lgІо/І. (8)
Ослабление интенсивности светового потока при прохождении через раствор, газ или твердое тело, зависит от количества поглощающих свет центров, встречающихся на пути потока излучения.
Рассмотрим поглощение излучения раствором соединения при условии, что с изменением концентрации состав и структура этого соединения не меняются. Поместим немного раствора в цилиндр и будем наблюдать поглощение излучения сверху в полном слое. Если согласно условию при разбавлении раствора общее количество поглощающих свет центров остается постоянным, общее светопоглощение также не изменится. При разбавлении в п раз концентрация раствора уменьшится в п раз, а толщина слоя во столько же раз соответственно увеличится, поэтому общее поглощение излучения не изменится. Следовательно, можно написать
А =εСl. (9)
Таким образом, выражение оптической плотности А будет иметь вид:
А=lgІо/І = εСl. (10)
Эту зависимость называют законом Бугера. Закон Бугера справедлив для всех областей электромагнитных излучений от рентгеновского излучения до радиоволн. Если раствор, концентрация которого равна С1, при толщине слоя l1 имеет такое же поглощение излучения при определенной длине волны, как и раствор того же вещества при большей толщине слоя l2, то очевидно во втором растворе концентрация вещества С2 меньше, чем в первом растворе:
А=εС1 l1 = εС2 l2... (11) С1 l1 = С2 l2 ...(12)
Если в уравнении (10) концентрация С выражена в молях поглощающего излучение соединения на 1 л, а толщина слоя l– в сантиметрах, то ε выражает молярный коэффициент светопоглощения. Как видно из уравнения (10), молярный коэффициент поглощения численно равен оптической плотности 1 М раствора при толщине слоя 1 см.
Молярный коэффициент поглощения ε характеризует внутренние свойства вещества и не зависит от объема раствора, толщины слоя и интенсивности освещения. Поэтому величина ε является наиболее важной, общепризнанной и объективной характеристикой возможной чувствительности фотометрического определения. Значения ε в области максимума для различных поглощающих свет соединений сильно различаются. Так, полосы поглощения «простых» ионов (аква-комплексов) меди, никеля и других в видимой части спектра характеризуются низкими значениями ε порядка 10 -100. Окрашенные аммиакаты, пероксидные и другие однороднолигандные комплексы имеют значения ε ≈ 102-103. Многие комплексы с органическими реактивами (ализаринаты, дитизонаты и т.п.) имеют очень высокие значения ε – порядка 104 и 105.
Закон Бугера выведен для монохроматического излучения. Если же при измерении оптической плотности пользуются светофильтром с достаточно широкой областью пропускания света, то наблюдается отклонение от прямой пропорциональности между оптической плотностью и концентрацией вещества. Кроме того, закон Бугера справедлив только в том случае, если с изменением концентрации вещества оно не претерпевает никаких химических изменений: не происходит ассоциация молекул при высокой концентрации вещества, а также вещество не диссоциирует на ионы.
Таким образом, причины отклонения от закона Бугера могут быть физическими и химическими.
Закон Бугера справедлив для разбавленных растворов, для концентраций веществ меньше 0,01 М. При больших концентрациях частицы, поглощающие свет, настолько близко расположены друг к другу, что каждая частица влияет на распределение заряда соседних частиц, что приводит к изменению способности частиц поглощать свет данной длины волны. В этом случае наблюдается отклонение от прямолинейной зависимости поглощение – концентрация.
Погрешности измерения могут возникать также из-за того, что при прохождении через границу воздух – стекло около 4% светового потока отражается. Эта погрешность сводится к минимуму, если сравнивают световые потоки, проходящие через исследуемый и холостой растворы.
Тогда
А ≈ lg Іхол/Ір ≈ lg Іо/І (13)
Поэтому, если Іо считать интенсивностью светового потока, прошедшего через кювету с холостым раствором, погрешность, связанная с отражением света при прохождении через систему воздух – стекло и стекло – воздух будет сведена к допустимому минимуму.
Значительное отклонение от закона Бугера связано с немонохроматичностью светового потока вещества. Лучшие результаты получают на спектрофотометрах, т.е. при измерении оптической плотности при монохроматическом свете.
Пламенная фотометрия
Пламенная фотометрия — раздел атомно-эмиссионного спектрального анализа. Основой метода является возбуждение в пламени спектра определяемого элемента и непосредственное измерение интенсивности свечения аналитической линии.
Анализируемый раствор с помощью распылителя переводят в аэрозоль и подают в пламя горелки. Под действием высокой температуры испаряется растворитель, удаляется кристаллизационная вода, испаряются твердые остатки, молекулы которых распадаются на атомы и, возбуждаясь, испускают спектр.
Термическая энергия высокотемпературного пламени значительно ниже энергии дуги или искры. Поэтому в пламени возбуждаются только наиболее чувствительные спектральные линии с низкими потенциалами возбуждения. Число элементов, определяемых этим методом, значительно меньше, чем при возбуждении электрическими источниками света. В пламенном фотометре любого типа различают три основные части: системы возбуждения и выделения аналитической спектральной линии и систему регистрации интенсивности излучения линии.
Система возбуждения спектральных линий состоит из распылителя и распылительной камеры, смесителя-отстойника, горелки и пламени. Топливом для горелки служат горючие газы, приведенные в табл. 1 и газ-окислитель — баллонный кислород или сжатый воздух от компрессора.
Система выделения спектральной линии состоит из светофильтров или спектральных приборов — монохроматоров. Светофильтр должен быть выбран таким образом, чтобы максимум его пропускания совпадал с длиной волны спектральной линии или молекулярной полосы определяемого элемента. Для разделения нескольких близко расположенных спектральных линий удобнее применять монохроматоры или полихроматоры — спектральные приборы, у которых на выходе установлены щели, которые позволяют выделить необходимые линии (пламенные спектрофотометры).
Регистрирующая система объединяет все средства обнаружения и регистрации интенсивности излучения спектральной линии. В нее входят фотоэлементы или фотоэлектроумножители, усилительные и регистрирующие приборы.
На рис. 1 приведена принципиальная схема пламенного спектрофотометра.
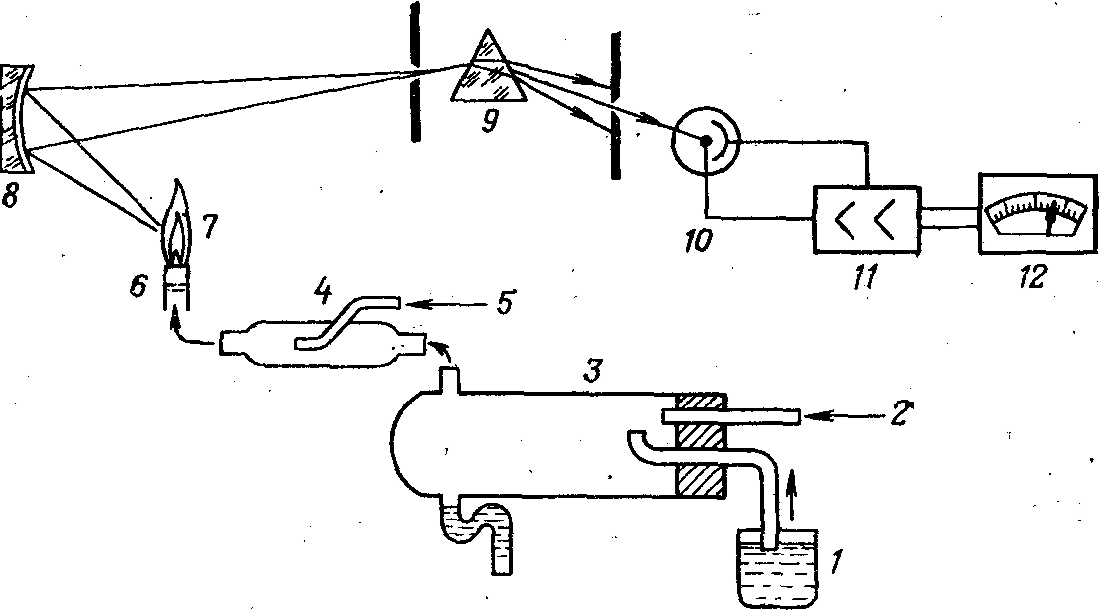
Рис. 1. Принципиальная схема пламенного фотометра: 1 — анализируемый раствор; 2—подача газа-окислителя (воздух, воздух, обогащенный кислородом); 3—распылитель; 4 — отстойник-смеситель; 5—подача газа-топлива; 6—горелка; 7—пламя; 8 — зеркало-конденсор; 9—монохроматор (светофильтр, прибор); 10—фотоэлемент, фотоумножитель; II, 12—усилитель и отсчетно-регистрирующее устройство
Одной из основных частей пламенного фотометра или спектрофотометра являются распылители и горелки. В пламенной фотометрии применяют горелки двух типов: нераспыляющие (ламинарные) и распыляющие (турбулентные). Нераспыляющие горелки имеют внешнюю распылительную систему. Образуемые в ней аэрозоли вместе с газом-окислителем подаются в конденсационную камеру— смеситель, где смешиваются с горючим газом и затем попадают в пламя горелки. В комбинированных горелках-распылителях окислителя применяют кислород. Для стабилизации режима горения таких горелок необходимо увеличивать скорость истечения газов из сопла горелки, что делает поток газов турбулентным. В горелках такого типа анализируемый раствор втягивается газом-окислителем в капилляр и затем распыляется в реакционную зону пламени. Существенной частью нераспыляющих горелок являются их наконечники с тонкой защитной сеткой или щелевые, обеспечивающие равномерное горение пламени без проскока его в корпус горелки.
Основными факторами, определяющими свойства и температуру пламени, являются, состав горючей смеси, состоящей из газа-топлива и газа-окислителя, количество и состав вводимого в пламя анализируемого раствора, закономерности процесса генерации аэрозоля и испарения капель, формирующие действие сопла горелки на поток аэрозоля. В ламинарном пламени нераспыляющей горелки различают три основные зоны: внутренний и внешний конусы и тонкую высокотемпературную зону. Поверхность внутреннего конуса пламени определяется положением фронта горения газовой смеси. Для стабилизации пламени в пространстве необходимо, чтобы скорость истечения потока газов из сопла горелки и скорость распространения фронта горения газовой смеси были примерно одинаковыми. Скорость распространения фронта горения для обычно применяемых в пламенной фотометрии смесей горючих газов с воздухом составляет 0,2—0,4 м/с, а с кислородом — на порядок выше. Поэтому для обеспечения стабильного режима горения необходимо выбирать и соответствующую скорость истечения горючей смеси из сопла горелки.
Условия устойчивости горения пламени изображают в виде диаграммы зависимости скорости истечения потока газа из сопла горелки от концентрации горючего газа в смеси (рис. 2).

Концентрация горючего газа
Рис. 2. Диаграмма зон устойчивости горения ламинарного пламени:
1 — оторвавшееся пламя; 2 — нестабильное положение пламени; 3 — зона устойчивого горения; 4 — проскок пламени; 5 — нет пламени
Показанная на диаграмме зона 3 устойчивого горения соответствует допустимому соотношению скоростей горения и истечения потоков газов. Если же скорость истечения превысит некоторую критическую, то фронт горения может удалиться от краев сопла. Тогда произойдет «отрыв» (зона 1), и пламя погаснет. При недостаточной скорости истечения происходит проскок пламени внутрь горелки (зона 4), что может вызвать повреждение всей системы.
Таблица 1. Температура пламен, используемых в методе пламенной фотометрии
-
Горючий газ
Температура, °С
воздух
кислород
Ацетилен
2100—2530
3000—3500
Бутан
1300—1900
2900
Метан
1955—2150
2720-3010
Пропан
1900-2190
2800—3070
Число элементов, определяемых методом пламенной фотометрии, зависит главным образом от температуры пламени, способов выделения аналитической линии и регистрации ее интенсивности. В таблице 2 приведены примеры окрашивания пламени солями некоторых элементов. Применение пламенных спектрофотометров дает возможность определять более семидесяти элементов. Однако, обычно этим методом определяют щелочные и щелочноземельные элементы, имеющие потенциал возбуждения не более 5 эВ. Практически невозможно определить этим методом неметаллы.
Таб. 2. Окрашивание пламени солями некоторых элементов
Элемент |
Цвет пламени |
Литий |
Карминово-красный |
Натрий |
Ярко-желтый |
Калий |
Фиолетовый |
Кальций |
Кирпично-красный |
Стронций |
Карминово-красный |
Барий |
Желто-зеленый |
Медь |
Ярко-зеленый |
Бор |
Ярко-зеленый |
Свинец |
Бледно-голубой |
Мышьяк |
Бледно-голубой |
Спектральные свойства элементов характеризуются их спектром, испускаемым в пламени. Многие элементы испускают в пламени спектр с хорошо выраженными линиями нейтральных атомов (щелочные, щелочноземельные элементы, элементы IБ, ПБ и ШБ групп и др.). Ряд элементов в пламени испускают молекулярные полосы оксидов (элементы групп ША, IVА, VА, VIА, VПА РЗЭ) или же сплошной спектр (Ti, Мо, U, Zn).
Чувствительность пламенно-фотометрических определений зависит от чувствительности используемых в анализе спектральных линий, их интенсивности, температуры пламени, конструкции прибора и системы регистрации излучения.
Атомно-абсорбционный спектральный анализ
Атомно-абсорбционный спектральный анализ — это метод определения концентрации по поглощению слоем паров элемента монохроматического света, длина волны которого соответствует центру линии поглощения. Анализ проводят по наиболее чувствительным в поглощении спектральным линиям, которые соответствуют переходам из основного состояния в более высокое энергетическое состояние. В большинстве случаев эти линии являются также и наиболее чувствительными и в эмиссионном анализе. Если молекулы вещества поглощают свет полосами в широких интервалах волн, то поглощение парами атомов происходит в узких пределах, порядка тысячных долей нанометра (центр линии).
Атомное поглощение, как и молекулярное, характеризуется экспоненциальным законом убывания интенсивности проходящего света в зависимости от длины поглощающего слоя, аналогичным закону Бугера:
А =lgI0/I =kνCb
где А—оптическая плотность поглощения; I0, I — интенсивности падающего и прошедшего света; kν — коэффициент поглощения, зависящий от частоты света; С — концентрация поглощающих атомов; b — толщина поглощающего слоя.
В атомно-абсорбционном анализе анализируемое вещество под действием тепловой энергии разлагается на атомы. Этот процесс называют атомизацией, т. е. переведением вещества в парообразное состояние, при котором определяемые элементы находятся в виде свободных атомов, способных к поглощению света. Излучение и поглощение света под воздействием внешней энергии связаны с процессами перехода атомов из одного стационарного состояния (i, Еi) в другое (k, Еk). Возбуждаясь, атомы переходят в стационарное состояние k с энергией Еk и затем, возвращаясь в исходное основное (невозбужденное) состояние i с энергией Еi, испускают свет с частотой νki.. Излучательные переходы осуществляются спонтанно без какого-либо внешнего воздействия. Повышение температуры излучающего облака в значительной степени сказывается на увеличении в нем концентрации возбужденных атомов, на интенсивности спектральных линий и, следовательно, на чувствительности атомно-эмиссионного спектрального анализа.

Рис. 3. Принципиальная схема атомно-абсорбционного спектрофотометра:
1 — источник света; 2— пламя; 3 — 5 — монохроматор; 6—8 — блок усиления и регистрации
Наряду с излучательными переходами в пламени возможны и переходы из стационарного состояния i в стационарное состояние k, происходящие вынужденно в результате поглощения внешнего излучения с частотой νki.
В отличие от атомного излучения атомное поглощение определяется заселенностью нижнего уровня. Поэтому тепловая энергия должна быть использована только для атомизации анализируемых веществ. Увеличение же числа атомов в возбужденном состоянии за счет атомов, находящихся в основном состоянии, приводит к уменьшению чувствительности определения атомно-абсорбционным методом.
В качестве источника света в атомно-абсорбционном анализе используют стабилизированные излучатели, лампы полого катода или высокочастотные шариковые лампы, испускающие дуговой или искровой спектр определяемого элемента. Такой источник света должен давать узкие и яркие спектральные линии определяемых элементов со стабильной интенсивностью. Для выделения спектральных линий применяют монохроматоры с фотоэлектрическими приемниками света.
Атомное поглощение было известно еще в начале 19 столетия, однако для аналитических целей его начали применять в 1955 г., когда физик Уолш предложил схему прибора. Она состоит из источника света 1, пламени, монохроматоров 3—5 и блока усиления и регистрации (рис. 3). Свет от лампы полого катода, излучающей дуговой спектр определяемого металла, проходит через пламя горелки и разлагается монохроматором в спектр. Монохроматор выделяет необходимую аналитическую линию, интенсивность свечения которой регистрируется фотоэлектрическим приемником. При отсутствии в пламени поглощающих атомов показание регистрирующего прибора должно быть максимальным. Анализируемый раствор с помощью распылителя переводится в аэрозоль и подается в пламя горелки. Под действием высокой температуры растворитель испаряется, а находящиеся в растворе соли распадаются на атомы, способные поглощать. С повышением содержания определяемого элемента в анализируемом растворе увеличивается количество поглощающих атомов в пламени. Анализ проводят по градуировочному графику, построенному в системе координат атомное поглощение (аналитический сигнал)—концентрация элемента в анализируемом растворе.
Источники света. Основными требованиями к источникам света в атомно-абсорбционном анализе являются большая яркость и стабильность свечения резонансных линий, простота и безопасность работы с ними.
Лампы полого катода представляют собой стеклянный цилиндрический баллон диаметром 3— 5 см с выходным окном, которое изготовлено из кварца или стекла. Катод лампы изготовлен из металла в виде цилиндра или стакана и укрепляется на стержне, впаянном в баллон. Анодом служит металлический стержень. Лампы заполнены инертным газом (аргоном или неоном) до давления 0,2—2 МПа.
Атомизация анализируемых веществ — получение поглощающих слоев — происходит в несколько стадий: испарение пробы, термическая диссоциация молекул, получение паров атомов и их локализация. Способы атомизации разделяют на пламенные и непламенные. Пламена наиболее часто применяют как в пламенной фотометрии, так и в атомно-абсорбционном анализе.
В атомно-абсорбционном анализе для повышения чувствительности определения увеличивают длину поглощающего слоя. Это достигается путем применения специальных щелевых горелок, трубок-адаптеров, в которые направляется поток отходящих газов пламени или зеркальных систем для многократного прохождения луча через пламя.
В основе электротермических атомизаторов (ЭТА) — миниатюрные графитовые трубки, нагреваемые в атмосфере инертного газа мощной электрической дугой (печь Кинга, графитовая кювета Львова) или электрическим током, пропускаемым через ее стенки (печи Кинга и Массмана), для испарения проб, подаваемых в виде раствора (рис. 4). Разработаны различные варианты ЭТА с использованием графитовых, вольфрамовых, платиновых нитей или петель, стержней, лент, нагреваемых электрическим током. Во всех этих конструкциях анализируемый раствор с помощью пипетки-дозатора (10—100 мкл) вводят в графитовую трубку через отверстие в середине ее боковой стенки, либо наносят на поверхность нити или ленты.
Вынос испаряющихся
веществ из трубки Ввод пробы
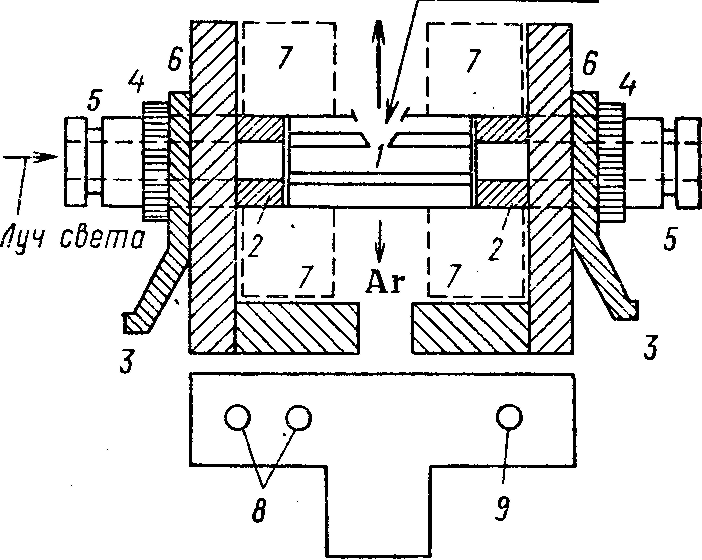
Рис. 4. Электротермический атомизатор (ЭТА):
/ — графитовая трубка, кювета 2 — графитовые шайбы для контакта: 3—контакт для кабеля от блока питания; 4 — гайки; 5—патрубки, снабженные кварцевыми окнами; 6—стойки; 7 — цилиндры, охлаждаемые водой; 8 — штуцеры для подвода и слива воды; 9 —штуцер для подачи аргона.
В промышленных конструкциях ЭТА имеется специальный блок питания, позволяющий по заранее заданной программе, в зависимости от методики, регулировать время и температуру нагрева трубки. На первой стадии печь нагревается до температуры, при которой удаляются растворитель и кристаллизационная вода (100—120°С). Во второй стадии температура повышается настолько, чтобы можно было разрушить соли металлов с неорганическими или органическими анионами. На третьей стадии температура резко повышается. При этом образуемые на предыдущем этапе оксиды восстанавливаются до свободного металла, который переходит в парообразное состояние (процесс атомизации). Четвертая высокотемпературная стадия предназначена для очистки печи от остатков пробы путем выноса их инертным газом. После этого прибор готов для анализа новой порции анализируемого раствора. Для предотвращения разрушения графитовых трубок при их нагреве и дли ускорения выноса паров анализируемого материала через внутренние и внешние стенки трубки пропускают инертный газ. На стадии атомизации, когда необходимо повысить концентрацию свободных атомов, предусмотрена возможность автоматического отключения потока инертного газа.
В атомно-абсорбционном анализе применяют одно-, двух- и многоканальные спектрометры. Для увеличения стабильности работы и уменьшения влияния источников погрешностей измерения на результаты анализа применяют луч сравнения, которым может быть немонохроматический свет от лампы полого катода или какая-нибудь нерезонансная спектральная линия. Чаще используют для этих целей резонансную линию, которую выделяют с помощью осветительной системы (рис. 5). Свет лампы полого катода 1 попадает на светоделитель 2, который разделяет его на два потока одинаковой интенсивности. Один из них проходит через слой атомизированных ионов в ячейке 4. С помощью системы зеркал оба потока могут быть сфокусированы на щель 6 прибора. Модулятор — вращающееся секторное зеркало 5 — попеременно направляет свет двух потоков в монохроматор, с помощью дискриминатора для разделения сигналов радиотехническим способом и фотоумножителя измеряют их интенсивности. Для повышения чувствительности определения и уменьшения влияния фона используют дейтериевую лампу 7.

Рис. 5. Оптическая схема осветительной системы двухканального атомно-абсорбционного спектрофотометра:
/—лампа полого катода; 2 — светоделительный элемент; 3 — плоские зеркала; 4—поглощающая ячейка; 5 — вращающееся секторное зеркало; 6—щель спектрофотометра; 7—дейтериевая лампа
Атомно-абсорбционный метод в настоящее время является одним из наиболее распространенных методов анализа. В этом методе, как и в атомно-эмиссионном, нет необходимости проводить групповое разделение элементов. Предварительная подготовка проб сводится к их переведению в раствор и отделению нерастворимых компонентов, например SiО2. Дальнейшая аналитическая операция сводится к подаче анализируемого раствора в распылитель и последующему измерению сигнала. С помощью таких универсальных приемов этим методом можно определять более 60 элементов с довольно низким пределом обнаружения.
Кондуктометрия. Кондуктометрическое титрование
Кондуктометрия основана на измерении электрической проводимости растворов. Если в раствор вещества поместить два электрода (платиновых или других инертных) и подать на электроды разность потенциалов, то через раствор потечет электрический ток. Как и каждый проводник электричества, растворы характеризуются сопротивлением R и обратной ему величиной – электрической проводимостью L (см− ). Сопротивление раствора R (Ом) прямо пропорционально расстоянию между электродами l, удельному сопротивлению раствора ρ и обратно пропорционально площади электродов S:
![]() ,
,
![]() (1)
(1)
Удельное сопротивление ρ является характеристикой раствора как проводника и представляет собой сопротивление раствора при l и S, равных единице. Величина, обратная удельному сопротивлению, называется удельной электрической проводимостью χ:
χ
![]() (2)
(2)
Растворы индивидуальных веществ характеризуются эквивалентной электрической проводимостью λ, представляющей собой электрическую проводимость объема раствора, содержащего 1 моль вещества:
![]() ,
(3)
,
(3)
где С – концентрация вещества, моль/дм3.
Эквивалентная электрическая проводимость раствора зависит от количества ионов и их подвижности. Количество ионов определяется степенью ионизации молекул веществ α. Подвижность ионов U представляет собой расстояние, проходимое ионами в 1с при градиенте потенциалов 1 В/см. Электрическая проводимость 1 моля вещества в растворе складывается из суммы подвижностей положительных U+ и отрицательных U- ионов, умноженной на количество электричества, соответствующее 1 молю и равное постоянной Фарадея F, и на степень ионизации вещества:
λ = α·F(U+ + U−) = α·(FU+ + FU−) (4)
Характеристикой веществ является предельная эквивалентная электрическая проводимость Λ, наблюдаемая при бесконечно большом разбавлении раствора (при α = 1) и связанная с эквивалентной λ коэффициентом f:
Λ = FU+ + FU− = Λ+ + Λ−; λ = fΛ = f(Λ+ + Λ−) (5)
Электрическая проводимость раствора при кондуктометрических измерениях определяется его концентрацией С, подвижностью ионов U и постоянной (константой) ячейки К, учитывающей размер электродов, расстояние между ними, объем раствора в ячейке, ее форму и т.д.:
L = KCU (6)
Зависимость (6) лежит в основе кондуктометрического анализа.
Кондуктометрический анализ проводят с помощью кондуктометров – приборов, измеряющих сопротивление растворов. По величине сопротивления R определяют обратную ему по величине электрическую проводимость растворов L.
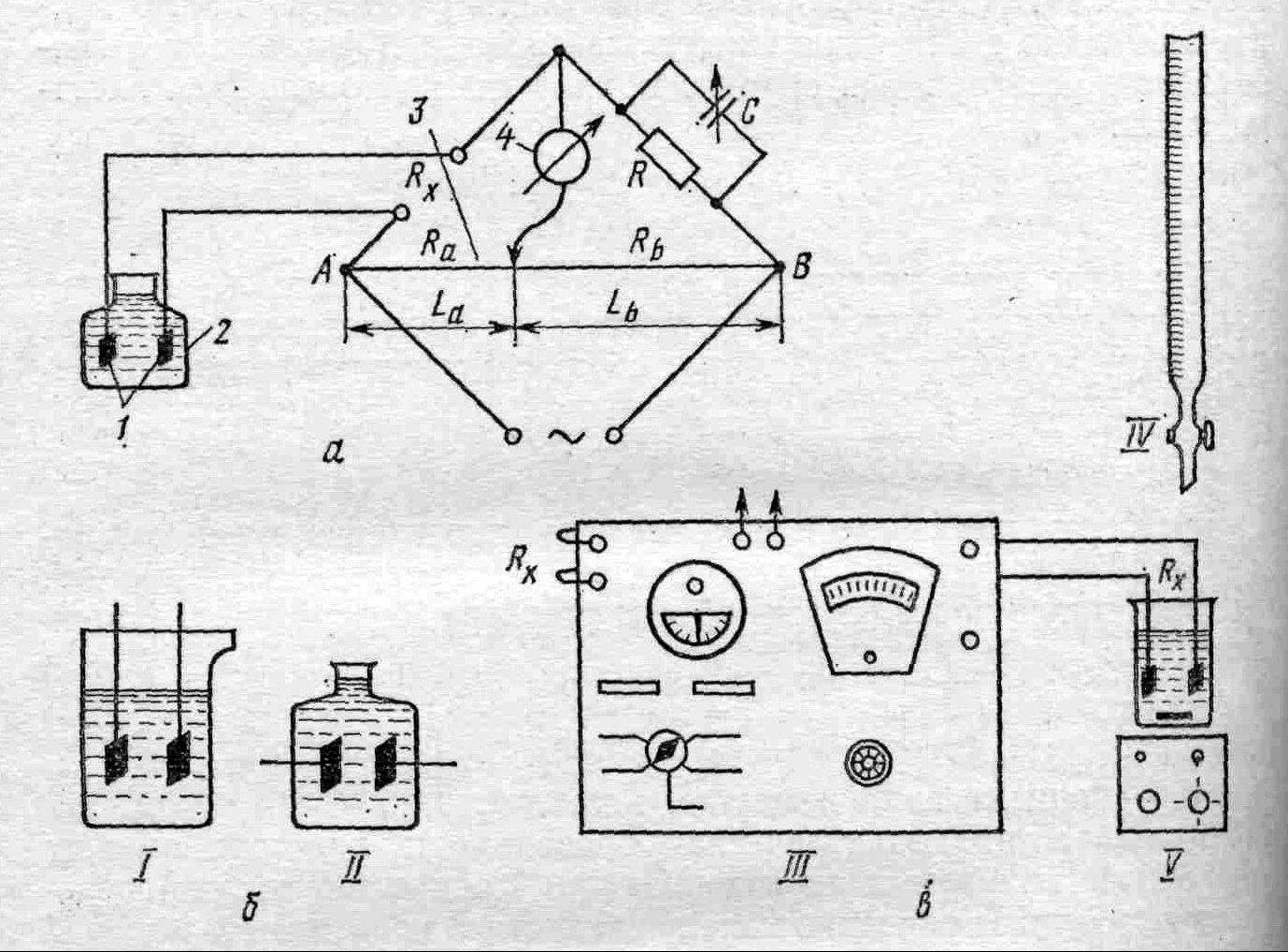
Рис. 1. Принципы кондуктометрических измерений:
а – схема кондуктометра; б – схема ячеек; в – установка для кондуктометрического титрования; I – обычная ячейка; II – ячейка с уменьшенным объемом; III – кондуктометр; IV – бюретка; V – мешалка
Кондуктометры построены по мостовой схеме. Ячейка с раствором 2, куда опущены электроды 1, включена в плечо электрического моста (рис.1, а), состоящего из реохорда 3 – переменного сопротивления R, помещенных в плечи моста, и измерительного нуль-прибора 4, включенного в диагональ моста. В качестве измерительного нуль-прибора используют чувствительные стрелочные микроамперметры, осциллографы, электронные индикаторы с индикаторной лампой, наушники (при применении переменного тока звуковой частоты). К точкам А и В моста подключают переменный электрический ток звуковой или другой частоты и, передвигая движок реохорда, ищут точку, в которой измерительный нуль-прибор покажет исчезновение сигнала. В этот момент сопротивление плеча реохорда Rx так относится к постоянному сопротивлению R, как сопротивление плеча реохорда Rа относится к сопротивлению плеча Rb:
Rx/R = Ra/Rb, отсюда Rx = RRa/Rb.
Отношение Ra/Rb равно отношению длин плеч реохорда La/Lb. Определив Rх, легко рассчитать электрическую проводимость раствора.
Питание измерительного моста осуществляют переменным током низкой частоты для предупреждения электрохимической реакции и образования на электроде двойного электрического слоя (быстрая смена заряда электрода). В кондуктометрических измерениях определенное значение имеет подбор ячейки. Ячейка для кондуктометического анализа представляет собой стеклянный сосуд, в который впаяны платиновые электроды, покрытые платиновой чернью (рис.1, б). При изменении формы ячейки, объема раствора электрическая проводимость ячейки меняется вследствие того, что электрический ток проходит по всему объему раствора, а не только через его часть, находящуюся между электродами. Для учета влияния ячейки в расчетные формулы вводят константу ячейки К, определяемую экспериментально путем измерения в данной ячейке электрической проводимости 0,1 и 0,01 н КCl, для которых известно стандартное значение удельной электрической проводимости (χ0.1н = 128,96 См; χ0.01н = 141,27 См). Частное от деления стандартного значения χст на экспериментально полученное χя дает величину коэффициента К. С учетом константы ячейки формула для удельной электрической проводимости принимает вид
χ = К/R = KL; K = χст / χя = χстRя,
где Rя – сопротивление 0,1или 0, 01 н КCl, залитого в ячейку; χя - электрическая проводимость этого раствора; χст - стандартное значение удельной электрической проводимости 0,1 или 0, 01 н КCl.
Определение концентрации растворов осуществляют прямой кондуктометрией и кондуктометрическим титрованием. Прямая кондуктометрия используется для определения концентрации раствора по калибровочному графику. Для составления калибровочного графика замеряют электрическую проводимость (или сопротивление) серии растворов с известной концентрацией и строят калибровочный график зависимости электрической проводимости от концентрации. Затем измеряют электрическую проводимость анализируемого раствора и по графику определяют его концентрацию. На электрическую проводимость растворов влияет температура, поэтому определение целесообразно вести в термостатированных ячейках.
Кондуктометрическое титрование. При кондуктометрическом титровании в ячейку с электродами помещают анализируемый раствор, ячейку помещают на магнитную мешалку и титруют соответствующим титрантом. Титрант добавляют равными порциями.

Рис. 2. Кривые кондуктометрического титрования
После добавления каждой порции титранта замеряют электрическую проводимость раствора и строят график зависимости между электрической проводимостью и объемом титранта (рис.2). При добавлении титранта происходят изменения электрической проводимости раствора. В точке эквивалентности наступает перегиб кривой титрования.
Различные ионы в растворах имеют отличающиеся друг от друга подвижности. Наиболее высокой подвижностью обладают H+ (319,8) и OH− (198,3). Это объясняется способностью этих ионов двигаться при наложении разности потенциалов, переходя от одной молекулы воды к другой. Остальные ионы двигаются в растворе вместе с сольватной оболочкой, в связи с чем их скорость движения замедлена и подвижность снижена. От подвижности ионов зависит электрическая проводимость раствора: чем выше подвижность ионов, тем больше электрическая проводимость раствора.
Характер кривых кондуктометрического титрования различен в зависимости от величины подвижности ионов определяемого вещества и титрования.
Титруемое вещество и титрант имеют ионы с высокой подвижностью. При титровании, например, НCl раствором NaOH (рис.2, а) в растворе сначала присутствуют Н+-ионы, имеющие высокую подвижность, по мере титрования их концентрация уменьшается и электрическая проводимость раствора падает. В точке эквивалентности электрическая проводимость раствора минимальна. При добавлении избытка NaOH в растворе появляются свободные OH--ионы, имеющие высокую подвижность, и электрическая проводимость раствора снова возрастает. Восходящий участок кривой титрования имеет меньший угол наклона вследствие более низкой подвижности ионов OH−.
Титруемое
вещество и титрант имеют ионы с низкой
подвижностью. Например, при титровании
Na2SO4
раствором BaCl2
электрическая проводимость раствора
до точки эквивалентности практически
неизменна (рис.2, б), так как малоподвижные
![]() -
ионы связываются в сульфат бария и
заменяются Cl−-ионами
с близкой подвижностью, количество Na+
остается неизменным. После точки
эквивалентности вследствие появления
избытка Ba2+- и
Cl−-ионов электрическая
проводимость раствора возрастает.
-
ионы связываются в сульфат бария и
заменяются Cl−-ионами
с близкой подвижностью, количество Na+
остается неизменным. После точки
эквивалентности вследствие появления
избытка Ba2+- и
Cl−-ионов электрическая
проводимость раствора возрастает.
Титруемое вещество имеет ионы с высокой подвижностью, титрант – с низкой. В этом случае до точки эквивалентности электрическая проводимость раствора снижается, после точки эквивалентности – изменяется незначительно (рис.2, в). Примером здесь может служить титрование HCl раствором NaHCO3.
Титруемое вещество имеет ионы с низкой подвижностью, титрант - с высокой. Например, при титровании CaCl2 раствором NaOH электрическая проводимость раствора сначала несколько уменьшается вследствие замены ионов Ca2+, связываемых в осадок Ca(OH)2, на Na+, затем возрастает при появлении избытка OH−-ионов (рис.2, г). Кривые кондуктометрического титрования могут искажаться вследствие гидролиза и других причин.
Кондуктометрическое титрование обладает рядом преимуществ. Его можно проводить в мутных и окрашенных средах, в отсутствие химических индикаторов. Метод обладает повышенной чувствительностью и позволяет анализировать разбавленные растворы веществ (до 10-4 моль/дм3). Кондуктометрическим титрованием анализируют смеси веществ, так как различия в подвижности различных ионов существенны и их можно дифференцированно оттитровывать в присутствии друг друга. Точность кондуктометрического титрования находится в пределах точности титриметрического анализа.
Кондуктометрический анализ легко автоматизировать, если раствор титранта подавать из бюретки с постоянной скоростью, а изменения электрической проводимости раствора регистрировать на самописце. Эта разновидность кондуктометрии получила название хронокондуктометрического анализа, так как по времени титрования до точек перегиба кривой титрования можно рассчитать результат.
В кондуктометрии используют практически все аналитические реакции и диапазон определяемых веществ здесь необычайно широк.
В кислотно-основном титровании кодуктометрическим путем можно определять сильные кислоты, слабые кислоты (имеющие значения рК до 8-10), смеси сильных и слабых кислот (с ∆рК>4), соли слабых оснований и сильных кислот. Кислотно-основные методы кондуктометрического титрования основаны на высокой подвижности ионов Н+ и ОН−, малейшие изменения концентрации которых приводят к значительным изменениям электрической проводимости растворов. В качестве титрантов в кислотно-основном кондуктометрическом титровании применяют 0,1 н, 0,01 н, 0,001 н растворы HCl, NaOH, титруют растворы, содержащие от 0,1 до 0,001 моль/дм3 определяемых веществ.
В осадительном кондуктометрическом
титровании электрическая проводимость
титруемых растворов сначала уменьшается
или остается на некотором постоянном
уровне вследствие связывания титруемого
электролита в осадок, после точки
эквивалентности при появлении избытка
титранта – снова возрастает. Повышение
растворимости осадков (ПР > 10-8)
затрудняет определение точки
эквивалентности вследствие сглаживания
кривой титрования. Методом осадительного
кондуктометрического титрования
определяют анионы, осаждаемые перхлоратом
ртути (II) и нитратом серебра
(![]() соли
органически кислот), солями бария (
соли
органически кислот), солями бария (![]() органические кислоты). Для определения
катионов применяют сульфат лития (
органические кислоты). Для определения
катионов применяют сульфат лития (![]() ),
хромат калия (
),
хромат калия (![]() ),
оксалат лития (
),
оксалат лития (![]() и др.) и ряд других реагентов.
и др.) и ряд других реагентов.
В
комплексиметрическом кондуктометрическом
титровании изменения электрической
проводимости раствора наступают
вследствие связывания катионов металла
в комплекс с ЭДТА (или другими лигандами).
При этом для каждого катиона с помощью
буферных растворов регулируют рН среды,
влияющий на характер кривых титрования.
Титрованию подвергают 0,01![]() 0,005
М растворы солей металлов. Комплексиметрическим
путем можно определять
0,005
М растворы солей металлов. Комплексиметрическим
путем можно определять
![]() и др.
и др.
Окислительно-восстановительное
кондуктометрическое титрование основано
на изменении концентрации реагирующих
ионов и появлении в растворе новых
ионов, что изменяет электрическую
проводимость раствора. Например, при
титровании арсенитов раствором йода в
присутствии гидрокарбоната натрия из
раствора исчезает
![]() и появляются
и появляются
![]() и
и
![]() .
До точки эквивалентности электрическая
проводимость раствора возрастает, после
точки эквивалентности изменяется мало.
.
До точки эквивалентности электрическая
проводимость раствора возрастает, после
точки эквивалентности изменяется мало.
К недостаткам метода следует отнести малую селективность.
Развитие получила высокочастотная кондуктометрия, в которой электроды с раствором не контактируют, что важно при анализе агрессивных сред и растворов в закрытых сосудах (ампулах). При высокочастотной кондуктометрии электроды накладываются поверх стекла ячейки, которая выполняет роль конденсатора в высокочастотном колебательном контуре (рис.3).
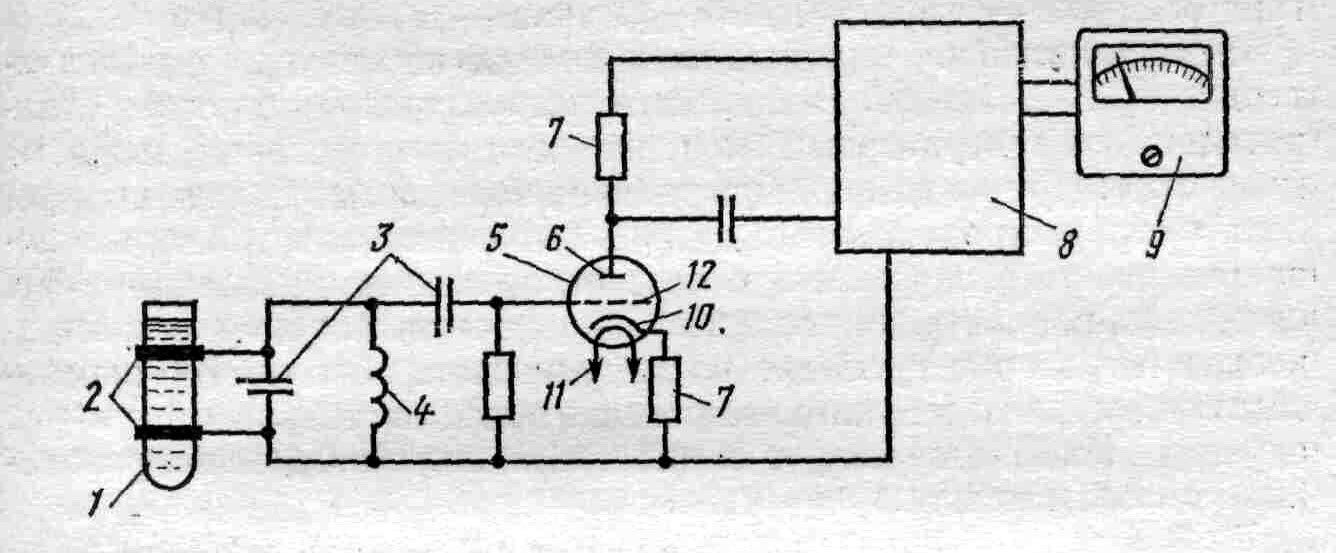
![]()
Рис. 3. Схема высокочастотного титратора:
1 – ячейка; 2 – электроды; 3 – конденсатор; 4 – катушка индуктивности; 5 – усилительная радиолампа; 6 – анод; 7 – сопротивление; 8 – усилитель; 9 – измерительный прибор; 10 – катод; 11 – накал; 12 – сетка радиолампы
Контур включен в радиотехническое устройство, выполняющее роль генератора колебаний и измерителя характеристик ячейки. В высокочастотной кондуктометрии о концентрации раствора можно судить по высокочастотной проводимости (или обратной величине – сопротивлению ячейки) и по емкости ячейки как конденсатора, пластинами которого являются электроды, диэлектриком – стеклянные стенки ячейки и раствор между ними. Частота колебательного контура f, состоящего из конденсатора емкостью C и катушки индуктивности L, определяется уравнением
![]()
Емкость конденсатора С зависит от диэлектрической проницаемости диэлектрика ε, площади пластин S и расстояния между ними l:
![]()
П. Дебаем и Г. Фалькенгагеном выведено уравнение, связывающее концентрацию раствора Ср, частоту колебаний f, диэлектрическую проницаемость растворителя и предельную эквивалентную электрическую проводимость раствора Λ:
![]() ,
,
где К – коэффициент пропорциональности.
На указанных зависимостях основан метод высокочастотной кондуктометрии. Получили развитие два варианта метода – прямая высокочастотная кондуктометрия и высокочастотное титрование.
Прямая высокочастотная кондуктометрия применяется для определения влажности веществ, зерна, древесины, концентрации растворов в закрытых сосудах-ампулах, при анализе агрессивных жидкостей. При определении влажности используют сильное влияние воды, имеющей высокую диэлектрическую проницаемость (ε = 81), на емкость ячейки как конденсатора.
Высокочастотное титрование проводят на специальных титраторах. Высокочастотный титратор включает измерительный и генераторный блок, ячейку для титрования, мешалку и бюретку. При проведении титрования записывают показания прибора и строят кривую титрования. В точке эквивалентности наблюдается перегиб, связанный с соответствующими изменениями рН среды или концентрации веществ. Высокочастотное кондуктометрическое титрование проводят по типу кислотно-основного, окислительно-восстановительного или осадительного титрования в тех случаях, когда отсутствует подходящий индикатор или при анализе смесей веществ.
