
- •41. Электрорецепция.
- •42. Как влияет удаление малозначащих признаков из обучающей выборки на процесс обучения нейросети? Пример на эвм.
- •43. Пространственная конфигурация биополимеров. Типы объемных взаимодействий в белковых макромолекулах. Водородные связи.
- •44. Хеморецепция.
- •45. Показать последовательность обучения и тестирования нейронной сети. Что такое внешняя выборка.
- •46. Взаимодействие макромолекул с растворителем. Состояние воды и гидрофобные взаимодействия в биоструктурах.
- •47. Восприятие запахов: пороги, классификация запахов.
- •48. Каким параметром характеризуется быстрота затухания колебаний, и какие процессы в живой природе имеют колебательный характер
- •49. Особенности пространственной организации белков и нуклеиновых кислот. Модели фибрилляторных и глобулярных белков. Качественная структурная теории белка.
- •50. Бактериородопсин как молекулярный фотоэлектрический генератор.
- •51. По каким физическим параметрам классифицируются биопотенциалы и какие требования предъявляются к усилителям биопотенциалов в этой связи.
- •52. Структура и функционирование биологических мембран. Мембрана как универсальный компонент биологических систем.
- •53. Вкус. Вкусовые качества. Строение вкусовых клеток.
- •55. Бислойные мембраны. Протеолипосомы. Поверхностный заряд мембранных систем.
- •56. Фотохимические превращения родопсина. Рецепторные потенциалы.
- •57. Описать методику выполнения измерений длительности сенсомоторных реакций (р-тест).
- •58. Антиоксиданты, механизм их биологического действия. Естественные антиоксиданты тканей и их биологическая роль.
- •59. Закон Вебера-Фехнера.
- •60. Как проверить экспериментально закон Вебера-Фехнера.
48. Каким параметром характеризуется быстрота затухания колебаний, и какие процессы в живой природе имеют колебательный характер
В настоящее время экспериментально изучено достаточно большое количество колебательных систем в биологии: периодические биохимические реакции, колебания в гликолизе, периодические процессы фотосинтеза, колебания численности видов, излучение звезд, происходящее за счет ядерных реакций в их недрах; волны на поверхности водоемов, возбуждаемые ветром; биение сердца, вызываемое периодическим сокращением сердечной мышцы; речь, вызываемая колебаниями гортани и т. д. Во всех этих процессах некоторые характеризующие систему величины изменяются периодически в силу свойств самой системы без какого-либо периодического воздействия извне. Подобные системы относятся к классу автоколебательных.
Автоколебательными называются системы, в которых устанавливаются и поддерживаются незатухающие колебания за счет сил, зависящих от состояния самой системы, причем амплитуда этих колебаний определяется свойствами самой системы, а не начальными условиями.
Существует понятие - декремент затухания, количественная характеристика быстроты затухания колебаний. Декремент затухания равен натуральному логарифму отношения двух последующих максимальных отклонений х колеблющейся величины в одну и ту же сторону. Декремент затухания - величина, обратная числу колебаний, по истечении которых амплитуда убывает в е раз. Например, если d = 0,01, то амплитуда уменьшится в е раз после 100 колебаний. Декремент затухания характеризует число периодов, в течение которых происходит затухание колебаний, а не время такого затухания. Полное время затухания определяется отношением Т/d.
49. Особенности пространственной организации белков и нуклеиновых кислот. Модели фибрилляторных и глобулярных белков. Качественная структурная теории белка.
Общие черты пространственных структур различных белков были установлены в работах Л.Полинга и Р.Кори:
1. Длины связей и величины валентных углов всех пептидых груп - одинаковы.
2. Все атомы пептидной группы расположены в одной плоскости и предпочтительной конфигурацией пептидной группы является транс-конфигурация
3. Полипептидная цепь полностью насыщена водородными связями
4. Двухгранные углы вращения вокруг связей N - Cа и Cа - С' отвечают минимумам торсионных потенциалов, а расстояния между всеми валентно не связанными атомами превышают суммы ван-дер-ваальсовых радиусов.
5. Конформационные состояния всех звеньев полипептидной цепи эквивалентны.
Полинг и Кори, сформулировали гипотезу, согласно которой альфа-спираль и складчатая бэта-структура имеют фундаментальное значение в пространственной организации белковых молекул и что структуры фибриллярных, глобулярных белков и синтетических пептидов могут быть описаны с помощью небольшого числа канонических форм - некоторых структурных блоков.
Общая структура свернутого белка исключительно компактна. Например, полностью вытянутая цепь панкреатического трипсинового ингибитора (58 остатков) имеет длину 21.1 нм.
Нуклеиновые кислоты - это длинные цепочки, состоящие из четырех многократно повторяющихся единиц (нуклеотидов). Их структуру можно представить следующим образом:
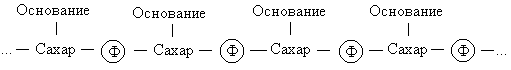
Символ Ф обозначает фосфатную группу. Чередующиеся остатки сахара и фосфорной кислоты образуют сахарофосфатный остов молекулы, одинаковый у всех ДНК, а огромное их разнообразие обусловливается тем, что четыре азотистых основания могут располагаться вдоль цепи в самой разной последовательности.
Сахаром в нуклеиновых кислотах является пентоза; четыре из пяти ее углеродных атомов вместе с одним атомом кислорода образуют кольцо. В РНК сахар представлен рибозой, а в ДНК - дезоксирибозой, содержащей на один атом кислорода меньше.
Поскольку фосфатные группы присоединены к сахару асимметрично, в положениях 3 и 5, молекула нуклеиновой кислоты имеет определенное направление. Сложноэфирные связи между мономерными единицами нуклеиновых кислот чувствительны к гидролитическому расщеплению (ферментативному или химическому), которое приводит к высвобождению отдельных компонентов в виде небольших молекул.
Азотистые основания – это плоские гетероциклические соединения. Они присоединены к пентозному кольцу по положению 1. Более крупные основания имеют два кольца и называются пуринами: это аденин (А) и гуанин (Г). Основания, меньшие по размерам, имеют одно кольцо и называются пиримидинами: это цитозин (Ц), тимин (Т) и урацил (У). В ДНК входят основания А, Г, Т и Ц, в РНК вместо Т присутствует У. Последний отличается от тимина тем, что у него отсутствует метильная группа (CH3). Урацил встречается в ДНК некоторых вирусов, где он выполняет ту же функцию, что и тимин.
Фибриллярные белки - расположенные параллельно друг другу вытянутые полипептидные цепи, образующие длинные нити или слои. Существует четыре типа фибриллярных белков, выполняющих в животных организмах защитную или структурную роль: альфа-кератины, бэта-керотины, коллаген и эластин. Все эти белки не растворяются в воде при физиологических условиях.
В глобулярных белках полипептидная цепь свернута в компактную глобулу. Белки этого класса имеют значительно более сложные конформации, чем фибриллярные белки. Некоторые глобулярные белки выполняют транспортные функции: вместе с током крови они переносят кислород, питательные вещества и неорганические ионы; к этому же классу белков принадлежат антитела, часть гормонов, а также компоненты мембран и рибосом.
