
- •Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
- •Закон постоянства состава. Впервые сформулировал ж.Пруст (1808 г).
- •Закон кратных отношений (д.Дальтон, 1803 г.)
- •Закон объемных отношений (Гей-Люссак, 1808 г.)
- •Закон Авогадро ди Кваренья(1811 г.)
- •3.2.3 Способы образования ковалентной связи
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов
- •1.4. Коррозионные гальванические элементы и причины их возникновения
Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов
Как вы уже знаете, химические процессы могут сопровождаться различными явлениями — поглощением и выделением теплоты, света, звука и т.д. В частности, они могут приводить к возникновению электрического тока или вызываться им. Такие процессы называются электрохимическими, и их открытие сыграло существенную роль как в химии, так и в физике. Возьмем два одинаковых стакана. В один нальем раствор хлорида меди и опустим в него медную пластину, в другой — раствор хлорида цинка и опустим в него цинковую пластину. Внешне при этом в обоих стаканах ничего не происходит. Однако если соединить металлические пластины проводником с встроенным в него гальванометром и амперметром, то мы увидим, что стрелка гальванометра отклонится, показывая наличие разности потенциалов. При этом стрелка амперметра останется на нуле, что свидетельствует об отсутствии тока между пластинами. Что же происходит? Хотя, опуская пластину меди в раствор соли меди, мы ничего не видели, кое-что все же происходило. В очень тонком (практически мономолекулярном) слое раствора, прилегающем к металлу, полярные молекулы воды начали вырывать из кристаллической решетки меди ее ионы: Cu(тв)Cu2++2e- Этот процесс можно рассматривать как обычную химическую реакцию, но с участием необычного реагента — электронов, которые в результате реакции остаются в металле, придавая ему отрицательный заряд, Слой раствора, прилегающий к металлу, за счет избытка положительных ионов приобретает положительный заряд. Возникает разница потенциалов, которая стремится вернуть
ионы меди обратно в металл, и устанавливается равновесие. Получается, что в результате химического процесса появилось электрическое устройство — конденсатор (правда, имеющий молекулярные размеры). Он называется двойным электрическим слоем, а вся созданная система (металл — раствор его соли) — полуэлементом, В отличие от обычного химического равновесия, полученное нами характеризуется не только соотношением концентраций реагентов и продуктов, но и разницей потенциалов в двойном электрическом слое. Эта разница называется электродным потенциалом металла и характеризует окислительно-восстановительную способность твердого металла. (Сразу отметим, что такую способность для газообразного металла характеризует совсем другая величина — ионизационный потенциал, который равен энергии, необходимой для отрыва электрона от изолированного атома). Непосредственно измерить электродный потенциал практически невозможно — ведь он существует между объектами, разделёнными одним слоем молекул. Однако если взять два полуэлемента, образованных разными металлами (как в нашем опыте), то потенциалы на металлических пластинах будут разными, что мы и заметили. Полученная система из двух полуэлементов называется гальваническим элементом. ••: Если мы соединим в нашем опыте стаканы трубочкой с раствором какой-либо соли (солевым мостиком), то амперметр покажет наличие тока. При этом, поскольку электродный потенциал цинка ниже, чем у меди, то электроны из цинковой пластины пойдут в медную. По принципу Ле Шателье в обоих полуэлементах сместится равновесие в двойном электрическом слое (ведь электроны участвуют в реакции!) Это приведет к тому, что медь из раствора будет осаждаться на медной пластине, а цинк уходить с цинковой пластины в раствор. По солевому мостику избыток положительных ионов из стакана с хлоридом цинка будет переходить в раствор хлорида меди, восстанавливая электростатическое равновесие. Этот процесс будет продолжаться до тех пор, пока либо не растворится полностью цинк, либо не кончится хлорид меди. Если отвлечься от электрических процессов и рассматривать только химические, то получится реакция: Cl2+Zn=Cu+ZnCl2 Но ее можно провести и без гальванического элемента! Однако только его участие объясняет, почему реакция идет именно в этом направлении, а, скажем, не наоборот. Таким образом, знание величин электродных потенциалов позволяет предсказать возможность и направление окислительно-восстановительных реакций. Как же их узнать? Если использовать один и тот же полуэлемент (электрод сравнения) в сочетании с различными другими, то можно получить набор величин, которые будут отличаться от электродных потенциалов сравниваемых металлов на одну и ту же величину — на потенциал электрода сравнения. На практике эти величины можно использовать так же, как и сами электродные потенциалы. Реально в качестве электрода сравнения используется водородный электрод. Он представляет собой специально подготовленную платиновую пластину, погруженную в раствор серной кислоты с концентрацией ионов водорода 1 моль/л и омываемую непрерывной струей водорода под давлением 100000 Па при температуре 25°С. При этом на поверхности платины происходят следующие процессы. Н22Н (1) НН++e- (2) Реакция (2), как видно, очень похожа на ту, что происходит в металлическом полуэлементе. На платиновой пластине появляется потенциал, который условно принят за ноль. Если пластину металла, погруженного в раствор его соли с концентрацией 1 моль/л, соединить в гальванический элемент с водородным электродом при температуре 25°С, то возникшая разность потенциалов называется стандартным электродным потенциалом металла и обозначается как E°. Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au Если вспомнить, что происходило в нашем гальваническом элементе, то легко понять, почему расположение металлов в этом ряду предсказывает их свойства: 1) Каждый металл может вытеснять (восстанавливать) из растворов их солей те металлы, которые стоят в ряду напряжений после него. 2) Все металлы, имеющие отрицательный электродный потенциал (то есть стоящие в ряду напряжений до водорода), могут вытеснять (восстанавливать) его из растворов кислот.
Как нетрудно догадаться, понятие стандартного электродного потенциала приложимо не только к системе металл/ион металла, но и к любой реакции, проходящей с участием электронов. Эти реакции вам хорошо знакомы: вы их писали, составляя электронно-ионный баланс для уравнивания окислительно-восстановительных реакций, например: Cr2O2-7+14Н++бe-2Cr3++7Н2O Мы не будем останавливаться на том, как измеряют стандартные электродные потенциалы таких полуреакций — это выходит за рамки данного курса, но такие методы есть, и с их помощью определены стандартные окислительно-восстановительные потенциалы огромного количества реакций. Они сведены в таблицы, где приводятся стандартные потенциалы реакций в форме: | окисленная форма | + ne- | восстановленная форма | и, соответственно, показывают окислительную способность окисленной формы. Для того, чтобы понять, возможно ли протекание окислительно-восстановительной реакции, необходимо найти разность стандартных потенциалов соответствующих полуреакций. Например, узнаем, можно ли с помощью кислого раствора бихромата получить свободные галогены окислением бромидов и хлоридов. Находим в таблице 12 полуреакцию для окислителя В случае бромида разница потенциалов 0.28 В > 0 и реакция K2Cr2O7+KBr+H2SO4 Cr2(SO4)3+K2SO4+H2O+Br2 будет идти. В случае же хлорида разница составляет -0.01 В<0 и аналогичная реакция происходить не будет. Напротив, будет идти обратная реакция, то есть окисление трехвалентного хрома в кислом растворе хлором. Однако нужно помнить, что выяснять направление реакции с помощью стандартных потенциалов можно только при условии, что реакция проходит при 25°С , а Концентрации всех реагентов — 1 моль/л. Так, на самом деле реакция окисления хлорида калия бихроматом калия будет идти, так как при 25°С невозможно создать в растворе концентрацию хлора 1 моль/л.


№60
ДВОЙНОЙ
ЭЛЕКТРИЧЕСКИЙ СЛОЙ
, тонкий поверхностный слой из
пространственно разделенных электрич.
зарядов противоположного знака,
образующийся на границе двух фаз.
Поскольку пространств. разделение
зарядов всегда сопровождается
возникновением электрич. разности
потенциалов, Д. э.с. можно рассматривать
как своеобразный микроконденсатор,
расстояние между обкладками к-рого
определяется молекулярными размерами.
Образование Д.э.с. оказывает существенное
влияние на скорость электродных
процессов, адсорбцию ионов и нейтральных
молекул, устойчивость дисперсных систем,
смачиваемость, коэф. трения и др. св-ва
межфазных границ. В биол. системах
процессы образования и разрушения Д.
э. с. на клеточных мембранах сопровождают
распространение электрич. импульсов
вдоль нервных и мышечных волокон. Наиб.
детально строение Д. э. с. изучено на
границе между металлич. электродом и
р-ром электролита. При погружении
металлич. электрода М в р-р электролита,
содержащий ионы этого металла М+
(потенциалопределяющие ионы),
устанавливается электрохим. равновесие,
сопровождаемое выравниванием электрохим.
потенциалов этих ионов в кристаллич.
решетке металла и в р-ре. Если первоначально
электрохим. потенциал ионов М+
в металле
![]() был
больше электрохим. потенциала этих
ионов в р-ре
был
больше электрохим. потенциала этих
ионов в р-ре
![]() ,
то в процессе выравнивания этих величин
нек-рое кол-во ионов М+
переходит из металла в р-р и пов-сть
металла заряжается отрицательно.
Притянутые к ней кулоновскими силами
катионы из р-ра (не обязательно М+)
образуют положит. обкладку Д. э. с.
Возникающая при этом электрич. разность
потенциалов препятствует дальнейшему
переходу ионов М+
из
металла в р-р, что и приводит к установлению
электрохим. равновесия. Если первоначально
,
то в процессе выравнивания этих величин
нек-рое кол-во ионов М+
переходит из металла в р-р и пов-сть
металла заряжается отрицательно.
Притянутые к ней кулоновскими силами
катионы из р-ра (не обязательно М+)
образуют положит. обкладку Д. э. с.
Возникающая при этом электрич. разность
потенциалов препятствует дальнейшему
переходу ионов М+
из
металла в р-р, что и приводит к установлению
электрохим. равновесия. Если первоначально
![]() ,
то при установлении электрохим. равновесия
часть ионов М+
из р-ра переходит на металл, заряжая его
пов-сть положительно. Отрицат. обкладку
Д. э.с. в этом случае составляют притянутые
к пов-сти металла анионы р-ра. Путем
подбора концентрации потенциалопределяющих
ионов в р-ре можно добиться такой
ситуации, что условие
,
то при установлении электрохим. равновесия
часть ионов М+
из р-ра переходит на металл, заряжая его
пов-сть положительно. Отрицат. обкладку
Д. э.с. в этом случае составляют притянутые
к пов-сти металла анионы р-ра. Путем
подбора концентрации потенциалопределяющих
ионов в р-ре можно добиться такой
ситуации, что условие
![]() не
требует перехода ионов М+
из металла в р-р или наоборот. В этом
случае заряд пов-сти металла равен нулю,
а его потенциал, измеренный относительно
к.-л. электрода сравнения, наз. потенциалом
нулевого заряда
. Условия
положительно заряженной, отрицательно
заряженной и незаряженной пов-сти
металла можно осуществить и в том случае,
если в р-ре электролита нет
потенциалопределяющих ионов. Для этого
необходимо внести в р-р кроме данного
металлич. электрода М к.-л. вспомогат.
электрод и подсоединить оба электрода
к внеш. источнику постоянного напряжения.
В зависимости от величины и знака
напряжения источника можно произвольно
изменять заряд q
пов-сти
металла М. При q
> 0
ионную обкладку Д. э. с.образуют притянутые
из р-ра анионы, при q
< 0
- катионы. При потенциале нулевого
заряда, когда q
=
0, ионный Д.э.с. отсутствует, но разность
потенциалов на границе р-р|металл
(гальвани-потенциал) не равна нулю, т.
к. на этой границе существуют т. наз.
адсорбционный и электронный Д.э.с.
Адсорбц. Д.э.с. связан с некулоновской
(специфической) адсорбцией ионов или
полярных молекул. Так, напр., на границе
ртуть|водный р-р KI при q
=
0 донорно-акцепторное взаимод. приводит
к специфич. адсорбции анионов I,
к-рые уже вследствие кулоновского
взаимод. притягивают эквивалентное
кол-во катионов К+.
При этом электрич. центры анионов I
оказываются ближе к пов-сти ртути, чем
электрич. центры катионов К+,
и пространств. разделение зарядов ведет
к образованию адсорбц. Д. э. с., отрицат.
обкладка к-рого обращена в сторону
металла. Полярные молекулы р-рителя или
растворенных нейтральных в-в, как
правило, адсорбируются на электроде
таким образом, что средняя нормальная
к пов-сти составляющая дипольного
момента не равна нулю. Ориентиров.
адсорбция диполей поэтому также приводит
к образованию адсорбц. Д.э.с. Напр., при
адсорбции молекул бутилового спирта
из водного р-ра на незаряженной пов-сти
ртути гидрофобные углеводородные
радикалы С4Н9,
несущие положит. заряд диполя, ориентированы
в сторону пов-сти, а гидрофильные
ОН-группы, на к-рых сосредоточен отрицат.
заряд, ориентированы в сторону р-ра.
Адсорбц. Д.э.с. может образоваться также
и при адсорбции неполярных частиц, если
их донорно-акцепторное взаимод. с
электродом сопровождается возникновением
наведенного дипольного момента (напр.,
при адсорбции на электродах атомов Н
или О). Электронный Д.э.с. обусловлен
квантовомех. св-вами электронов в
металлах и полупроводниках. Согласно
совр. моделям металла как электронного
газа и ионного остова электронный Д.э.с.
связывают с тем, что электронный газ
несколько выходит за пределы ионного
остова, что и приводит к пространств.
разделению зарядов. При этом своей
положит. обкладкой Д. э. с. обращен к
металлу, отрицательной - к контактирующей
с металлом фазе (р-ру или газу). В
полупроводниках из-за малого кол-ва
носителей тока (электронов в зоне
проводимости и "дырок" в валентной
зоне) при наложении внеш. напряжения
возникает их неравномерное пространств.
распределение в поверхностном слое,
к-рое рассматривают как электронный Д.
э. с. внутри полупроводниковой фазы. В
общем случае Д. э. с., вызванные разными
причинами, накладываются друг на друга,
что приводит к весьма сложной структуре
границы раздела между электродом и
р-ром. Возникновение Д. э. с. на границе
непроводящего твердого тела с р-ром
связано либо с адсорбцией, либо с взаимод.
поверхностных ионогенных групп твердого
тела с молекулами р-рителя. Так, напр.,
кристаллы AgI, полученные по р-ции KI +
AgNO3
:AgI + KNO3,
в р-рах с избытком KI адсорбируют ионы
I
и заряжаются отрицательно, в р-рах с
избытком AgNO3
адсорбируют ионы Ag+
и заряжаются положительно. При этом к
заряженной пов-сти AgI под действием
электростатич. сил притягиваются ионы
противоположного знака, образующие
ионную обкладку Д.э.с. С другой стороны,
взаимод. поверхностных ионогенных групп
разл. оксидов с ионами Н3О+
, ОН
и молекулами воды в зависимости от рН
р-ра может приводить либо к положит.,
либо к отрицат. заряжению пов-сти оксида.
не
требует перехода ионов М+
из металла в р-р или наоборот. В этом
случае заряд пов-сти металла равен нулю,
а его потенциал, измеренный относительно
к.-л. электрода сравнения, наз. потенциалом
нулевого заряда
. Условия
положительно заряженной, отрицательно
заряженной и незаряженной пов-сти
металла можно осуществить и в том случае,
если в р-ре электролита нет
потенциалопределяющих ионов. Для этого
необходимо внести в р-р кроме данного
металлич. электрода М к.-л. вспомогат.
электрод и подсоединить оба электрода
к внеш. источнику постоянного напряжения.
В зависимости от величины и знака
напряжения источника можно произвольно
изменять заряд q
пов-сти
металла М. При q
> 0
ионную обкладку Д. э. с.образуют притянутые
из р-ра анионы, при q
< 0
- катионы. При потенциале нулевого
заряда, когда q
=
0, ионный Д.э.с. отсутствует, но разность
потенциалов на границе р-р|металл
(гальвани-потенциал) не равна нулю, т.
к. на этой границе существуют т. наз.
адсорбционный и электронный Д.э.с.
Адсорбц. Д.э.с. связан с некулоновской
(специфической) адсорбцией ионов или
полярных молекул. Так, напр., на границе
ртуть|водный р-р KI при q
=
0 донорно-акцепторное взаимод. приводит
к специфич. адсорбции анионов I,
к-рые уже вследствие кулоновского
взаимод. притягивают эквивалентное
кол-во катионов К+.
При этом электрич. центры анионов I
оказываются ближе к пов-сти ртути, чем
электрич. центры катионов К+,
и пространств. разделение зарядов ведет
к образованию адсорбц. Д. э. с., отрицат.
обкладка к-рого обращена в сторону
металла. Полярные молекулы р-рителя или
растворенных нейтральных в-в, как
правило, адсорбируются на электроде
таким образом, что средняя нормальная
к пов-сти составляющая дипольного
момента не равна нулю. Ориентиров.
адсорбция диполей поэтому также приводит
к образованию адсорбц. Д.э.с. Напр., при
адсорбции молекул бутилового спирта
из водного р-ра на незаряженной пов-сти
ртути гидрофобные углеводородные
радикалы С4Н9,
несущие положит. заряд диполя, ориентированы
в сторону пов-сти, а гидрофильные
ОН-группы, на к-рых сосредоточен отрицат.
заряд, ориентированы в сторону р-ра.
Адсорбц. Д.э.с. может образоваться также
и при адсорбции неполярных частиц, если
их донорно-акцепторное взаимод. с
электродом сопровождается возникновением
наведенного дипольного момента (напр.,
при адсорбции на электродах атомов Н
или О). Электронный Д.э.с. обусловлен
квантовомех. св-вами электронов в
металлах и полупроводниках. Согласно
совр. моделям металла как электронного
газа и ионного остова электронный Д.э.с.
связывают с тем, что электронный газ
несколько выходит за пределы ионного
остова, что и приводит к пространств.
разделению зарядов. При этом своей
положит. обкладкой Д. э. с. обращен к
металлу, отрицательной - к контактирующей
с металлом фазе (р-ру или газу). В
полупроводниках из-за малого кол-ва
носителей тока (электронов в зоне
проводимости и "дырок" в валентной
зоне) при наложении внеш. напряжения
возникает их неравномерное пространств.
распределение в поверхностном слое,
к-рое рассматривают как электронный Д.
э. с. внутри полупроводниковой фазы. В
общем случае Д. э. с., вызванные разными
причинами, накладываются друг на друга,
что приводит к весьма сложной структуре
границы раздела между электродом и
р-ром. Возникновение Д. э. с. на границе
непроводящего твердого тела с р-ром
связано либо с адсорбцией, либо с взаимод.
поверхностных ионогенных групп твердого
тела с молекулами р-рителя. Так, напр.,
кристаллы AgI, полученные по р-ции KI +
AgNO3
:AgI + KNO3,
в р-рах с избытком KI адсорбируют ионы
I
и заряжаются отрицательно, в р-рах с
избытком AgNO3
адсорбируют ионы Ag+
и заряжаются положительно. При этом к
заряженной пов-сти AgI под действием
электростатич. сил притягиваются ионы
противоположного знака, образующие
ионную обкладку Д.э.с. С другой стороны,
взаимод. поверхностных ионогенных групп
разл. оксидов с ионами Н3О+
, ОН
и молекулами воды в зависимости от рН
р-ра может приводить либо к положит.,
либо к отрицат. заряжению пов-сти оксида.
Двойной электрический слой (межфазный) - ДЭС
Двойной электрический слой (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных

молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:
1.Переход ионов или электронов из одной фазы в другую (поверхностная ионизация). Примером
может служить диссоциация поверхностных функциональных групп, принадлежащих одной
из фаз (как правило, твердой). Для определения знака заряда поверхности используется
правило Фаянса — Панета
2.Преимущественная адсорбция в межфазном слое ионов одного знака.
3.Ориентирование полярных молекул в поверхностном слое. По этому механизму ДЭС образуется
в случае, если вещества, составляющие фазы системы не могут обмениваться зарядами.
Для определения знака заряда поверхности используют правило Кёна, гласящее, что из
двух соприкасающихся фаз положительно заряжается та, которая имеет большую
диэлектрическую проницаемость.
В отсутствии теплового движения частиц, строение двойного электрического слоя подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:
Слой Гельмгольца или адсорбционный слой, примыкающий непосредственно к межфазной поверхности.
Этот слой имеет толщину
![]()
равную радиусу потенциалопределяющих ионов в несольватированном состоянии.
Диффузный слой или слой Гуи, в котором находятся противоионы. Диффузный слой имеет толщину
![]()
которая зависит от свойств системы и может достигать больших значений. Электрической характеристикой ДЭС
является потенциал
![]()
Электрокинетический потенциал или дзета-потенциал - это потенциал соответствует плоскости скольжения и является частью потенциала диффузного слоя. Плоскость скольжения образуется в результате того, что при движении дисперсных частиц наиболее удаленная часть диффузного слоя не участвует в движении, а остается неподвижной. Поэтому появляется нескомпенсированность поверхностного заряда частицы и становятся возможными электрокинетические явления. Дзета-потенциал является одной из важнейших характеристик двойного электрического слоя.
№61
Электродные потенциалы металлов
Электрохимические процессы относятся к окислительно-восстановительным. В окислительно-восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю. Если же процессы окисления и восстановления пространственно разделить, а электроны направить по металлическому проводнику, то такая система будет представлять собой гальванический элемент. Причиной возникновения электрического тока в гальваническом элементе является разность электродных потенциалов.
Что такое электродный потенциал? Представим, что пластинка металла опущена в воду. Металлы являются кристаллами и в них существует подвижное равновесие между атомами и ионами металлов и свободными электронами, которое можно выразить уравнением
Ме
|
(12.1) |
При погружении металла в воду ионы его поверхностного слоя под действием полярных молекул воды отрываются и гидратированными переходят в раствор:
Меn+ + mН2О Меn+ · mН2О. |
(12.2) |
В результате такого перехода жидкость заряжается положительно, а металл - отрицательно, поскольку на нем появляется избыток электронов. С течением времени по мере перехода ионов металла в водную среду и накопления их начинает замедляться дальнейшее растворение металла и устанавливается подвижное равновесие:
Ме + mH2O Men+ · mH2O + ne. |
(12.3) |
Состояние равновесия уравнения (12.3) зависит от природы металла (энергии ионизации), от концентрации ионов металла в растворе. Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо (по принципу Ле-Шателье), и ионы металла переходят в раствор. Электроны остаются на поверхности металла, заряжая его отрицательно по отношению к раствору. Этот процесс является окислением. Электростатическое притяжение между катионами металла в растворе и избыточными электронами на поверхности металла образует двойной электрический слой (ДЭС), что приводит к возникновению на границе соприкосновения металла и жидкости определенной разности потенциалов, или скачка потенциала. Двойной электрический слой можно уподобить плоскому конденсатору с определенной разностью потенциалов.
Скачок потенциала, возникающий на границе фаз металл-раствор называют электродным потенциалом металла.
Способность посылать ионы металла в раствор у разных металлов неодинакова и зависит от энергии ионизации, сублимации и гидратации. Чем меньше энергия ионизации, тем больше способность металла посылать ионы в раствор и тем ниже его равновесный потенциал. По такой схеме идет образование двойного электрического слоя у активных металлов. Этот процесс можно выразить уравнением; например, для цинка:
|
(12.4) |
Неактивные металлы имеют большую энергию ионизации и практически не посылают ионы в раствор, поэтому равновесная концентрация их в растворе очень мала. Если поместить такой металл в раствор его соли с концентрацией больше равновесной, то в данном случае возникает двойной электрический слой за счет адсорбции ионов металла из раствора на металлической пластинке. Поверхность металла поэтому заряжается положительно, а раствор - отрицательно за счет избытка кислотных остатков. Строение двойного электрического слоя у неактивных металлов можно выразить уравнением:
|
(12.5) |
Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры. Если металл опустить в раствор его соли, содержащий 1 г-ион металла в 1 литре (точнее, активность которого а = 1), то электродный потенциал будет постоянной величиной при данной температуре и давлении. Такой потенциал называется нормальным или стандартным электродным потенциалом. Обозначается электродный потенциал металла следующим образом: ЕМеn+/Me0, а стандартный - E0Men+/Me0.
Основополагающим звеном для понимания электрохимических процессов является ряд напряжения металлов. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается наименее активными благородными металлами:
Li, Rb, К, Ва, Sr, Ca, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au.
Так выглядит, по новейшим представлениям, ряд напряжений для важнейших металлов и водорода. Если из двух любых металлов ряда изготовить электроды гальванического элемента, то на предшествующем в ряду материале появится отрицательное напряжение. Величина напряжения (разность потенциалов) зависит от положения элемента в ряду напряжений и от свойств электролита.
Сущность ряда напряжения установим из нескольких простых опытов, для которых нам понадобятся источник тока и электрические измерительные приборы.
Ряд напряжений металлов
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов, или, точнее, ряд стандартных электродных потенциалов (табл.12.1).
В таблице потенциалы расположены по возрастанию их величин, что соответствует уменьшению восстановительной и повышению окислительной активности соответствующих систем. Если составить электрохимическую цепь из двух электродов этого ряда, то на одном из них, потенциал которого ниже по сравнению с другим, будет идти процесс окисления, а на другом - процесс восстановления.
Ряд напряжений характеризует химические свойства металлов:
Чем левее в ряду напряжений находится металл, тем он химически активнее, тем легче окисляется и труднее восстанавливается из своих ионов.
Каждый металл ряда, не разлагающий воду, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей.
Все металлы, стоящие в ряду напряжений левее водорода, вытесняют (восстанавливают) его из разбавленных кислот (типа серной), а стоящие правее водорода его не вытесняют.
Чем дальше расположены друг от друга в ряду напряжений два металла, тем большую ЭДС будет иметь построенный из них биметаллический гальванический элемент.
Для стандартных электродных потенциалов действительно выражение
ΔG0 = nE0F = ΔH0 – TΔS0 |
(12.6) |
где ΔG0 - уменьшение свободной энергии для электродной реакции; n - число электронов; F - число Фарадея; ΔH0 и ΔS0 - изменения энтальпии и энтропии.
Величина электродного потенциала металла зависит от свойств металла, активности его ионов в растворе и температуры. Эта зависимость выражается уравнением Нернста:
|
(12.7) |
где ЕМеn+/Me - потенциал металла в вольтах при данной активности ионов; Е0Меn+/Me - стандартный электродный потенциал металла; R - универсальная газовая постоянная, равная 8,314 Дж/град?моль; Т - температура в градусах абсолютной шкалы; n - заряд иона металла; F - число Фарадея, равное 96500 Кл; аMen+ - активность ионов металла в растворе, г-ион/л.
Переходя от натуральных логарифмов к десятичным и подставляя в уравнение (12.7) значения соответствующих величин, а также учитывая, что для разбавленных растворов активности мало отличаются от концентраций (а ∼ с), получаем:
|
(12.8) |
Величина E0Men+/Me называется стандартным потенциалом металлического электрода и получается при активности ионов металла в растворе, равной 1. Тогда lgaMen+ = 0 и E0Men+/Me = EMen+/Me.
Следовательно, стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
![]() ,
,
где
 —
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;
—
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;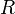 —
универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
—
универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K); —
абсолютная
температура;
—
абсолютная
температура;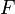 —
число
Фарадея,
равное 96485,35 Кл/моль;
—
число
Фарадея,
равное 96485,35 Кл/моль;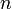 —
число
моль
электронов,
участвующих в процессе;
—
число
моль
электронов,
участвующих в процессе; и
и
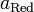 —
активности
соответственно окисленной
и восстановленной
форм вещества, участвующего в полуреакции.
—
активности
соответственно окисленной
и восстановленной
форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
№62
Гальванические элементы
Два металла, погруженные в растворы их солей, соединенные между собой электролитическим ключом, образуют гальванический элемент. Впервые гальванический элемент предложил Вольта. Этот элемент состоял из медных и цинковых пластинок, разделенных сукном, смоченным раствором серной кислоты. При последовательном соединении большого числа пластинок элемент Вольта обладает значительной ЭДС.
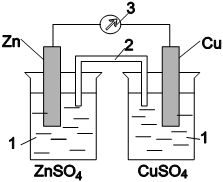 Рис.
12.1. Схема гальванического элемента
1
- растворы ZnSO4 и CuSO4; 2 - электролитический
мостик; 3 - гальванометр
Рис.
12.1. Схема гальванического элемента
1
- растворы ZnSO4 и CuSO4; 2 - электролитический
мостик; 3 - гальванометр
Рассмотрим систему, в которой два электрода находятся в растворах собственных ионов. Примером может служить гальванический элемент Даниэля-Якоби (рис. 12.1). Он состоит из медной пластины, погруженной в раствор сульфата меди, и цинковой пластины, погруженной в раствор сульфата цинка. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластинки возникает двойной электрический слой и устанавливается равновесие:
Zn Zn2+ + 2e.
В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой, устанавливается равновесие и возникает электродный потенциал меди Cu ⇔ Cu2+ + 2e. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
Реакция окисления цинка Zn0 – 2e → Zn2+ (анодный процесс). Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
Реакция восстановления ионов меди Cu2+ + 2e → Cu0 (катодный процесс). Процессы восстановления получили название в электрохимии катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами.
Движение электронов во внешней цепи.
Движение ионов в растворе: сульфат-анионов к аноду, катионов цинка и меди к катоду.
Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем
Zn + Cu2+ = Cu + Zn2+.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводником 1-го рода и проводником 2-го рода обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода - двумя чертами, например, схема элемента Даниэля-Якоби записывается в виде:
(–) Zn /Zn2+ Cu2+/ Cu (+).
Как видно, в гальваническом элементе идет химическая реакция
Zn + CuSO4 = ZnSO4 + Cu;
во внешней цепи элемента протекает электрический ток, т. е. в гальваническом элементе происходит превращение химической энергии в электрическую.
Необходимое условие работы гальванического элемента - разность потенциалов его электродов, она называется электродвижущей силой и обозначается Еэ. Электродвижущая сила всякого работающего элемента есть величина положительная и для любого биметаллического элемента может быть вычислена по разности между стандартными потенциалами катода и анода. Так, Еэ медно-цинкового элемента равна разности между стандартными потенциалами меди (катода) и цинка (анода):
Eэ = E0Cu2+/Cu – E0Zn2+/Zn = +34 - (– 0,76) = 1,1 В.
Если на электродах испытывает превращение 1 моль вещества, то через систему протекает количество электричества, равное nF, где n - число молей эквивалентов в одном моле вещества (по закону Фарадея). Таким образом, максимальная электрическая работа Wm, э гальванического элемента при превращении 1 моля вещества
Wm, э = n F Eэ. |
(12.9) |
В то же время максимальная полезная работа Wm, р, которую может совершить система, равна энергии Гиббса реакции:
Wm,p = – ΔG. |
(12.10) |
Так как Wm,э = Wm,p, то, приравнивая правые части, получаем:
– ΔG = n·F·Eэ; Eэ = – ΔG/n·F. |
(12.11) |
Таким образом, при известных значениях энергии Гиббса по реакции можно рассчитать электродвижущую силу Еэ и наоборот. Уравнение (12.11) показывает связь между химической и электрической энергиями.
– ΔG0 = n · F · Eэ = 2 · 96500 · 1,1 = 212300 Дж.
Концентрационный гальванический элемент
Необходимую для работы гальванического элемента разность потенциалов можно создать, используя один и тот же раствор разной концентрации и электроды из одного металла. В этом случае элемент называется концентрационным и работает за счет выравнивания концентрации растворов. Такие элементы находят применение при измерении концентрации ионов в растворе. Примером концентрационного элемента может служить элемент, составленный из двух водородных электродов:
Pt, H2 |
/ H2SO4 |
|
H2SO4 / |
H2, Pt. |
|
CH+ |
|
С''Н+ |
|
Если СН+ < C''H+, то Еэ = 0,059 lg С''Н+ / СН+.
При СН+ = 1 моль/л электродвижущая сила элемента будет определяться концентрацией водородных ионов во втором растворе, т. е.
Еэ = 0,059 lg C''H+ = – 0,059 pH.
№63
Напряжение гальванического элемента
Напряжение
гальванического элемента - это предельное
значение разности электродных потенциалов
(напряжений) элемента (![]() ),
при токе через элемент, стремящийся к
нулю.
),
при токе через элемент, стремящийся к
нулю.
Оно равно разности равновесных потенциалов катода и анода элемента.
![]()
По
уравнению, связывающему химическую и
электрическую энергии при известных
значениях энергии Гиббса реакции G,
рассчитывают величину
![]() :
:
![]() ,
,
где n - число электронов, участвующих в процессе;
F - постоянная Фарадея, равная 96500 Кл/моль;
- напряжение гальванического элемента.
При стандартных условиях, т.е. при концентрациях реагентов и продуктов реакции, равных 1 моль/л, температуре 298 К и давлении 1,01· 105 Па:
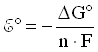 ,
,
где
![]() -
стандартное напряжение гальванического
элемента.
-
стандартное напряжение гальванического
элемента.
Откуда стандартная энергия Гиббса реакции элемента Даниэля-Якоби:
G(298 К) = -212,3 кДж/моль = -212,3 кВт· с/моль.
Стандартное напряжение элемента Даниэля-Якоби равно:
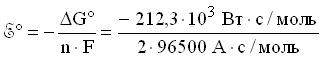
ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления: U = Eэ – I(r1–r2) – ΔE, где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
ВОДОРОДНЫЙ электрод в электрохимии - обычно платинированная пластина, погруженная в раствор кислоты с определенной концентрацией ионов Н+ и омываемая газообразным водородом. При давлении водорода 0,1 МПa и термодинамической активности его ионов, равной единице, потенциал водородного электрода условно принят равным нулю. Такой водородный электрод называется стандартным, он служит электродом сравнения, от которого отсчитывают потенциалы других электродов.
№64
Поляризация. Рассмотренный гальванический элемент Вольта не может длительно работать вследствие возникающего в нем вредного явления поляризации. Сущность этого явления заключается в следующем. Положительные ионы водорода Н2+, направляющиеся к медному электроду 1, взаимодействуют с имеющимися на нем свободными электронами и превращаются в нейтральные атомы водорода. Эти атомы покрывают поверхность медного электрода сплошным слоем 4, что ухудшает работу гальванического элемента по двум причинам. Во-первых, между слоем водорода и электролитом возникает дополнительная э. д. с. (э. д. с. поляризации), направленная против основной э. д. с. элемента, поэтому его результирующая э. д. с. Е уменьшается. Во-вторых, слой водорода отделяет медный электрод от электролита и препятствует подходу к нему новых положительных ионов. При этом резко возрастает внутреннее сопротивление гальванического элемента.
Для борьбы с поляризацией во всех гальванических элементах вокруг положительного электрода располагают специальные вещества — деполяризаторы, которые легко вступают в химическую реакцию с водородом. Они поглощают подходящие к положительному электроду ионы водорода, не позволяя им осаждаться на этом электроде.
Промышленность выпускает гальванические элементы различных типов (с различными электродами и электролитами), имеющие разное конструктивное выполнение. Наиболее распространены угольно-цинковые элементы, в которых угольный и цинковый электроды погружены в водный раствор хлористого аммония (нашатыря) или поваренной соли, а в качестве деполяризатора применяется перекись марганца.
Деполяризация в гальванических элементах.
Основным
материалом для отрицательных электродов
в современных элементах является цинк.
При этом электролит подбирают таким
образом, чтобы переходящие в раствор
положительные ионы цинка, соединяясь
с имеющимися там отрицательными ионами
электролита, давали с последними
растворимое соединение без выделения
газа. Так, например, если электролитом
является раствор H2SO4, то при растворении
цинка образуется растворимая соль
ZnSO4. Таким образом, задача деполяризации
сводится только к устранению водорода
на положительном электроде.
В
настоящее время применяют исключительно
химическую деполяризацию. Ее сущность
заключается в том, что в элемент вводят
какой-либо сильный окислитель, который
вступает в химическую реакцию с водородом,
выделяющимся у положительного электрода,
и этим предотвращает его выделение в
газообразном состоянии.
Рассмотрим
некоторые примеры деполяризации в
элементах. На рис. 122 показано устройство
гальванического элемента Лекланше. Его
электродами являются угольный стержень
(С) и цинковый цилиндр (Zn), а электролитом
служит водный раствор нашатыря (хлористого
аммония, NH4Cl). В качестве деполяризатора
в этом элементе употребляют перекись
марганца (МnО2). Для деполяризации угольный
стержень помещают внутри холщевого
мешка, который набивают измельченной
 Рис.
122. Элемент Лекланше
Рис.
122. Элемент Лекланше
 Рис,
123. Сухой элемент Лекланше
перекисью
марганца, смешанной для лучшей проводимости
с графитом. Выделяющийся при работе
элемента водород вступает в реакцию с
деполяризатором по уравнению
MnO2 +2Н=
МnО+Н2О,
в результате чего водород
окисляется кислородом деполяризатора,
образуя воду, и в газообразном состоянии
не выделяется; элемент Лекланше дает
э. д. с. около 1,4 В.
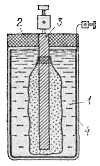
На рис. 123 показано
устройство так называемого «сухого»
элемента, имеющего обширные применения.
Это — элемент Лекланше, в котором вместо
жидкого электролита использована
крахмалистая масса 1 консистенции
густого клейстера, содержащая нашатырь.
Сверху элемент заливается слоем смолы
2, препятствующим выпадению массы при
опрокидывании элемента и предохраняющим
ее от быстрого высыхания. Угольный
электрод 3 имеет вид стерженька, а
цинковый электрод 4 образует корпус
элемента. Подобным образом устроены
батарейки для карманных фонарей: они
содержат два или три маленьких сухих
элемента, соединенных последовательно.
Очень
хорошо устранена поляризация в элементе
Даниеля (§75). При работе элемента у катода
(Zn) происходит образование растворимого
ZnSO4, а на аноде (Cu) выделяется металлическая
медь. Таким об -разом, поверхность
металлических электродов остается
чистой, и поляризация не возникает.
В
последнее время с успехом используется
так называемый воздушный деполяризатор,
при котором для окисления водорода
используется кислород воздуха, подводимый
к аноду при помощи специального
устройства.
Рис,
123. Сухой элемент Лекланше
перекисью
марганца, смешанной для лучшей проводимости
с графитом. Выделяющийся при работе
элемента водород вступает в реакцию с
деполяризатором по уравнению
MnO2 +2Н=
МnО+Н2О,
в результате чего водород
окисляется кислородом деполяризатора,
образуя воду, и в газообразном состоянии
не выделяется; элемент Лекланше дает
э. д. с. около 1,4 В.
На рис. 123 показано
устройство так называемого «сухого»
элемента, имеющего обширные применения.
Это — элемент Лекланше, в котором вместо
жидкого электролита использована
крахмалистая масса 1 консистенции
густого клейстера, содержащая нашатырь.
Сверху элемент заливается слоем смолы
2, препятствующим выпадению массы при
опрокидывании элемента и предохраняющим
ее от быстрого высыхания. Угольный
электрод 3 имеет вид стерженька, а
цинковый электрод 4 образует корпус
элемента. Подобным образом устроены
батарейки для карманных фонарей: они
содержат два или три маленьких сухих
элемента, соединенных последовательно.
Очень
хорошо устранена поляризация в элементе
Даниеля (§75). При работе элемента у катода
(Zn) происходит образование растворимого
ZnSO4, а на аноде (Cu) выделяется металлическая
медь. Таким об -разом, поверхность
металлических электродов остается
чистой, и поляризация не возникает.
В
последнее время с успехом используется
так называемый воздушный деполяризатор,
при котором для окисления водорода
используется кислород воздуха, подводимый
к аноду при помощи специального
устройства.
№65
Электролиз расплавов и растворов электролитов
Химическая реакция, протекающая под действием электрического тока, называется электролизом.
Если постоянный электрический ток пропускать через систему, состоящую из двух проводников первого рода (металлы) и проводника второго рода (раствор или расплав электролита *, в который они опущены), то на границе их раздела возникают электрохимические процессы, составляющие сущность электролиза.
Так, при электролизе расплава хлорида меди (II) электродные процессы могут быть выражены полуреакциями:
на катоде (–) Сu2+ + 2e Cu0 – катодное восстановление
на аноде (+) 2 Cl– – 2e Cl2 – анодное окисление
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
Cu2+ + 2 Cl– Cu + Cl2
При электролизе щелочей и солей оксокислот на аноде выделяется кислород:
4 OH– – 4e 2 H2O + O2
2 SO42– – 4e 2 SO3 + O2
В водных растворах кроме ионов самого электролита находятся также молекулы воды и ионы H+ и OH–, способные участвовать в электродных процессах. В этом случае при электролизе возможны конкурирующие реакции. Критерием, определяющим преимущество того или иного электродного процесса, служит величина его электродного потенциала *. Чем выше потенциал, тем легче (при меньшей отрицательной поляризации электрода) происходит восстановление на катоде и труднее (при большей положительной поляризации электрода) осуществляется окисление на аноде.
Минимальный потенциал, при котором процесс электролиза становится возможным, называется потенциалом (напряжением) разложения или выделения. Его находят вычитанием электродного потенциала катиона из соответствующего значения электродного потенциала аниона. Например, потенциал разложения хлорида цинка равен E(Cl2/2Cl–) – E(Zn2+/Zn)=1,36–(–0,76)=2,12 В. Эта разность потенциалов, или ЭДС * внутреннего гальванического элемента *, возникающего в результате выделения на электродах * продуктов электролиза, имеет направление, противоположное внешней ЭДС, которая служит источником тока. Поэтому электролиз возможен при условии компенсации внутренней ЭДС внешним напряжением. Часто реально необходимый потенциал разложения электролита оказывается больше теоретической величины. Эта разность называется перенапряжением.
При электролизе водного раствора на катоде могут восстанавливаться: 1) Ионы металлов, например Cu2+; 2) ионы водорода в кислой среде: 2H+ + 2e H2 (E=0 при pH=0 и E= –0,41В при pH=7); 3) молекулы воды в нейтральной и щелочной среде: 2H2O + 2e H2 + 2OH– (E= –0,41В при pH=0 и E= –0,83В при pH=14);. Из этих значений электродных потенциалов следует, что при электролизе растворов солей меди, как и всех металлов, стоящих после водорода в ряду напряжений *, на катоде выделяются эти металлы. В нейтральных растворах возможно также выделение и тех металлов, потенциал которых имеет отрицательное значение, но не ниже, чем –0,41В.
При электролизе водного раствора на аноде могут окисляться: 1) Анионы электролита; 2) молекулы воды в нейтральной и кислой среде: 2H2O – 4e 4H+ + O2 (E=1,23В); 3) ионы OH– в щелочной среде: 4OH– – 4e 2H2O + O2 (E=0,40В); 4) материал анода (например, медь).
Из растворов, содержащих смесь катионов, происходит последовательное выделение металлов в порядке уменьшения величины их электродных потенциалов *. Если в растворе находятся ионы металлов, стоящих в начале ряда напряжений * примерно до Ti (E= –1,63В), то на катоде выделяется водород. Металлы, электродные потенциалы которых не сильно отличаются от водородного, выделяются на катоде одновременно с водородом (приблизительно от цинка до олова). В зависимости от условий электролиза массовые соотношения металла и водорода могут быть различными, вплоть до фактического выделения только одного металла. Такая затрудненность выделения водорода называется водородным перенапряжением, Это явление играет большую роль во многих электрохимических процессах. Водородное перенапряжение увеличивается с повышением плотности тока i (сила тока на 1 см2 площади электрода), уменьшается с повышением температуры и зависит от материала катода. Наименьшим оно будет на платине и при небольшой плотности тока практически равно нулю, наибольшим – на ртути и свинце (при i=1А/см2 1,41 и 1,56В соответственно). В результате на свинцовом катоде практически выделяется только свинец, что позволяет проводить его очистку электролизом. На ртутном катоде из нейтральных водных растворов удается восстанавливать даже натрий. Его выделению способствует также образование амальгамы, равновесный потенциал которой значительно менее отрицателен, чем электродный потенциал металлического натрия.
Среди процессов, протекание которых возможно на аноде, в первую очередь осуществляется тот, электродный потенциал которого имеет наиболее низкое значение. Так, окисление анионов кислородсодержащих кислот (SO42–, CO32–, PO43–, NO3– и т.п.) в водном растворе невозможно, т.к. полуреакции окисления воды или ионов OH– с выделением кислорода характеризуются более низкими значениями потенциалов. Окисление галогенид-ионов (кроме F–) в водном растворе происходит с образованием свободных галогенов.
Из-за кислородного перенапряжения при электролизе водных растворов хлоридов на аноде выделяется не кислород, а хлор, хотя его стандартный электродный потенциал (1,36В) имеет большее значение по сравнению с кислородным E(O2+4H+/2H2O)=1,23В.
Напряжение разложения электролита.
При наложении на электроды внешнего тока равновесие электродных реакций [Ох]+nе [Red] нарушается. На электроде, присоединенном к отрицательному полюсу источника тока, оно сместится вправо, а потенциал — до значения, при котором скорость реакции восстановления окислителя будет превосходить скорость обратной реакции на величину внешнего тока. На электроде, присоединенном к положительному полюсу источника тока, будут происходить аналогичные электродные процессы, но противоположно направленные. В результате смещения потенциалов в электролизере возникает э. д. с, равная напряжению, приложенному извне, и противоположная по направлению. Однако, как показывает опыт, ток заметной величины начинает проходить через электролитическую ячейку лишь при достижении напряжения на электролизере до определенной величины. Зависимость силы тока от приложенного напряжения при электролизе показана на графике (рис. 2). На кривой виден излом. Продолжение прямого участка кривой до пересечения с ось абсцисс отсекает на ней отрезок, равный минимальному напряжению, необходимому для разложения электролита инертных электродах, при котором происходит электролиз с заметной скоростью. Это минимальное напряжение называют напряжением (э.д.с.) разложения электролита.
Равновесные потенциалы электродных реакций, протекающих при электролизе, рассчитывают по формуле Нернста. Для этого в таблице стандартных электродных потенциалов находят значения потенциалов реакций, подставляют в формулу концентрации веществ, участвующих в электродных реакциях и решают уравнение с одним неизвестным. Разность найденных по формуле Нернста равновесных потенциалов катода и анода равна э. д. с, при которой скорости прямых и обратных реакций на электродах равны. Следовательно, при найденном значении э. д. с. ток в цепи равен нулю. Электролиз будет протекать лишь при напряжении, превосходящем разность равновесных потенциалов электродных реакций. Только при таком условии возможно прохождение тока. Например, при электролизе воды катод можно рассматривать как водородный, а анод как кислородный электроды. Э. д. с. такой пары электродов при отсутствии тока в цепи и рН—7 равна 1,23 в.
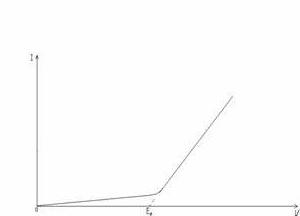
Рис. 2. График зависимости силы тока от напряжения при электролизе.
При получении кислорода и водорода электролизом, раствора серной кислоты на платиновых электродах требуется напряжение на 0,5 в большее, чем 1,23 в, а именно не менее 1,7 в. Эта часть напряжения необходима для преодоления сопротивления протеканию тока, связанного с перенапряжением (затруднением) электрохимических реакций, и сопротивления электролита.
V=фа - фк +na +nk + фраств
Где V – напряжение на электродах ванны;
фа и фк – потенциалы катода и анода, рассчитанные по формуле Нернста,
с учетом изменения концентрации веществ при электролизе;
фраств – падение напряжения на сопротивлении раствора
na и nk – перенапряжение анодной и катодной реакций.
При этом часть электродной энергии превращается в химическую, а часть – в тепловую.
A = n*F*v = n*F*(фа - фк +na +nk + фраств ) = An + Ah + Aраств
Где n*F – число Фарадеев электричества, необходимое для восстановления
на катоде и окисления на аноде 1 моля вещества.
An - Полезная работа (An = n*F*(фа - фк));
Aраств - теплота освобождающаяся на сопротивление электролита
(Араств = n*F*фраств);
Ah - теплота освобождающаяся на сопротивление перенапряжения
(Ап = n*F*(na +nk));
Из этих уравнений следует, что перенапряжение электродных реакций и сопротивление раствора снижают к. п. д. электролитической ванны.
Напряжение разложения электролита равно разности между напряжением, подаваемым на ванну, и падением напряжения на сопротивлении раствора. Оно складывается из равновесных электродных потенциалов и соответствующих перенапряжений катодной и анодной реакций:
Ep = v - фраств = фа - фк +na +nk
Напряжение разложения зависит как от природы электролита, так и от природы электродов.
№66
Поляризация электродов.
При электролизе потенциалы электродов смещаются в противоположные стороны до значений, при которых становится возможным протекание катодной и анодной реакций. Это явление носит название поляризации. Электроды при электролизе поляризуются в следствии следующих причин:
изменения химической природы поверхности электродов при накоплении на них продуктов электролиза (химическая поляризация);
замедленности стадии разряда (ионизации) участвующих в реакции веществ при последующих неэлектрохимических стадий (перенапряжение);
медленного подвода (отвода) к электроду веществ, участвующих в электродном процессе, по сравнению со скоростью самой реакции (концентрационная или диффузионная поляризация).
Химическая поляризация электродов наблюдается в тех случаях, когда на них адсорбируют или отлагаются продукты окисления-восстановления. Так, например, на платиновом катоде при электролизе воды адсорбируется водород и катод из платинового как бы превращается в водородный, для которого характерна электродная реакция 2Н+ + 2е « Н2 и соответствующее значение потенциала. При выделении хлора на платиновом электроде платиновый электрод превращается в хлорный. Точно так же при гальваническом покрытии меди никелем медный электрод превращается в никелевый, и потенциал смещается в отрицательную сторону до значения, соответствующего никелевому электроду.
В ряде случаев прохождению электрического тока препятствует замедленность перехода электронов с катода на восстанавливающиеся частицы или с частиц восстановителя на анод. Для того чтобы электролиз протекал с достаточно высокой скоростью, потенциал катода должен быть смещен от равновесного значения в отрицательную сторону, а потенциал анода соответственно в положительную. Затрудненной может оказаться и какая – либо другая стадия электродной реакции, например десорбция газообразных продуктов электролиза, образование новой фазы на поверхности электрода (кристаллов металла или пузырьков газа), соединение атомов в молекулы, адсорбция разряжающихся ионов и.т.д.
Перенапряжение электродных реакций можно вычислить по разности между напряжением разложения и э.д.с. химической поляризации:
na + nk = Ер - фа + фк
Оно зависит от плотности тока, проходящего через электроды, и эта зависимость выражается уравнением Тафеля:
nk = a + b * lg ik
na = a, + b, * lg ia
где ia и ik – плотность тока на аноде и соответственно на катоде, а/ см2
a(a’) и b(b’) – константы.
При повышении температуры на 10 С перенапряжение уменьшается на
2-3 мв. Оно также зависит от природы вещества, из которого изготовлен электрод. Например, при выделении водорода из соляной кислоты на катоде из платины при плотности тока 1 А/см2 требуется напряжение всего 0,1 в, в то время как на катоде из свинца – 1,5 в, а из ртути – 1,4 в.
Перенапряжение выделения водорода и кислорода на некоторых электродах при 200 С.
Электроды |
Перенапряжение, в |
|
|
водорода |
кислорода |
|
|
ik = 1 А/см2 |
ik = 1мА/см2 |
iа = 1мА/см2 |
|
Платина гладкая |
0,1 |
0,02 |
0,7 |
Никель |
0,64 |
0,34 |
1,09 |
Железо |
0,7 |
0,33 |
1,07 |
Серебро |
0,95 |
0,4 |
0,97 |
Медь |
0,8 |
0,455 |
1,05 |
Олово |
1,24 |
0,86 |
1,21 |
Цинк |
1,24 |
0,89 |
1,75 |
Кадмий |
1,4 |
1,04 |
ѕ |
Ртуть |
1,406 |
1,06 |
1,62 |
Свинец |
1,56 |
1,23 |
1,44 |
Графит |
ѕ |
0,6 |
1,17 |
Таблица 2.
Таким образом, при выборе электродов кроме окислительно-восстановительного потенциала системы, необходимо учитывать и перенапряжение реакций. Так, высокое перенапряжение разряда ионов водорода на цинке делает возможным восстановление ионов цинка из водного раствора, несмотря на то, что равновесный потенциал цинкового электрода более отрицателен, чем водородного.
Пользуясь формулой Нернста, можно найти, что потенциал водородного электрода находится в линейной зависимости от рН раствора.
В тех случаях, когда перенапряжение электродной реакции невелико (что характерно для реакций восстановления многих металлов), скорость электролиза (сила тока) определяется диффузией, миграцией ионов в электрическом поле и перемешиванием раствора. Так как частицы, принимающие участие в реакциях, при достижении электрода мгновенно разряжаются, то их концентрация на поверхности электрода практически равна нулю. Из формулы же Нернста следует, что уменьшение концентрации окислителя приводит к смещению потенциала электрода в отрицательную сторону, а восстановителя в положительную. Если скорость электролиза ограничивается концентрационной поляризацией, то при увеличении напряжения быстро достигается предельное значение силы тока и ускорить электрохимическую реакцию повышением напряжения уже не удается. Дальнейшее повышение напряжения делает возможным протекание других электродных реакций, например разложение воды с выделением водорода и кислорода.
Концентрационная поляризация увеличивает напряжение в ванне. Ее можно уменьшить перемешиванием раствора. Однако перемешивание раствора по условиям электролиза часто неприменимо.
№67
ТАФЕЛЯ
УРАВНЕНИЕ
,
осн.
соотношение электрохимической
кинетики
. Связывает
перенапряжение электродного процесса
(сдвиг потенциала электрода по
отношению к его равновесному значению;
см. Поляризация
)
с
плотностью тока i,
протекающего через границу электрод
|р-р: =a
+ blgi
(а
и
b-эмпирич.
постоянные). Установлено Ю. Тафелем
опытным путем в 1905 применительно к
элект-рохим. р-ции 2Н3О+
+ 2е = Н2
+ 2Н2О,
при этом использовались электроды из
разл. металлов. Пытаясь дать теоре-тич.
обоснование ур-нию, Тафель предположил,
что за обратимой стадией разряда Н3О+
+ е![]() Надс
+ Н2О
следует лимитирующая (замедленная)
стадия рекомбинации адсорбированных
на электроде атомов водорода: 2Надс
: Н2
. В дальнейшем, однако, было показано,
что приведенное Т. у. является частным
случаем более общего ур-ния, связывающего
значения i
и в рамках теории замедленного разряда.
Эмпирич. постоянная а
оказывается
связанной с кинетич. параметром стадии
разряда-коэф. переноса (0
Надс
+ Н2О
следует лимитирующая (замедленная)
стадия рекомбинации адсорбированных
на электроде атомов водорода: 2Надс
: Н2
. В дальнейшем, однако, было показано,
что приведенное Т. у. является частным
случаем более общего ур-ния, связывающего
значения i
и в рамках теории замедленного разряда.
Эмпирич. постоянная а
оказывается
связанной с кинетич. параметром стадии
разряда-коэф. переноса (0![]()
![]() 1),
а постоянная b-
с
током обмена i0:
a=
-(RT/nF)lni0;
b = 2,3RT/nF,
где n-число
электронов, участвующих в стадии разряда,
F
- постоянная
Фарадея.
1),
а постоянная b-
с
током обмена i0:
a=
-(RT/nF)lni0;
b = 2,3RT/nF,
где n-число
электронов, участвующих в стадии разряда,
F
- постоянная
Фарадея.
№70
Законы электролиза Фарадея
С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Фарадеем, который в результате своих исследований установил следующие законы электролиза: 1. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества. Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс — взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода .всегда будет пропорционально числу прошедших по цепи электронов, т.е. количеству электричества. 2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств вещества. Пусть, например, электрический ток последовательно проходит через растворы соляной кислоты, нитрата серебра, хлорида меди (II) и хлорида олова (IV). Через некоторое время определяют
количества
выделившихся продуктов электролиза.
Оказывается, что за время, в течение
которого из раствора соляной кислоты
выделяется 1 г водорода, т.е. 1 моль атомов,
из остальных растворов выделяются
указанные ниже массы металлов:
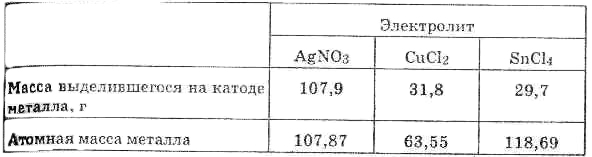 Сопоставляя
выделившиеся массы с атомными массами
тех же металлов, находим, что выделяется
1 моль атомов серебра, 1/2 моля атомов
меди и 1/4 моля атомов олова. Другими
словами, количества образовавшихся на
катоде веществ равны их эквивалентам.
К такому же выводу приводит и измерение
количеств веществ, выделяющихся на
аноде. Так, в первом, третьем и четвертом
приборах выделяется по 35,5 г хлора, а во
втором — 8 г кислорода; нетрудно видеть,
что и здесь вещества образуются в
количествах, равных их эквивалентам.
Рассматривая
второй закон электролиза с точки зрения
электронной теории, нетрудно понять,
почему при электролизе вещества
выделяются в химически эквивалентных
количествах. Обратимся, например, к
электролизу хлорида меди (II). При выделении
меди из раствора каждый ион меди получает
от катода два электрона, и в то же время
два хлорид-иона отдают электроны аноду,
превращаясь в атомы хлора. Следовательно,
число выделившихся атомов меди всегда
будет вдвое меньше числа выделившихся
атомов хлора, т.е. массы меди и хлора
будут относиться друг к другу как их
эквивалентные массы.
Измерениями
установлено, что количество электричества,
обуславливающее электрохимическое
превращение одного эквивалента вещества,
равно 96485 (округленно 96500) кулонам. Это
количество электричества называется
Фарадеем и обозначается буквой F. Второй
закон электролиза дает прямой метод
определения «эквивалентов различных
элементов. На этом же законе основаны
расчеты, связанные с электрохимическими
производствами. Зависимость количества
вещества, образовавшегося под действием
электрического тока, От времени, силы
тока и природы электролита может быть
установлена на основании обобщенного
закона Фарадея:
m=(Э/F)•I•t=(M/n•F)•I•t,
Сопоставляя
выделившиеся массы с атомными массами
тех же металлов, находим, что выделяется
1 моль атомов серебра, 1/2 моля атомов
меди и 1/4 моля атомов олова. Другими
словами, количества образовавшихся на
катоде веществ равны их эквивалентам.
К такому же выводу приводит и измерение
количеств веществ, выделяющихся на
аноде. Так, в первом, третьем и четвертом
приборах выделяется по 35,5 г хлора, а во
втором — 8 г кислорода; нетрудно видеть,
что и здесь вещества образуются в
количествах, равных их эквивалентам.
Рассматривая
второй закон электролиза с точки зрения
электронной теории, нетрудно понять,
почему при электролизе вещества
выделяются в химически эквивалентных
количествах. Обратимся, например, к
электролизу хлорида меди (II). При выделении
меди из раствора каждый ион меди получает
от катода два электрона, и в то же время
два хлорид-иона отдают электроны аноду,
превращаясь в атомы хлора. Следовательно,
число выделившихся атомов меди всегда
будет вдвое меньше числа выделившихся
атомов хлора, т.е. массы меди и хлора
будут относиться друг к другу как их
эквивалентные массы.
Измерениями
установлено, что количество электричества,
обуславливающее электрохимическое
превращение одного эквивалента вещества,
равно 96485 (округленно 96500) кулонам. Это
количество электричества называется
Фарадеем и обозначается буквой F. Второй
закон электролиза дает прямой метод
определения «эквивалентов различных
элементов. На этом же законе основаны
расчеты, связанные с электрохимическими
производствами. Зависимость количества
вещества, образовавшегося под действием
электрического тока, От времени, силы
тока и природы электролита может быть
установлена на основании обобщенного
закона Фарадея:
m=(Э/F)•I•t=(M/n•F)•I•t,
где m — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль);М — молярная масса вещества (г/моль); n — количество отдаваемых или принимаемых электронов; I — сила тока (A); t — продолжительность процесса (с); F — константа Фарадея, характеризующая количества электричества, необходимое для выделения 1 эквивалентной массы вещества (F=96500 Кл/моль=26,8 А•ч/моль). Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью.
№71
ТЕХНИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА
Электролиз нашел широкое применение в технике, например в металлургии, химической промышленности и т. д.
1. Покрытие металлов слоем другого металла при помощи электролиза (гальваностегия).
Для предохранения металлов от окисления, а также для придания изделиям прочности и лучшего внешнего вида их покрывают тонким слоем благородных металлов
(золото, серебро) или малоокисляющимися металлами (хром, никель).
Предмет, подлежащий гальваническому покрытию, тщательно очищают, полируют и обезжиривают, после чего погружают в качестве катода в гальваническую ванну. Электролитом является раствор соли металла, которым осуществляется покрытие. Анодом служит пластина из того же металла. На рис. 45 изображена ванна для никелирования. Электролитом служит водный раствор вещества, содержащего никель (например, сернокислый никель NiS04), катодом является предмет, подвергающийся покрытию. Величина тока, пропускаемого через ванну, должна соответствовать величине t покрываемой поверхности. Для равномерного покрытия предмета его помещают между двумя анодными пластинами. После покрытия предмет вынимают из ванны, сушат и полируют.
2. Получение копий с предметов при помощи электролиза (гальванопластика).
Для получения копий с металлических предметов (монет, медалей, барельефов и т. п.) делают слепки из какого-нибудь пластичного материала (например, воска). Для придания слепку электропроводимости его покрывают графитовой пылью, погружают в ванну в качестве катода и получают на нем слой металла нужной толщины. Затем путем нагревания удаляют воск.
Производство патефонных пластинок основано на применении гальванопластики (рис. 40). Восковая пластина с нанесенной на ней записью, опыленная для электропроводимости золотом, погружается в раствор медного купороса в качестве катода. Медный анод поддерживает концентрацию раствора постоянной. Полученный металлический рельефный негативный отпечаток служит для штампования из нагретой пластмассы большого числа патефонных пластинок.
Гальванопластика применяется во многих отраслях промышленности, в том числе в полиграфии. Процесс гальванопластики был разработан в 5836 г. русским академиком Борисом Семеновичем Якоби (1801—1874). Б. С. Якоби известен своими многочисленными работами в области электротехники. Он является изобретателем первого электродвигателя с непосредственным вращением вала, коллектора для выпрямления тока, пишущих телеграфных аппаратов, а также первого в мире буквопечатающего телеграфного аппарата; им впервые (в 1838 г.) осуществлено движение лодки при помощи электрической энергии.
Якоби созданы приборы для измерения электрического сопротивления, изготовлен эталон сопротивления, сконструирован вольтметр.
3. Рафинирование (очистка) металлов.
В электротехнике благодаря хорошей электропроводимости наиболее широкое применение как проводниковый материал имеет медь. Медные руды, кроме меди, содержат много примесей, таких, как, например, железо, сера, сурьма, мышьяк, висмут, свинец, фосфор и т. п. Процесс получения меди из руды заключается в следующем. Руду измельчают и обжигают в особых печах, где некоторые примеси выгорают, а медь переходит в окись меди, которую снова плавят в печах вместе с углем. Происходит восстановительный процесс, и получают продукт,
называемый черной медью, с содержанием меди 98—99%. Медь, идущая на нужды электротехники, должна быть наиболее чистой, так как всякие примеси уменьшают электропроводимость меди. Такая медь получается из черной меди путем рафинирования ее электрическим способом.
Неочищенная медь подвешивается в качестве анода в ванну с раствором медного купороса (рис. 47). Катодом служит лист чистой меди. При пропускании через ванну электрического тока медь с анода переходит в раствор, а оттуда осаждается на катод. Электролитическая медь содержит до 99,95% меди.
Медь в электротехнике применяется для изготовлений голых к изолированных проводов, кабелей, обмоток электрических машин и трансформаторов, медных полос, лент, коллекторных пластин, деталей машин и аппаратов.
Второе место после меди в электротехнике занимает алюминий. Сырьем для получения алюминия служат бокситы, состоящие из окиси алюминия (до 70%), окиси кремния и окиси железа. В результате обработки бокситов щелочью получается продукт, называемый глиноземом (Аl2O3).
Глинозем с некоторыми добавлениями (для снижения температуры плавления) загружается в огнеупорную печь, стенки и дно которой выложены угольными пластинами, соединенными с отрицательным полюсом источника напряжения. Через крышку печи проходит угольный стержень, который служит анодом. Сначала опускают угольный анод, в результате чего возникает электрическая дуга, которая расплавляет глинозем. В дальнейшем происходит электролиз расплавленной массы. Чистый алюминий скапливается на дне сосуда, откуда его выливают в формы. Процентное содержание алюминия в металле достигает 99,5%. Для получения алюминия требуется большое количество электроэнергии. Поэтому алюминиевые заводы строятся около больших гидроэлектростанций с дешевой электроэнергией.
Алюминий в электротехнике употребляется для изготовления проводов, кабелей, получения некоторых сплавов.
Гальваническое покрытие – это металлическая пленка толщиной от долей микрона до десятых долей миллиметра, наносимые на поверхность не металлических и металлических изделий методом гальваники для придания им твердости, износостойкости, антикоррозийных, антифрикционных, декоративных свойств.
1.1 Классификация гальванических покрытий
Классификация покрытий. В зависимости от требований, предъявляемых к эксплуатационным характеристикам деталей, различают три типа покрытий:
- защитные, применяемые для защиты от коррозии деталей в различных агрессивных средах;
- защитно-декоративные, применяемые для декоративной отделки деталей с одновременной защитой их от коррозии;
- специальные, применяемые для придания поверхности деталей специальных свойств (износостойкости, паяемости, твердости, электроизоляционных, магнитных свойств и др.), восстановления изношенных деталей или обеспечивающие защиту основного металла от особых сред (местная защита от цементации, азотирования и пр.).
По способу защитного действия гальванические покрытия делят на катодные и анодные. Катодные покрытия имеют более положительный, а анодные более электроотрицательный электродные потенциалы по сравнению с потенциалом металла, на который они нанесены. Так, например, Си, Ni, Ag, Аи, осажденные на сталь, являются катодными покрытиями, a Zn и Cd по отношению к стали — анодными.
Защитные действия покрытий зависят не только от природы металла, но и от состава коррозионной среды. Олово по отношению к Fe в растворах неорганических кислот и солей является катодным покрытием, а в ряде органических кислот (пищевых консервах) — анодным. Катодные покрытия защищают металл детали механически, изолируя его от окружающей среды. Основное требование к катодным покрытиям — беспористость. Анодные покрытия защищают металл детали главным образом электрохимически. Поэтому степень пористости анодных покрытий в отличие от катодных не играет существенной роли.
Для краткого наименования различных видов покрытий в конструкторской и нормативно-технологической документации приняты специальные условные обозначения (шифры) покрытий.
Шифр покрытий включает сведения о способе нанесения (за исключением гальванических покрытий) (табл. 1, Прилож.1), материале покрытия (начальные буквы металла покрытия) (табл. 2, Прилож.1), признаке, характеризующем физико-механические свойства покрытия (табл. 3, Прилож.1), толщине покрытия (табл. 4, Прилож.1), декоративные свойства покрытий—по ГОСТ 21484—76 и о виде дополнительной обработки (табл. 5, Прилож.1).
При выборе покрытий следует учитывать назначение и материал детали, условия эксплуатации деталей, назначение и свойства покрытия, способ нанесения покрытия, допустимость контактов сопрягаемых металлов и экономическую целесообразность применения этого покрытия [3, С.34].
Коррозионное воздействие среды, определяемое условиями эксплуатации изделий, является одним из важнейших факторов, обусловливающих выбор покрытий.
Условия эксплуатации в зависимости от коррозионной агрессивности среды (степени загрязнения воздуха коррозионно-активными агентами, температуры окружающей среды и других климатических факторов) классифицируют по группам: легкая — Л, средняя — С, жесткая — Ж, очень жёсткая — ОЖ.
ЭЛЕКТРООСАЖДЕНИЕ
, выделение
фазы (металла, сплава, оксида и др.) на
пов-сти электрода в результате протекания
электрохим. р-ции. Э. металлов лежит в
основе гидроэлектрометаллургии (см.
Электролиз
)и гальванотехники
. Металлы
Au, Ag, Cu, Bi, Pb, Sn, Cd, Co, Ni, Fe, Zn, Mn осаждаются
из водных р-ров простых солей. Нек-рые
элементы - W, Mo, P, S - м. б. выделены в виде
сплавов с металлами группы железа. Al,
Mg, Be, Zr и др., имеющие высокий отрицат.
электродный потенциал осаждаются из
неводных р-ров или расплавов солей.
Э.
металла происходит при более отрицат.
электродном потенциале, чем его
равновесный потенциал в данном р-ре.
Выделение
Ag, Pb, Cd из водных р-ров простых солей
происходит при небольших значениях
поляризации электрода![]() Со, Ni, Fe вьщеляются при высокой поляризации
электрода; для Сu, Bi, Zn поляризация
Со, Ni, Fe вьщеляются при высокой поляризации
электрода; для Сu, Bi, Zn поляризация![]() имеет
промежут. значение. Величина
имеет
промежут. значение. Величина![]() растет
с увеличением тока i
через электрохим. систему. Подвод
разряжающихся ионов к пов-сти катода
осуществляется путем диффузии, конвекции
и миграции. Ток iд,
при к-ром скорость разряда ионов
сравнивается со скоростью их доставки
к пов-сти катода путем диффузии, наз.
предельным диффузионным
током
. Дальнейший
рост тока становится возможным при
возрастании потенциала электрода до
значений, достаточных для протекания
новой электрохим. р-ции (выделения Н2
или др. металлов). В режиме предельного
диффузионного тока на катоде наблюдается
рост дендритов и порошкообразных
отложений, при более низких токах
осаждаются плотные металлич. слои.
При
содержании в р-ре ионов неск. металлов
и достижении потенциала их совместного
разряда на катоде образуется осадок
сплава. Для получения компактных слоев
сплавов стремятся сблизить потенциалы
разряда ионов, изменяя активность
разряжающихся ионов (напр., путем подбора
соответствующих лигандов) или избират.
торможением разряда более электроположит.
металла (напр., введением в р-р ПАВ). Наиб.
часто встречающийся случай совместного
разряда ионов - выделение металла и Н2.
Кол-во электричества, затраченное
на выделение металла, отнесенное к
общему кол-ву пропущенного электричества,
наз. выходом металла по току. Выделяющийся
Н2 может
включаться в материал катода и растущий
осадок, ухудшая их физ.-мех. св-ва. Особенно
сильное воздействие водород оказывает
на высокопрочные стали, вызывая развитие
трещин, - т. наз. водородное охрупчивание.
Для устранения охрупчивания после
нанесения покрытия изделия прогревают
до восстановления исходных мех. св-в.
Согласно закону Фарадея, кол-во
выделяющегося металла на единице площади
пов-сти за единицу времени пропорционально
току, поэтому распределение тока по
пов-сти электрода важно для получения
равномерных по толщине покрытий, особенно
на сложно профилир. изделиях. Распределение
тока зависит от электрохим. поляризуемости
dE/di, омич.
сопротивления р-ра, соосаждения примесей
и локального выхода металла по току.
Морфология пов-сти электроосажденных
слоев и их структура определяются
плотностью тока, т-рой, интенсивностью
перемешивания р-ра, концентрацией
компонентов, присутствием в р-ре ПАВ
или др. примесей. Повышение т-ры,
интенсивности перемешивания или снижение
плотности тока способствуют росту более
крупных и совершенных кристаллов.
Э.
металлов обычно протекает в неравновесных
условиях и в присутствии адсорбир.
компонентов р-ра. Следствием этого
является отклонение физ. и мех. св-в
электроосажденных металлов, особенно
сплавов, от значений, характерных для
равновесных условий. Осадки имеют более
высокую твердость, пониженные пластичность
и электропроводность, малый размер
кристаллов. Плотность дислокаций
достигает 1011-1012
см-1
, что соответствует предельным степеням
деформации металла. Из-за повышенной
концентрации вакансий в электроосажденных
слоях наблюдается ускоренная взаимная
диффузия компонентов в многослойных
покрытиях. Особенно сильно отличаются
от равновесных св-ва электроосажденных
сплавов, для к-рых характерно образование
сильно пересыщенных твердых р-ров и др.
метастабильных фаз, иногда отсутствующих
на диаграмме равновесия. В нек-рых
случаях на катоде осаждаются аморфные
системы - т. наз. металлич. стекла.
Соосаждение с металлом разл. примесей
может происходить не только в результате
совместного разряда ионов (напр.,
водорода, фосфора или серы), но и путем
захвата из р-ра заряженных частиц и
нейтральных молекул ПАВ. Включение в
растущий осадок крупных неметаллич.
частиц (А12О3,
MoS2,
алмаза и др.) приводит к образованию
композиц. покрытий, к-рые м. б. использованы
в качестве абразивных или антифрикц.
покрытий. Э. металлов и сплавов используется
для придания пов-сти изделия особых
физ.-мех. св-в: магнитных (изготовление
магнитопроводов и магн. экранов, нанесение
рабочих слоев на диски элементов памяти
ЭВМ), электрических (токонесущие слои
волноводов и печатных плат, элементы
сопротивлений и нагревателей), высокой
твердости, сопротивления износу, отражат.
способности, а также для покрытия
контактов с низким переходным
сопротивлением.
растет
с увеличением тока i
через электрохим. систему. Подвод
разряжающихся ионов к пов-сти катода
осуществляется путем диффузии, конвекции
и миграции. Ток iд,
при к-ром скорость разряда ионов
сравнивается со скоростью их доставки
к пов-сти катода путем диффузии, наз.
предельным диффузионным
током
. Дальнейший
рост тока становится возможным при
возрастании потенциала электрода до
значений, достаточных для протекания
новой электрохим. р-ции (выделения Н2
или др. металлов). В режиме предельного
диффузионного тока на катоде наблюдается
рост дендритов и порошкообразных
отложений, при более низких токах
осаждаются плотные металлич. слои.
При
содержании в р-ре ионов неск. металлов
и достижении потенциала их совместного
разряда на катоде образуется осадок
сплава. Для получения компактных слоев
сплавов стремятся сблизить потенциалы
разряда ионов, изменяя активность
разряжающихся ионов (напр., путем подбора
соответствующих лигандов) или избират.
торможением разряда более электроположит.
металла (напр., введением в р-р ПАВ). Наиб.
часто встречающийся случай совместного
разряда ионов - выделение металла и Н2.
Кол-во электричества, затраченное
на выделение металла, отнесенное к
общему кол-ву пропущенного электричества,
наз. выходом металла по току. Выделяющийся
Н2 может
включаться в материал катода и растущий
осадок, ухудшая их физ.-мех. св-ва. Особенно
сильное воздействие водород оказывает
на высокопрочные стали, вызывая развитие
трещин, - т. наз. водородное охрупчивание.
Для устранения охрупчивания после
нанесения покрытия изделия прогревают
до восстановления исходных мех. св-в.
Согласно закону Фарадея, кол-во
выделяющегося металла на единице площади
пов-сти за единицу времени пропорционально
току, поэтому распределение тока по
пов-сти электрода важно для получения
равномерных по толщине покрытий, особенно
на сложно профилир. изделиях. Распределение
тока зависит от электрохим. поляризуемости
dE/di, омич.
сопротивления р-ра, соосаждения примесей
и локального выхода металла по току.
Морфология пов-сти электроосажденных
слоев и их структура определяются
плотностью тока, т-рой, интенсивностью
перемешивания р-ра, концентрацией
компонентов, присутствием в р-ре ПАВ
или др. примесей. Повышение т-ры,
интенсивности перемешивания или снижение
плотности тока способствуют росту более
крупных и совершенных кристаллов.
Э.
металлов обычно протекает в неравновесных
условиях и в присутствии адсорбир.
компонентов р-ра. Следствием этого
является отклонение физ. и мех. св-в
электроосажденных металлов, особенно
сплавов, от значений, характерных для
равновесных условий. Осадки имеют более
высокую твердость, пониженные пластичность
и электропроводность, малый размер
кристаллов. Плотность дислокаций
достигает 1011-1012
см-1
, что соответствует предельным степеням
деформации металла. Из-за повышенной
концентрации вакансий в электроосажденных
слоях наблюдается ускоренная взаимная
диффузия компонентов в многослойных
покрытиях. Особенно сильно отличаются
от равновесных св-ва электроосажденных
сплавов, для к-рых характерно образование
сильно пересыщенных твердых р-ров и др.
метастабильных фаз, иногда отсутствующих
на диаграмме равновесия. В нек-рых
случаях на катоде осаждаются аморфные
системы - т. наз. металлич. стекла.
Соосаждение с металлом разл. примесей
может происходить не только в результате
совместного разряда ионов (напр.,
водорода, фосфора или серы), но и путем
захвата из р-ра заряженных частиц и
нейтральных молекул ПАВ. Включение в
растущий осадок крупных неметаллич.
частиц (А12О3,
MoS2,
алмаза и др.) приводит к образованию
композиц. покрытий, к-рые м. б. использованы
в качестве абразивных или антифрикц.
покрытий. Э. металлов и сплавов используется
для придания пов-сти изделия особых
физ.-мех. св-в: магнитных (изготовление
магнитопроводов и магн. экранов, нанесение
рабочих слоев на диски элементов памяти
ЭВМ), электрических (токонесущие слои
волноводов и печатных плат, элементы
сопротивлений и нагревателей), высокой
твердости, сопротивления износу, отражат.
способности, а также для покрытия
контактов с низким переходным
сопротивлением.
№72
Коррозия металла
Коррозия металлов Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии. Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов. Химическая коррозия Химическая коррозия — взаимодействие поверхности металла с (коррозионно-активной) средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом: 4Fe + 3O2 → 2Fe2O3 При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде). Электрохимическая коррозия Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т.п. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды - либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т.п., электропроводность ее повышается, и скорость процесса увеличивается. При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки. Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём лужения или оцинковки - олово или цинк имеют более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а олово или цинк должны корродировать. Однако в связи с образованием на поверхности олова или цинка окисной плёнки процесс коррозии сильно замедляется.
1.1 Классификация коррозионных процессов.
1. По механизму процесса различают химическую и электрохимическую коррозию металла.
Химическая коррозия - это взаимодействие металлов с коррозионной средой, при котором окисляется металл и восстанавливается окислительные компоненты коррозионной среды протекают в одном акте. Так протекает окисление большинства металлов в газовых средах содержащих окислитель (например, окисление в воздухе при повышении температуры)
Электрохимическая коррозия - это взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительной компоненты среды происходит не водном акте, и их скорости зависят от электродного потенциала
металла. По такому процессу протекают, например, взаимодействие металла с кислотами:
эта суммарная реакция состоит из двух актов:
2. По характеру коррозионного разрушения.
Общая или сплошная коррозия при которой коррозирует вся поверхность металла. Она соответственно делится на равномерную (1а), не равномерную (1б) и избирательную (1в), при которой коррозионный процесс распространяется преимущественно по какой-либо структурной составляющей сплава.
Местная коррозия при которой коррозируют определенные участки металла:
а) коррозия язвами - коррозионные разрушения в виде отдельных средних и больших пятен (коррозия латуни в морской воде)
б) межкристаллическая коррозия при ней процесс коррозии распространяется по границе металл-сплав (алюминий сплавляется с хромоникелем) и другие виды коррозии.
3. По условиям протекания процесса.
а) Газовая коррозия - это коррозия в газовой среде при высоких температурах. (жидкий металл, при горячей прокатке, штамповке и др.)
б) Атмосферная коррозия - это коррозия металла в естественной атмосфере или атмосфере цеха (ржавление кровли, коррозия обшивки самолета).
в) Жидкостная коррозия - это коррозия в жидких средах: как в растворах электролитов, так и в растворах не электролитов.
г) Подземная коррозия - это коррозия металла в почве
д) Структурная коррозия - коррозия из-за структурной неоднородности металла.
е) Микробиологическая коррозия - результат действия бактерий
ж) Коррозия внешним током - воздействие внешнего источника тока (анодное или катодное заземление)
з) Коррозия блуждающими токами - прохождение тока по непредусмотренным путям по проекту.
и) Контактная коррозия - сопряжение разнородных электрохимических металлов в электропроводящей среде.
к) Коррозия под напряжением - одновременное воздействие коррозионной среды и механического напряжения.
№73
Термодинамическая возможность электрохимической коррозии металлов
Принципиальная возможность или невозможность самопроизвольного протекания процесса электрохимической коррозии металла, так же как и химической коррозии, определяется знаком изменения свободной энергии процесса. Возможно самопроизвольное протекание только коррозионных процессов, которое сопровождается убылью изобарно-изотермического потенциала, т.е. ΔGТ < 0. При электрохимической коррозии металлов для расчетов более удобно пользоваться электрохимическими данными – электродными потенциалами. Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие
ΔGТ = -nEТF < 0 (330)
где ΔGТ - изменение изобарно-изотермического потенциала данного коррозионного процесса, кал/г-атом Me; n - число грамм-эквивалентов; ЕТ = (Vк) oбр - (Vа) обр - э.д.с. гальванического элемента, в котором обратимо осуществляется данный коррозионный процесс, В; (Vк) oбр - обратимый потенциал катодной реакции в данных условиях, В; (Vа) обр = (VMe) обр - обратимый потенциал металла в данных условиях (для сплавов - обратимый потенциал анодной составляющей сплава в данных условиях, В; F = 23062 кал/г-экв – число Фарадея.
Принципиальная возможность протекания процесса электрохимической коррозии металла определяется, таким образом, соотношением обратимого потенциала металла в данных условиях и обратимого потенциала катодного процесса в данных условиях.
Самопроизвольное протекание электрохимического коррозионного процесса возможно, если
(Vа) обр = (VMe) обр < (Vк) oбр (331)
т.е. для электрохимического растворения металла необходимо присутствие в электролите окислителя — деполяризатора, обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях. При соблюдении этого условия ЕТ > 0, a ΔGТ < 0.
