- •Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
- •Закон постоянства состава. Впервые сформулировал ж.Пруст (1808 г).
- •Закон кратных отношений (д.Дальтон, 1803 г.)
- •Закон объемных отношений (Гей-Люссак, 1808 г.)
- •Закон Авогадро ди Кваренья(1811 г.)
- •3.2.3 Способы образования ковалентной связи
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов
- •1.4. Коррозионные гальванические элементы и причины их возникновения
3.2.3 Способы образования ковалентной связи
Существуют два главных способа образования ковалентной связи *.
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:
![]()
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей *, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулах * возбужденных атомов подчеркнуты подуровни *, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
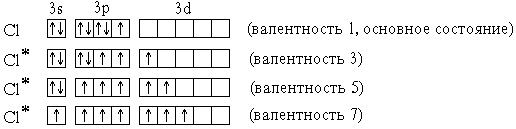
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образование иона аммония из молекулы аммиака и иона водорода можно отобразить схемой:
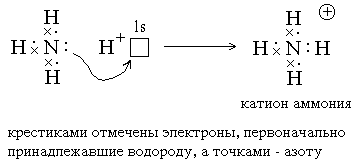
Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованным первым способом, поэтому термин “донорно-акцепторная” обозначает не какой-то особый вид связи, а лишь способ ее образования.
№39
Энергия химической связи
П рисоединение
электрона к атому происходит, когда
имеется выигрыш в энергии, или, другими
словами, если абсолютное
значение потенциальной энергии системы
атом
+ электрон
возрастает в результате связи электрона
с атомом.
рисоединение
электрона к атому происходит, когда
имеется выигрыш в энергии, или, другими
словами, если абсолютное
значение потенциальной энергии системы
атом
+ электрон
возрастает в результате связи электрона
с атомом.
С точки зрения выигрыша в энергии, образование связи - это нечто вроде промежуточного процесса между присоединением электрона к нейтральному атому (измеренное сродство к электрону) и присоединением электрона к атому, заряд ядра которого увеличивается на 1 единицу.
Чтобы оценить энергию химической связи молекул, состоящих из многоэлектронных атомов, необходимо оценить:
энергию связи связывающих электронов с ядрами,
заряд ядра многоэлектронного атома,
энергию межэлектронного отталкивания связывающих электронов от всех остальных электронов в молекуле.
Соотношение между энергией ионизации и зарядом ядра можно выразить следующим образом (см. раздел о энергии химической связи в атоме водорода):
EionZ = EionH Z2 , (4.3-1)
где EionZ и EionH - это энергия ионизации у водородоподобного атома и у атома с зарядом Z.
В случае с многоэлектронными атомами, значения зарядов ядер, используемые при вычислениях, не являются действительными зарядами ядер этих атомов. В таких вычислениях следует использовать так называемые эффективные заряды ядер (положительные заряды, которые действуют на связывающую электронную пару).
Аналогично уравнению (4.3-1), значение энергии межъядерного отталкивания, необходимое для оценки энергии молекулы, может быть также оценено с использованием эффективного заряда ядра с помощью выражения:
Erep eff = ErepH2 Zeff1 · Zeff2, (4.3-2)
где Erep eff - это эффективная энергия межъядерного отталкивания в молекуле, состоящей из двух атомов; ErepH2 - энергия отталкивания у молекулы H2; Zeff1 и Zeff2 - эффективные заряды ядер первого и второго атомов с учетом межядерного отталкивания.
Мы рассчитали энергию химической связи двухатомных молекул, состоящих из атомов и нескольких электронов как одноэлектронных атомов или водородоподобных атомов с зарядом ядра, равным эффективному заряду ядра этих молекул.
Для определения изменения электронной энергии при образовании молекулы из однотипных атомов, также как в случае с молекулой водорода, мы вычитаем энергию двух атомов от энергии молекулы и получаем, что эта энергия равна энергии связи в молекуле.
Рассмотрим раскладку сил в молекуле >>
Теперь мы можем вернуться объяснению энергии связи для группы D таблицы 4.4. >>
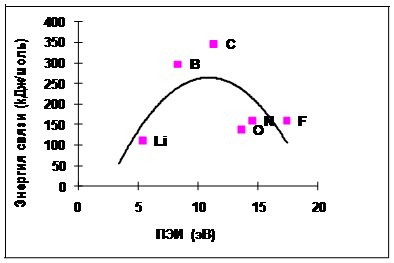
Рис. 4.3-2 Экспериментальные данные по зависимости энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов второго периода
На рис. 4.3-2 и 4.3-3 показана зависимость энергии химической связи от ПЭИ атомов, составляющих эти молекулы.
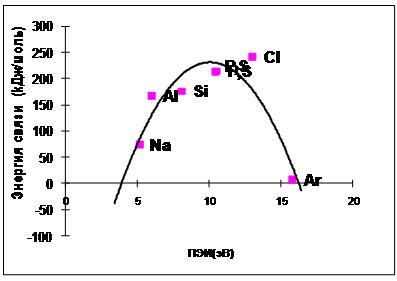
Рис.4.3-3 Зависимость энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов третьего периода (расчетные данные и экспериментальные).
Предполагалось,
что энергия химической связи и ПЭИ
(обе определяемые электростатическим
взаимодействием) коррелируют между
собой. Однако, расчетная зависимость
энергии имеет форму
![]() параболы.
То есть, когда ПЭИ увеличивается с 5 до
11 эВ [от лития (Li) к углероду (C)], увеличивается
энергия химической связи, а при
дальнейшем увеличении ПЭИ с 11 до 20 эВ,
энергия связи уменьшается.
параболы.
То есть, когда ПЭИ увеличивается с 5 до
11 эВ [от лития (Li) к углероду (C)], увеличивается
энергия химической связи, а при
дальнейшем увеличении ПЭИ с 11 до 20 эВ,
энергия связи уменьшается.
Согласно экспериментальным данным, энергия связи атомов также увеличивается на интервале с 5 до 11 эВ, но при дальнейшем увеличении ПЭИ от 11 до 16 падает до 0.
Очередное совпадение экспериментальной и расчетной зависимостей говорит о корректности объяснений природы химической связи.
Длина химической связи
Д лины
химической связи были
определены экспериментально для
огромного числа молекул.
лины
химической связи были
определены экспериментально для
огромного числа молекул.
В большинстве случаев - чем больше энергия связи, тем меньше длина связи.
Энергии связей для молекул NaF, NaCl и NaBr из таблицы 4.2 составляют 476 кДж/моль, 412 кДж/моль и 368 кДж/моль соответственно. Длины химических связей в этих соединениях будут соответственно 1.9 Å, 2.3 Å и 2.5 Å. В этом случае, зависимость между энергией связи и длиной выражается ожидаемой закономерностью: чем сильнее связь, тем она короче; чем сильнее атомы притягиваются друг к другу, тем короче расстояние между ними.
Аналогично, энергии связей Li-Li, Na-Na, K-K составляют 110 кДж/моль, 72 кДж/моль и 49 кДж/моль, тогда как длины химических связей Li-Li, Na-Na, K-K равны 2.7 Å, 3.08 Å, и 3.9 Å соответственно. Энергия одинарной связи C-C составляет 347 кДж/моль, в то время как ее длина равна 1.54 Å, т.е. меньше, чем длина связи Li -Li, энергия которой равна 110 кДж/моль.
Однако, для некоторых молекул (таблица 4.2) эта ожидаемая зависимость меняется на противоположную (парадоксальную) зависимость, что требует объяснения ПОЧЕМУ:
Согласно экспериментальным данным энергии связей C-C, Cl-Cl и F-F составляют 347 кДж/моль, 239 кДж/моль и 158 кДж/моль, тогда так длины связей в ряду C-C, Cl-Cl, F-F составляют 1.54 Å, 2 Å и 1.4 Å соответственно. Сначала длина химической связи увеличивается, а затем уменьшается.
Эта аномалия не является случайностью. На рисунке 4.4-1 мы видим определенные экспериментально зависимости длин одинарных связей от ПЭИ для элементов 2-го и 3-его периодов.
Кривая на рисунке 4.4-1 показывает, что длина одинарных связей в молекулах типа Li2-F2 и Na2 - Cl2 уменьшаются с увеличением ПЭИ связываемых атомов.
Зависимость энергии одинарной связи между идентичными атомами элементов 2-го и 3-го периодов от ПЭИ связываемых атомов и выражается гиперболой. |
Согласно экспериментальным данным, длины химических связей уменьшались с ростом ПЭИ связываемых атомов. То есть, парадоксальная зависимость, отмеченная выше, не была случайностью.
Такое простое умозаключение: чем сильнее связь, тем ближе атомы друг к другу оказалось несостоятельным для зависимостей, которые были определены экспериментально. Зависимости, полученные экспериментальным путем, качественным образом противоречат основным принципам теории образования химических связей. Однако, наполовину количественная оценка ожидаемых зависимостей на базе решения системы алгебраических уравнений показала, что парадоксальные зависимости в действительности закономерны и логичны.
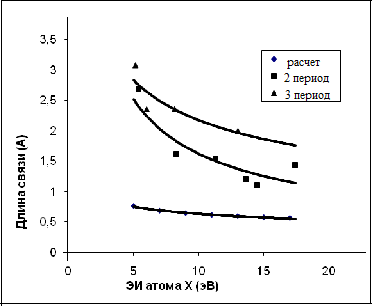
Рисунок 4.4-1 Зависимость длины химической связи в молекуле Х-Х от ЭИ атома Х для второго и третьего периодов (1- расчетный ряд и экспериментальные данные - для 2 и 3 периода)
Расчеты на основании системы уравнений 4.3-3 и 4.3-4 показывают, что зависимость длины химической связи от ПЭИ, также как и в эксперименте, выражается гиперболой.
В соответствии с вычислениями, сделанными посредством тех же уравнений, где зависимость энергии связи от ПЭИ связываемых атомов является параболой. Следовательно, рассматриваемые зависимости энергии связи и ее длины от ПЭИ (которые, на первый взгляд, казались парадоксальными по отношению друг к другу и к теории) в результате их полуколичественной оценки на основании решения системы уравнений (более фундаментальный подход со второго взгляда) совпали.
На рисунке 4.4-1 представлены три кривые зависимости длины химической связи от энергии ионизации. Все три кривые являются гиперболами, хотя и сильно отличаются по абсолютным значениям.
В чем же объяснение?
Сильное различие в абсолютных величинах имеет простое объяснение. Как уже указывалось, в ходе вычислений предполагалось, что атомы X в молекуле (X-X) подобны водороду, то есть, они имеют только один электрон, вращающийся в одном единственном слое. В действительности атомы всех периодов (кроме 1-го - водорода и гелия) содержат внутренние электронные слои.
С другой стороны, может быть не понятно то, как образуются молекулы вида HF, HCl (где атомы водорода связаны с атомами других периодов). Аномальные свойства молекулы H-X давно известны в химии. В рамках данной модели они объяснены в книге «XXI век. Общая химия».
№41
Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
|
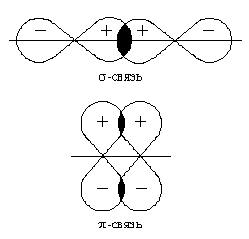
После образования между двумя атомами -связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p-связь. Она менее прочна, чем -связь: перекрывание происходит диффузными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну -связь. Число -связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Например, в молекуле NH3 и ионе NH4+ для атома азота оно равно трем и четырем. Образование -связей фиксирует пространственное положение атомов относительно друг друга, поэтому число -связей и углы между линиями связи, которые называются валентными углами, определяют пространственную геометрическую конфигурацию молекул.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций * электронов. При перекрывании облаков с одинаковыми знаками волновых функций электронная плотность в пространстве между ядрами возрастает. В этом случае происходит положительное перекрывание, приводящее к взаимному притяжению ядер. Если знаки волновых функций противоположны, то плотность электронного облака уменьшается (отрицательное перекрывание), что приводит к взаимному отталкиванию ядер.
Поляризуемость рассматривают на основе представлений о том, что ковалентная связь может быть неполярной (чисто ковалентной) или полярной *.
Важными характеристиками химической связи являются также ее длина и кратность. Длина связи определяется расстоянием между ядрами связанных атомов в молекуле. Как правило, длина химической связи меньше, чем сумма радиусов атомов, за счет перекрывания электронных облаков. Кратность связи определяется количеством электронных пар, связывающих два атома, например:
этан H3C–CH3 одинарная связь (-связь)
этилен H2C=CH2 двойная связь (одна -связь и одна -связь)
ацетилен HCCH тройная связь (одна -связь и две -связи).
С увеличением кратности возрастает энергия связи, однако это возрастание не пропорционально кратности, т.к. -связи менее прочны, чем -связь.
№43
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s-связью. -Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
После образования между двумя атомами -связи для остальных электронных облаков той же формы и с тем же главным квантовым числом * остается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p-связь. Она менее прочна, чем -связь: перекрывание происходит диффузными боковыми частями орбиталей. Каждая кратная связь (например, двойная или тройная) всегда содержит только одну -связь. Число -связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Например, в молекуле NH3 и ионе NH4+ для атома азота оно равно трем и четырем. Образование -связей фиксирует пространственное положение атомов относительно друг друга, поэтому число -связей и углы между линиями связи, которые называются валентными углами, определяют пространственную геометрическую конфигурацию молекул.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций * электронов. При перекрывании облаков с одинаковыми знаками волновых функций электронная плотность в пространстве между ядрами возрастает. В этом случае происходит положительное перекрывание, приводящее к взаимному притяжению ядер. Если знаки волновых функций противоположны, то плотность электронного облака уменьшается (отрицательное перекрывание), что приводит к взаимному отталкиванию ядер.
При образовании молекулы электронные облака изменяют свою форму. Например вместо неравноценных s- и p-электронных облаков могут образовываться равноценные гибридные (смешанные) электронные облака.
В результате гибридизации электронные облака приобретают более вытянутую форму. Это обеспечивает большее их перекрывание и, следовательно, увеличивает энергию ковалентной связи. Выигрыш энергии превышает затраты ее на осуществление гибридизации электронных орбиталей.
Из s- и p-орбитали образуются 2 гибридные sp-орбитали, вытянутые в противоположных направлениях. В зависимости от числа и типа орбиталей, участвующих в гибридизации, взаимное расположение гибридных орбиталей в пространстве будет различным.
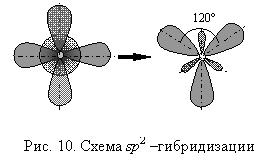
Если в гибридизации принимают участие 1 s- и 2 p-орбитали (sp2-гибридизация), то образуются 3 равноценные гибридные орбитали, располагающиеся в одной плоскости и ориентированные друг относительно друга под углом 120 град.
При гибридизации типа sp3, в которой принимает участие 1 s- и 3 p-орбитали, образующиеся равноценные 4 орбитали вытянуты в направлениях к вершинам тетраэдра.
У атомов элементов III и последующих периодов, имеющих d-орбитали, в гибридизации часто принимают участие 2 d-, 1 s- и 3 p-орбитали (sp3d2-гибридизация). В этом случае образуется шесть равноценных гибридных орбиталей, направленных к вершинам октаэдра.
Cвязи осуществляются за счет перекрывания как гибридизованных, так и негибридизованных орбиталей, π-связи - исключительно за счет перекрывания негибридизованных орбиталей. Направленность σ-связей обусловливает структуру молекулы. Одинарная связь между атомами - всегда σ-связь. В молекулах, содержащих кратные связи, одна σ-связь, а остальные - π-связи. Например, в молекуле азота, имеющей тройную связь (:NΞN:), содержится 1 σ- и 2 π-связи.
№45
Пространственная конфигурация молекул
Если на внешней оболочке атома имеются два электрона, один в s- состоянии а другой в р- состоянии, то при затрате некоторой энергии вместо исходных s- и р- орбиталей могут образоваться две гибридные sp- орбитали (рис. 9). Они вытянуты вдоль прямой в противоположных направлениях.
Б лагодаря
вытянутой форме гибридных
орбиталей,
достигается более полное перекрывание
взаимодействующих электронных облаков,
а значит, образуются более прочные
химические
связи.
Энергия, выделяющаяся при образовании
этих связей больше, чем суммарные затраты
энергии на возбуждение атома и гибридизацию
его атомных орбиталей. Т.к. sp-
орбитали ориентированы в противоположных
направлениях, то структура молекулы
линейная и валентный
угол
равен 180°. Связующее электронное облако
расположено симметрично между атомами
и молекула является неполярной, в тоже
время связь в молекуле всегда обладает
направленностью и является полярной.
Такую пространственную конфигурацию
будут иметь молекулы элементов II
группы: MgBr2,
СаН2,
ВаF2.
лагодаря
вытянутой форме гибридных
орбиталей,
достигается более полное перекрывание
взаимодействующих электронных облаков,
а значит, образуются более прочные
химические
связи.
Энергия, выделяющаяся при образовании
этих связей больше, чем суммарные затраты
энергии на возбуждение атома и гибридизацию
его атомных орбиталей. Т.к. sp-
орбитали ориентированы в противоположных
направлениях, то структура молекулы
линейная и валентный
угол
равен 180°. Связующее электронное облако
расположено симметрично между атомами
и молекула является неполярной, в тоже
время связь в молекуле всегда обладает
направленностью и является полярной.
Такую пространственную конфигурацию
будут иметь молекулы элементов II
группы: MgBr2,
СаН2,
ВаF2.
 Рассмотрим
пространственную структуру молекул
элементов III
группы. Химическая связь образуется за
счет s–электрона
и двух p–электронов
внешнего энергетического уровня.
Возникающее явление sp2–гибридизации,
приводит к образованию трех равноценных
гибридных орбиталей, ориентированных
в пространстве под углом 120° (рис. 10).
Все три связи равноценны и имеют
направление к более электроотрицательному
элементу. Образуемые элементами III
группы молекулы имеют структуру плоского
треугольника. Дипольный момент таких
молекул равен 0 и молекула неполярна.
Валентный
угол
составляет 120°. Аналогичные структуры
у молекул GaCl3,
InBr3,
TeI3.
Рассмотрим
пространственную структуру молекул
элементов III
группы. Химическая связь образуется за
счет s–электрона
и двух p–электронов
внешнего энергетического уровня.
Возникающее явление sp2–гибридизации,
приводит к образованию трех равноценных
гибридных орбиталей, ориентированных
в пространстве под углом 120° (рис. 10).
Все три связи равноценны и имеют
направление к более электроотрицательному
элементу. Образуемые элементами III
группы молекулы имеют структуру плоского
треугольника. Дипольный момент таких
молекул равен 0 и молекула неполярна.
Валентный
угол
составляет 120°. Аналогичные структуры
у молекул GaCl3,
InBr3,
TeI3.
При образовании молекул элементами IV группы главной подгруппы валентные электроны подвергаются sp3–гибридизации (рис. 11). Гибридная орбиталь способна к более сильному перекрыванию с орбиталями других атомов и образованию более прочных связей. Гибридные орбитали расположены в пространстве под углом 109°28’ и направлены к вершинам тетраэдра. Аналогичное строение имеют молекулы SiCl4, GeF4 СН4 и т. п.
М олекулы
элементов V
группы главной подгруппы NH3,
PH3,
AsH3
используют
для связей три неспаренных р–электрона,
находящихся на взаимно перпендикулярных
орбиталях. Но результаты экспериментальных
измерений показывают, что угол между
связями в молекуле NH3
отличен
от 90°
и
составляет 108° (рис. 12).
Полагают, что имеет место sp3–гибридизация
и из четырех гибридных орбиталей одна
занята неподеленной электронной парой.
Она влияет на связующие электронные
пары, отталкивая их и угол отличается
от тетраэдрического (109°). Молекулы имеют
структуру тригональной пирамиды.
Молекула является полярной.
олекулы
элементов V
группы главной подгруппы NH3,
PH3,
AsH3
используют
для связей три неспаренных р–электрона,
находящихся на взаимно перпендикулярных
орбиталях. Но результаты экспериментальных
измерений показывают, что угол между
связями в молекуле NH3
отличен
от 90°
и
составляет 108° (рис. 12).
Полагают, что имеет место sp3–гибридизация
и из четырех гибридных орбиталей одна
занята неподеленной электронной парой.
Она влияет на связующие электронные
пары, отталкивая их и угол отличается
от тетраэдрического (109°). Молекулы имеют
структуру тригональной пирамиды.
Молекула является полярной.
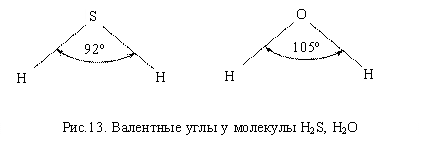 Молекулы
элементов VI
группы имеют угловую пространственную
структуру, что обусловлено наличием
двух неспаренных р–электронов,
участвующих в образовании химических
связей. Валентный
угол
у таких молекул составляет примерно
90°. Отклонения валентного угла от 90°
объясняют эффектом взаимного отталкивания
неподеленных пар электронов. Образуются
полярные молекулы, так как результирующая
векторов связей отлична от нуля (рис.
13).
Молекулы
элементов VI
группы имеют угловую пространственную
структуру, что обусловлено наличием
двух неспаренных р–электронов,
участвующих в образовании химических
связей. Валентный
угол
у таких молекул составляет примерно
90°. Отклонения валентного угла от 90°
объясняют эффектом взаимного отталкивания
неподеленных пар электронов. Образуются
полярные молекулы, так как результирующая
векторов связей отлична от нуля (рис.
13).
Гибридизация атомных орбиталей
Для объяснения отличия валентных углов в молекулах H2O (104,5) и NH3 (107,3) от 90 следует принять во внимание, что устойчивому состоянию молекулы отвечает ее геометрическая структура с наименьшей потенциальной энергией. Поэтому при образовании молекулы форма и взаимное расположение атомных электронных облаков * изменяется по сравнению с их формой и расположением в свободных атомах. В результате достигается более полное перекрывание орбиталей * при образовании химической связи. Такая деформация электронных облаков требует затраты энергии, но более полное перекрывание приводит к образованию более прочной связи, и в целом получается выигрыш в энергии. Этим и объясняется возникновение гибридных орбиталей.
Форма гибридной орбитали может быть определена математически путем сложения волновых функций * исходных орбиталей:
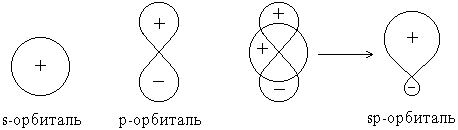
В результате сложения волновых функций s- и p-орбиталей с учетом их знаков оказывается, что плотность электронного облака (величина 2) по одну сторону от ядра повышена, а по другую – понижена.
В целом процесс гибридизации включает следующие этапы: возбуждение атома *, гибридизация орбиталей возбужденного атома, образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями. Тип гибридизации определяется типом и количеством участвующих в ней орбиталей.
Ниже рассмотрены примеры различных видов гибридизации s- и p-орбиталей.
Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании галогенидов бериллия, цинка, кадмия и ртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон. При образовании химической связи * эти две различные орбитали преобразуются в две одинаковые гибридные орбитали (sp-орбитали), направленные под углом 180 друг к другу, – две связи имеют противоположное направление (рисунок 3.5).
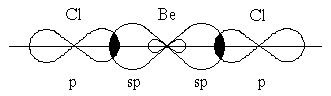
Рисунок 3.5 – Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2
Экспериментальное определение структуры молекул BeГ2, ZnГ2, CdГ2, HgГ2 (Г–галоген) показало, что эти молекулы являются линейными, и обе связи металла с атомами галогена имеют одинаковую длину.
Гибридизация одной s- и двух p-орбиталей (sp2-гибридизация) имеет место, например, при образовании соединений бора. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя p-электронами. Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120 друг к другу (рисунок 3.6). Действительно, как показывают экспериментальные исследования, молекулы таких соединений бора, как BГ3 (Г-галоген), B(CH3)3 – триметилбор, B(OH)3 – борная кислота, имеют плоское строение. При этом три связи бора в указанных молекулах имеют одинаковую длину и расположены под углом 120.
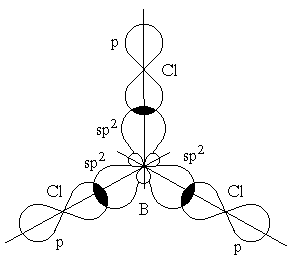
Рисунок 3.6 – Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3
Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. В этом случае четыре гибридные sp3-орбитали расположены под углом 10928 друг к другу; они направлены к вершинам тетраэдра (в молекулах CH4, CCl4, SiH4, GeBr4 и др.). Валентные углы в молекулах H2O (104,5) и NH3 (107,3) не точно соответствуют взаимному расположению “чистых” p-орбиталей (90). Это обусловлено некоторым вкладом s-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация. Валентные электроны в этих молекулах занимают четыре орбитали, которые близки к sp3-гибридным. Незначительное отличие валентных углов от тетраэдрических 10928 объясняется тем, что гибридизация в данном случае является неполной.
Во многих молекулах центральный атом не подвергается гибридизации. Так, валентные углы в молекулах H2S, PH3 и др. близки к 90, т.е. образование связей происходит с участием “чистых” p-орбиталей, расположенных под прямым углом друг к другу.
Металлическая связь, химическая связь, обусловленная взаимодействием электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллической решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетических уровней, называемых зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическую связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
При
сближении двух атомов
металла, например Li, образуется ковалентная
связь, при этом происходит расщепление
каждого энергетич. уровня валентного
электрона на два. Когда N
атомов
Li образуют кристаллическую решетку,
перекрывание электронных облаков
соседних атомов
приводит к тому, что каждый энергетич.
уровень валентного электрона расщепляется
на N
уровней,
расстояния между которыми из-за большой
величины N
настолько
малы, что их совокупность может считаться
практически непрерывной зоной
энергетических уровней, имеющей конечную
ширину. Поскольку каждый атом участвует
в образовании большего числа связей,
чем, например, в двухатомной молекуле
при том же числе валентных электронов,
то минимум энергии системы (или максимум
энергии связи) достигается при расстояниях
больших, чем в случае двухцентровой
связи в молекуле. Межатомные расстояния
в металлах
заметно больше, чем в соед. с ковалентной
связью (металлич. радиус атомов
всегда больше ковалентного радиуса), а
координационное число (число ближайших
соседей) в кристаллических решетках
металлов обычно 8 или больше 8. Для
наиболее часто встречающихся
кристаллических структур координационные
числа равны 8 (объемноцентрированная
кубическая), 12 (гранецентрированная
кубическая и гексагональная
плотно-упакованная). Расчеты параметров
металлических решеток с использованием
ковалентных радиусов дают заниженные
результаты. Так, расстояние между атомами
Li в молекуле Li2
(ковалентная связь) равно 0,267 нм, в металле
Li-0,304 нм. Каждый атом Li в металле имеет
8 ближайших соседей, а на расстоянии, в
![]() раз
большем,-еще 6. Энергия связи в расчете
на один атом Li в результате увеличения
числа ближайших соседей увеличивается
с 0,96.10-19
Дж для Li2
до 2,9.10-19
Дж для кристаллич. Li.
раз
большем,-еще 6. Энергия связи в расчете
на один атом Li в результате увеличения
числа ближайших соседей увеличивается
с 0,96.10-19
Дж для Li2
до 2,9.10-19
Дж для кристаллич. Li.
Во многих металлах металлическая связь между атомами включает вклады ионной или ковалентной составляющей. Особенности металлической связи у каждого металла могут быть связаны, например, с электростатическим отталкиванием ионов друг от друга с учетом распределения электрических зарядов в них, с вкладом в образование связи электронов внутренних незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и некоторыми другими причинами.
№47
Металлическая связь, химическая связь, обусловленная взаимодействием электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллической решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентными электронами металла зон энергетических уровней, называемых зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическую связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
При сближении двух атомов металла, например Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетич. уровня валентного электрона на два. Когда N атомов Li образуют кристаллическую решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется на N уровней, расстояния между которыми из-за большой величины N настолько малы, что их совокупность может считаться практически непрерывной зоной энергетических уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, например, в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич. радиус атомов всегда больше ковалентного радиуса), а координационное число (число ближайших соседей) в кристаллических решетках металлов обычно 8 или больше 8. Для наиболее часто встречающихся кристаллических структур координационные числа равны 8 (объемноцентрированная кубическая), 12 (гранецентрированная кубическая и гексагональная плотно-упакованная). Расчеты параметров металлических решеток с использованием ковалентных радиусов дают заниженные результаты. Так, расстояние между атомами Li в молекуле Li2 (ковалентная связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет 8 ближайших соседей, а на расстоянии, в раз большем,-еще 6. Энергия связи в расчете на один атом Li в результате увеличения числа ближайших соседей увеличивается с 0,96.10-19 Дж для Li2 до 2,9.10-19 Дж для кристаллич. Li.
Во многих металлах металлическая связь между атомами включает вклады ионной или ковалентной составляющей. Особенности металлической связи у каждого металла могут быть связаны, например, с электростатическим отталкиванием ионов друг от друга с учетом распределения электрических зарядов в них, с вкладом в образование связи электронов внутренних незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и некоторыми другими причинами.
№49
Степень окисления
Степень окисления - (окислительное число) , условный показатель, характеризующий заряд атома в соединениях. В молекулах с ионной связью совпадает с зарядом иона, напр. в NaCl степень окисления натрия +1, хлора -1. В ковалентных соединениях за степень окисления принимают заряд, который получил бы атом, если бы все пары электронов, осуществляющие химическую связь, были целиком перенесены к более электроотрицательным атомам, напр. в HCl степень окисления водорода +1, хлора ?1. Понятие степень окисления используется, напр., при составлении уравнений окислительно-восстановительных реакций. ;
ВАЖНЕЙШИЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Пределы окисления и восстановления элемента выражаются максимальным и минимальным значениями степеней окисления *. В этих крайних состояниях, определяемых положением в таблице Менделеева, элемент имеет возможность проявить только одну функцию – окислителя или восстановителя. Соответственно и вещества, содержащие элементы в этих степенях окисления, являются только окислителями (HNO3, H2SO4, HClO4, KMnO4, K2Cr2O7 и др.) или только восстановителями (NH3, H2S, галогеноводороды, Na2S2O3 и др.). Вещества, содержащие элементы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями (HClO, H2O2, H2SO3 и др.).
Окислительно-восстановительные реакции разделяются на три основных типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К первому типу относятся процессы, в которых атомы элемента-окислителя и элемента-восстановителя входят в состав разных молекул (примеры см. в разделе 6.1).
Внутримолекулярными называются реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы. Например, термическое разложение хлората калия по уравнению:
2 KClO3 2 KCl + 3 O2
Реакциями диспропорционирования называют процессы, в которых окислителем и восстановителем является один и тот же элемент в одной и той же степени окисления, которая в реакции одновременно как снижается, так и повышается, например:
3 HClO HClO3 + 2 HCl
Возможны также реакции обратного диспропорционирования. К ним относятся внутримолекулярные процессы, в которых окислителем и восстановителем является один и тот же элемент, но в виде атомов, находящихся в разной степени окисления и выравнивающих ее в результате реакции, например:
NH4NO2 N2 + 2 H2O.
ОБЩИЕ ПОНЯТИЯ. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Окислительно-восстановительными называют процессы, которые, в отличие от реакций обмена, сопровождаются смещением электронов от одних свободных или связанных атомов к другим. Поскольку в таких случаях имеет значение не степень смещения, а только число смещенных электронов, то принято условно считать смещение всегда полным и говорить об отдаче или смещении электронов.
Если атом или ион элемента отдает или принимает электроны, то в первом случае степень окисления элемента повышается, и он переходит в окисленную форму (ОФ), а во втором – понижается, и элемент переходит в восстановленную форму (ВФ). Обе формы составляют сопряженную окислительно-восстановительную пару. В каждой окислительно-восстановительной реакции участвуют две сопряженные пары. Одна из них соответствует переходу окислителя, принимающего электроны, в его восстановленную форму (ОФ1ВФ1), а другая – переходу восстановителя, отдающего электроны, в его окисленную форму (ВФ2ОФ2), например:
Cl2 + 2 I– 2 Cl– + I2
ОФ1 ВФ1 ВФ2 ОФ2
(здесь Cl2 – окислитель, I– – восстановитель)
Таким образом, одна и та же реакция всегда является одновременно процессом окисления восстановителя и процессом восстановления окислителя.
Коэффициенты в уравнениях окислительно-восстановительных реакций могут быть найдены методами электронного баланса и электронно-ионного баланса. В первом случае число принятых или отданных электронов определяется по разности степеней окисления элементов в исходном и конечном состояниях. Пример:
HN5+O3 + H2S2– N2+O + S + H2O
В этой реакции степень окисления меняют два элемента: азот и сера. Уравнения электронного баланса:
N5+ + 3e N2+ |
2 |
S2– – 2e S0 |
3 |
Справа от вертикальной черты ставятся коэффициенты, уравнивающие число принятых и отданных электронов. Найденные коэффициенты переносятся в уравнение реакции:
2 HNO3 + 3 H2S 2 NO + 3 S + 4 H2O
Уравнения электронного баланса формальны и не дают представления о характере частиц, реально существующих и взаимодействующих в растворах. Этого недостатка лишен метод электронно-ионного баланса, который называется также методом полуреакций. В этом случае во внимание принимаются не отдельные атомы, а частицы, в состав которых они входят:
NO3– + 4H+ + 3e NO + 2 H2O |
2 |
H2S – 2e S + 2 H+ |
3 |
Доля диссоциированных молекул H2S незначительна, поэтому в уравнение подставляется не ион S2–, а молекула H2S. Вначале уравнивается баланс частиц. При этом в кислой среде для уравнивания используются ионы водорода, добавляемые к окисленной форме, и молекулы воды, добавляемые к восстановленной форме. Затем уравнивается баланс зарядов, и справа от черты указываются коэффициенты, уравнивающие количество отданных и принятых электронов. После этого внизу записывается суммарное уравнение с учетом коэффициентов:
NO3– + 4H+ + 3e NO + 2 H2O |
2 |
H2S – 2e S + 2 H+ |
3 |
2 NO3– + 8 H+ + 3 H2S 2 NO + 4 H2O + 3 S + 6 H+ |
|
2 NO3– + 2 H+ + 3 H2S 2 NO + 4 H2O + 3 S |
|
В суммарном уравнении исключается равное число одинаковых частиц, находящихся как в левой, так и в правой части равенства. Таким образом получается ионно-молекулярное уравнение реакции, от которого легко перейти к молекулярному.
В щелочной среде баланс частиц уравнивается ионами OH–, добавляемыми к восстановленной форме, и молекулами воды, добавляемыми к окисленной форме. Например:
NaNO2 + KMnO4 + KOH NaNO3 + K2MnO4 + H2O
NO2– + 2 OH– – 2e NO3– + H2O |
1 |
MnO4– + e MnO42– |
2 |
NO2– + 2 OH– + 2 MnO4– NO3– + H2O + 2 MnO42– |
|
Получили сокращенное ионно-молекулярное уравнение. Добавив к нему ионы Na+ и K+, получим аналогичное уравнение в полной форме, а также молекулярное уравнение:
NaNO2 + 2 KMnO4 + 2 KOH NaNO3 + 2 K2MnO4 + H2O
В нейтральной среде баланс частиц уравнивается путем добавления молекул воды в левую часть полуреакций, а в правую часть добавляются ионы H+ или OH–:
I2 + Cl2 + H2O HIO3 + HCl
Исходные вещества не являются кислотами или основаниями, поэтому в начальный период протекания реакции среда в растворе близка к нейтральной. Уравнения полуреакций:
I2 + 6 H2O + 10e 2 IO3– + 12 H+ |
|
Cl2 + 2e 2 Cl– |
5 |
I2 + 5 Cl2 + 6 H2O 2 IO3– + 12 H+ + 10 Cl– |
|
Уравнение реакции в молекулярной форме:
I2 + 5 Cl2 + 6 H2O 2 HIO3 + 10 HCl.