
- •Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
- •Закон постоянства состава. Впервые сформулировал ж.Пруст (1808 г).
- •Закон кратных отношений (д.Дальтон, 1803 г.)
- •Закон объемных отношений (Гей-Люссак, 1808 г.)
- •Закон Авогадро ди Кваренья(1811 г.)
- •3.2.3 Способы образования ковалентной связи
- •Влияние среды на протекание окислительно-восстановительных реакций
- •Стандартные потенциалы окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов
- •1.4. Коррозионные гальванические элементы и причины их возникновения
№1
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений. Химические явления: одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется. Физические явления: меняется физическое состояние веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или образуются новые вещества с изменением состава ядер атомов.
Атомно - молекулярное учение.
1.Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
2.Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3.Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 117 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Массовое число Заряд ядра |
A Z |
Э |
63 29 |
Cu и |
65 29 |
Cu; |
35 17 |
Cl и |
37 17 |
Cl |
Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента. Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода.
1 а.е.м = 1/12 · m (12C) = 1,66057 · 10-24 г
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Ar(Mg) = 24,312 m (Mg) = 24,312·1,66057 · 10-24 = 4,037 · 10-23 г
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = mг / (1/12 mа(12C)) mr - масса молекулы данного вещества; mа(12C) - масса атома углерода 12C.
Mг = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 · 1023. (Постоянная Авогадро имеет размерность - моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m / n
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая - безразмерная.
M = NА · m(1 молекула) = NА · Mг · 1 а.е.м. = (NА · 1 а.е.м.) · Mг = Mг
Это
означает, что если масса некоторой
молекулы равна, например, 80 а.е.м. (SO3),
то масса одного моля молекул равна 80 г.
Постоянная Авогадро является коэффициентом
пропорциональности, обеспечивающим
переход от молекулярных соотношений к
молярным. Все утверждения относительно
молекул остаются справедливыми для
молей (при замене, в случае необходимости,
а.е.м. на г) Например, уравнение реакции:
2Na + Cl2![]() 2NaCl, означает, что два атома натрия
реагируют с одной молекулой хлора или,
что одно и то же, два моль натрия реагируют
с одним молем хлора.
2NaCl, означает, что два атома натрия
реагируют с одной молекулой хлора или,
что одно и то же, два моль натрия реагируют
с одним молем хлора.
Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи. В начале 20 века формулировка закона сохранения массы подверглась пересмотру в связи с появлением теории относительности (А.Эйнштейн, 1905 г.), согласно которой масса тела зависит от его скорости и, следовательно, характеризует не только количество материи, но и ее движение. Полученная телом энергия DE связана с увеличением его массы Dm соотношением DE = Dm · c2 , где с - скорость света. Это соотношение не используется в химических реакциях, т.к. 1 кДж энергии соответствует изменению массы на ~10-11 г и Dm практически не может быть измерено. В ядерных реакциях, где DЕ в ~106 раз больше, чем в химических реакциях, Dm следует учитывать. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава. Впервые сформулировал ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения. Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Массовая доля элементаw(Э) показывает, какую часть составляет масса данного элемента от всей массы вещества: где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
w(Э) = (n · Ar(Э)) / Mr
Закон кратных отношений (д.Дальтон, 1803 г.)
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
N2O N2O3 NO2(N2O4) N2O5
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1 : 3 : 4 : 5.
Закон объемных отношений (Гей-Люссак, 1808 г.)
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Закон Авогадро ди Кваренья(1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
Следствия.
Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так:
P1V1 / T1 = P2V2 / T2
И наоборот, из объединенного газового закона при P = const (P1 = P2) можно получить V1 / T1 = V2 / T2 (закон Гей-Люссака);
при Т= const (T1 = T2): P1V1 = P2V2 (закон Бойля-Мариотта);
при V = const P1 / T1 = P2 / T2 (закон Шарля).
№2
Лантаноиды
Лантаноиды (от лантан и греч. еidos — образ, вид), лантаниды, семейство из 14 химических элементов с атомным номером от 58 до 71, расположенных в 6-м периоде системы Менделеева вслед за лантаном (табл. 1). Л. и сходные с ними элементы скандий, иттрий и лантан образуют группу редкоземельных элементов (в литературе её обозначают сокращённо РЗЭ). Такое название объясняется тем, что все эти элементы встречаются редко и дают тугоплавкие, нерастворимые в воде окислы, по старинной терминологии, — "земли". Редкоземельные элементы входят в побочную подгруппу III группы периодической системы.
По химическим свойствам Л. весьма сходны между собой, что объясняется строением электронных оболочек их атомов: по мере увеличения заряда ядра структура двух внешних электронных оболочек не меняется, т.к. происходит заполнение электронами 3-й снаружи оболочки — глубоколежащего 4f-уровня. Максимально возможное число электронов на f-уровне равно 14, что определяет число элементов семейства Л. (см. также Актиноиды, Атом, Периодическая система элементов Д. И. Менделеева). Л. подразделяются на 2 подгруппы: цериевую, включающую церий Се, празеодим Pr, неодим Nd, прометий Pm, самарий Sm, европий Eu, и иттриевую, включающую гадолиний Gd, тербий Tb, диспрозий Dy, гольмий Но, эрбий Ег, тулий Tm, иттербий Yb, лютеций Lu. Это деление обусловлено периодичностью изменения некоторых свойств внутри семейства Л.; названия подгрупп возникли исторически.
Физические свойства. Л. — металлы серебристо-белого цвета (некоторые слегка желтоваты, например Pr и Nd). Кристаллическая структура большинства Л. — гексагональная плотноупакованная. Исключение составляют g-Ce и a-Yb (кубическая гранецентрированная), Sm (ромбоэдрическая), Eu — кубическая объёмноцентрированная. То обстоятельство, что при переходе от Се к Lu число электронов на двух внешних оболочках, как правило, не меняется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение электронов к ядру и приводит к так называемому лантаноидному сжатию; у нейтральных атомов Л. и ионов одинаковой валентности при увеличении атомного номера радиусы несколько уменьшаются. Температуры плавления у элементов подгруппы церия значительно ниже, чем у элементов подгруппы иттрия.
Л. высокой чистоты пластичны и легко поддаются деформации (ковке, прокатке). Мехапические свойства сильно зависят от содержания примесей, особенно кислорода, серы, азота и углерода. Значения предела прочности и модуля упругости металлов иттриевой подгруппы (за исключением Yb) выше, чем для цериевой. Все Л., за исключением La и Lu, обладают при температурах выше комнатной сильным парамагнетизмом, причиной которого является наличие у этих элементов нескомпенсированных в 4f-подоболочках спиновых и орбитальных магнитных моментов. В области низких температур большинство Л. цериевой подгруппы (Nd, Pr, Sm) находится в антиферромагнитном состоянии, а Л. иттриевой подгруппы (Tb, Dy, Но, Er и Tm) при очень низких температурах — в ферримагнитном состоянии, а при более высоких температурах переходят в т. н. геликоидальное антиферромагнитное состояние. Gd при всех температурах ниже 293 К (т. е. до точки Кюри) находится в ферромагнитном состоянии (см. Магнитная структура).
Металлы Tb, Dy, Но, Er и Tm обладают большими величинами намагниченности насыщения, огромными значениями энергии магнитной анизотропии и магнитострикции, что позволяет на основе этих металлов создавать магнитные материалы (сплавы, ферриты, халькогениды и др.) с уникальными свойствами. a-La становится сверхпроводником при 4,9 К, b-La при 5,85 К; для других Л. сверхпроводимость не обнаружена.
Химические свойства. Л. отличаются высокой химической активностью. При нагревании они реагируют с водородом, углеродом, азотом, фосфором, углеводородами, окисью и двуокисью углерода; разлагают воду, растворяются в соляной, серной и азотной кислотах; выше 180—200°С Л. быстро окисляются на воздухе. Для всех Л. характерна валентность 3. Некоторые Л. проявляют, кроме того, валентность 4 или 2.
Окислы Л. и лантана тугоплавки. Гидроокиси R (OH)3 имеют основной характер и нерастворимы в щелочах. Хлориды, сульфаты и нитраты трёхвалентных Л. растворимы в воде, и кристаллизуются большей частью в виде кристаллогидратов различного состава. Фториды, оксалаты, фосфаты, карбонаты и ферроцианиды малорастворимы в воде и разбавленных минеральных кислотах. Трёхзарядные катионы Ce, Gd, Tb, Yb, Lu бесцветны, Pm, Eu, Er имеют розовый цвет, Sm, Dy, Но — жёлтый, Pr и Tm — зелёный, Nd — фиолетово-красный.
Большинство простых солей Л. склонно к образованию двойных солей с солями щелочных металлов, аммония, магния. Л. дают комплексные соединения с многими органическими веществами. Среди них важное значение имеют комплексы, образуемые с лимонной кислотой и рядом аминополиуксусных кислот: нитрилотриуксусной, этилендиаминтетрауксусной кислотой и др. "комплексонами". Эти соединения используются в процессах разделения Л.
№9
Основные понятия химической кинетики
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость
![]() (3.1.)
(3.1.)
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак ( - ) – что вещество расходуется в ходе реакции.
Истинная (мгновенная) скорость реакции определяется соотношением
![]() (3.2)
(3.2)
где dc – бесконечно малое изменение концентрации вещества за бесконечно малый промежуток времени dt.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Все химические реакции можно разделить на гомогенные и гетерогенные. К гомогенным реакциям относятся реакции, протекающие между веществами, находящимися в одном агрегатном состоянии, если между ними отсутствуют поверхности раздела. К гомогенным реакциям относятся реакции между газами, неограниченно смешивающимися жидкостями и жидкими растворами. Гомогенные реакции протекают в объеме, т.е. имеются наиболее благоприятные условия для контакта молекул реагирующих веществ.
Реакции между веществами, находящимися в разных агрегатных состояниях, или в одном агрегатном состоянии, но разделенных поверхностями раздела относятся к гетерогенным реакциям. К ним относятся, например, реакции между газом и жидкостью, двумя несмешивающимися жидкостями, механическими смесями твердых веществ. В гетерогенных реакциях химический процесс протекает только на поверхностях раздела реагирующих фаз.
№11
Факторы, влияющие на скорость химической реакции
1) Природа реагирующих веществ (характер связи в молекулах реагентов);
2) Концентрация реагентов;
3) Температура;
4) Катализатор;
5) Давление (для газов);
6) Излучение (ИК-, УФ-, рентгеновское, радиоактивное и др.);
7) Площадь поверхности раздела фаз (для гетерогенных реакций).
Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действующих масс
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды (взрыв), другие осуществляются за минуты, часы, дни и большие промежутки времени. Кроме того, одна и та же реакция может в одних условиях (например, при повышенных температурах) протекать быстро, а в других (например, при охлаждении) - медленно. При этом различие в скорости одной и той же реакции может быть очень большим.
Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
При рассмотрении вопроса о скорости реакций необходимо различать гомогенные и гетерогенные реакции. С этими понятиями тесно связано понятие фазы.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Гомогенная реакция протекает в объеме фазы [пример - взаимодействие водорода и кислорода с образованием водяного пара: H2 (г) + O2 (г) → H2O (г)], а если реакция гетерогенна, то она протекает на поверхности раздела фаз [например, горение углерода: C (т) + O2 (г) → CO2 (г)]. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема фазы:
![]() ,
,
где n - количество вещества, моль; V - объем фазы, л; t - время; С - концентрация, моль/л.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
![]() ,
,
где S - площадь поверхности раздела фаз.
К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
Зависимость скорости реакции от концентраций реагирующих веществ. Реакция между молекулами происходит при их столкновении. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений тем больше, чем выше концентрация каждого из исходных веществ. Например, скорость реакции A + B → C пропорциональна произведению концентраций А и В:
v = k× [A] × [B],
где k - коэффициент пропорциональности, называемый константой скорости реакции. По смыслу величина k равна скорости реакции для случая, когда концентрации реагирующих веществ равны 1 моль/л.
Это соотношение выражает закон действия масс. Этот закон называют также законом действующих масс.: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция
2А+В → А2В
может протекать путем тройного столкновения:
А+А+В → А2В
Тогда в соответствии с законом действия масс концентрация каждого из реагирующих веществ входит в выражение скорости реакции в степени, равной коэффициенту в уравнении реакции:
v = k× [A] × [A] × [B] = k× [A] 2 [B]
Сумма показателей степени в уравнении закона действия масс называется порядком реакции. Например, в последнем случае реакция имеет третий порядок (второй - по веществу A и первый - по веществу B).
В случае, когда уравнение химической реакции не соответствует элементарному акту взаимодействия, а отражает лишь связь между массой вступивших в реакцию и образовавшихся веществ, то степени у концентраций не будут равны коэффициентам, стоящим перед формулами соответствующих веществ в уравнении реакции. Для реакции, которая протекает в несколько стадий, скорость реакции определяется скоростью самой медленной (лимитирующей) стадии.
Такая зависимость скорости реакции от концентрации реагирующих веществ справедлива для газов и реакций, проходящих в растворе. Реакции с участием твердых веществ не подчиняются закону действующих масс, так как взаимодействие молекул происходит лишь на поверхности раздела фаз. Следовательно, скорость гетерогенной реакции зависит еще и от величины и характера поверхности соприкосновения реагирующих фаз. Чем больше поверхность - тем быстрее будет идти реакция.
Влияние поверхности соприкосновения реагентов на скорость химической реакции Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов. Но в этом определении есть нюансы. Твердые вещества, участвующие в гетерогенной реакции, для увеличения скорости взаимодействия измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление.
Катализ
и ингибирование
Есть
вещества, которые влияют на скорость
химической реакции, не являясь при этом
реагентами.
Они принимают в реакции самое
непосредственное участие, но в результате
реакции остаются неизменными. Такие
вещества называются катализаторами,
если они ускоряют реакцию, и ингибиторами,
если замедляют ее. Механизм действия
катализаторов объясняется образованием
промежуточных соединений. Например,
механизм действия катализатора К в
реакции А + В = АВ можно схематически
показать так:
![]() А
+ К = АК АК + В = АВ + К
А + В = АВ (АК –
промежуточное соединение).
В присутствии
катализатора изменяется путь, по которому
происходит суммарная реакция, поэтому
изменяется ее скорость. Например: 2SO2
+ O2
= 2 SO3
(медленно);
2SO2
+ O2
= 2 SO3
(присутствии катализатора NO –
быстро).
Механизм:
2 NO + O2
= 2 NO 2
(быстро)
NO2
+ SO2
= SO3
+ NO (быстро).
NO
– катализатор, NO2
- промежуточное соединение. (приложение,
рисунок 6)
Особый случай катализа –
аутокатализ,
или
ускорение реакции одним из ее продуктов.
При этом скорость реакции не уменьшается
по мере расходования реагентов, а растет.
Так, реакция
2KMnO4
+ 5K2SO3
+ 3H2SO4
= 2MnSO4
+ 6K2SO4
+ 3H2O
ускоряется
по мере накопления ионов Mn2+,
образующихся при восстановлении
перманганата.
А
+ К = АК АК + В = АВ + К
А + В = АВ (АК –
промежуточное соединение).
В присутствии
катализатора изменяется путь, по которому
происходит суммарная реакция, поэтому
изменяется ее скорость. Например: 2SO2
+ O2
= 2 SO3
(медленно);
2SO2
+ O2
= 2 SO3
(присутствии катализатора NO –
быстро).
Механизм:
2 NO + O2
= 2 NO 2
(быстро)
NO2
+ SO2
= SO3
+ NO (быстро).
NO
– катализатор, NO2
- промежуточное соединение. (приложение,
рисунок 6)
Особый случай катализа –
аутокатализ,
или
ускорение реакции одним из ее продуктов.
При этом скорость реакции не уменьшается
по мере расходования реагентов, а растет.
Так, реакция
2KMnO4
+ 5K2SO3
+ 3H2SO4
= 2MnSO4
+ 6K2SO4
+ 3H2O
ускоряется
по мере накопления ионов Mn2+,
образующихся при восстановлении
перманганата.
№13 Влияние температуры на скорость химических процессов. Правило Вант-Гоффа
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t, присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ. Чтобы осуществля¬лось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции (I) этот закон выразится уравнением
v = kcA cB, (1)
где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Из уравнения (1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически
эта зависимость выражается соотношением
![]()
vt 2 = vt 1 γ,
где vt 1, vt 2 - скорости реакции соответственно при начальной (t 1) и конечной (t 2) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
Аррениуса уравнение, температурная зависимость константы скорости к элементарной хим. реакции:
![]()
где A-предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа -энергия активации, обычно принимающая положит. значения, Т-абс. температура, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу. а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в уравнении Аррениуса величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график) – прямая линия, отрицательный наклон которой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
Согласно
микроскопич. кинетич. интерпретации
уравнения Аррениуса, наличие
предэкспоненциального множителя А
обусловлено
равновесным максвелл-больцмановским
распределением реагирующих частиц, а
Также тем, что зависимость вероятности
реакции от энергии Е
этих частиц
имеет пороговый характер. Последнее
означает, что вероятность реакции
начинает быстро возрастать, как только
Е достигает
некоторой величины Е0.
В такой
ситуации к выражается уравнением, в
котором Еа
заменено на
Eo,
а А является
функцией температуры. Следовательно,
уравнение Аррениуса - аппроксимация
температурной зависимости истинной
константы скорости в ограниченном
температурном интервале. Для
рассматриваемого процесса изменение
энергии
![]() реагирующих
частиц, которое вызывает заметное
изменение вероятности реакции (напр.,
вдвое), существенно меньше средней
тепловой энергии частицы kT.Если
это условие не выполняется, аррениусов
график отклоняется от прямой линии.
наиб. существенные отклонения от
уравнения Аррениуса обусловлены
туннельным
эффектом,
когда в реакцию вступают частицы с
энергией много меньшей Eo,
Туннельный эффект, в частности, ответствен
за сильное нарушение аррениусовой
зависимости константы скорости в
условиях низких температур (при
реагирующих
частиц, которое вызывает заметное
изменение вероятности реакции (напр.,
вдвое), существенно меньше средней
тепловой энергии частицы kT.Если
это условие не выполняется, аррениусов
график отклоняется от прямой линии.
наиб. существенные отклонения от
уравнения Аррениуса обусловлены
туннельным
эффектом,
когда в реакцию вступают частицы с
энергией много меньшей Eo,
Туннельный эффект, в частности, ответствен
за сильное нарушение аррениусовой
зависимости константы скорости в
условиях низких температур (при
![]() k
Т), когда 1nк
при увеличении 1/k
Т перестает
убывать и принимает постоянное значение.
k
Т), когда 1nк
при увеличении 1/k
Т перестает
убывать и принимает постоянное значение.
Аррениуса уравнение применимо к мн. сложным реакциям; в этих случаях Еа обычно наз. кажущейся энергией активации. Для некоторых сложных реакций аррениусов график представляет собой кривую линию; если его используют для определения величин А и Еа, необходимо указывать соответствующие концентрационный и температурный интервалы.
Для некоторых реакций температурная зависимость к может быть представлена в виде уравнения Аррениуса лишь формально, с отрицат. значением Eа. Часто это указывает на то, что в совокупность элементарных процессов, определяющих р-цию, входит равновесная стадия, для которой температурная зависимость константы равновесия К выражается ур-нием:
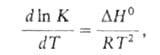
где
![]() -стандартное
изменение энтальпии реакции, которое
может принимать как положительные, так
и отрицат. значения.
-стандартное
изменение энтальпии реакции, которое
может принимать как положительные, так
и отрицат. значения.
Энергия активации
Энергия активации, разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе. Для различных химических реакций Э. а. изменяется в широких пределах — от нескольких до ~ 10 дж./ моль. Для одной и той же химической реакции значение Э. а. зависит от вида функций распределения молекул по энергиям их поступательного движения и внутренним степеням свободы (электронным, колебательным, вращательным). Как статистическую величину Э. а. следует отличать от пороговой энергии, или энергетического барьера, — минимальной энергии, которой должна обладать одна пара сталкивающихся частиц для протекания данной элементарной реакции.
В рамках представлений теории абсолютных скоростей реакций Э. а. — разность между значениями средней энергии активированных комплексов и средней энергии исходных молекул.
Представления об Э. а. возникли в 70—80-х гг. 19 в. в результате работ Я. Вант-Гоффа и С. Аррениуса, посвященных изучению влияния температуры на скорость химической реакции. Константа скорости реакции k связана с Э. а. (Е) уравнением Аррениуса:
k = koe-E/RT
где R — газовая постоянная, Т — абсолютная температура в К, ko — постоянная, называемая предэкспоненциальным множителем константы скорости. Это уравнение, основанное на молекулярно-кинетической теории, позже было получено в статистической физике с учетом ряда упрощающих предположений, одно из которых — независимость Э. а. от температуры. Для практики и для теоретических расчетов в сравнительно узких температурных интервалах это предположение справедливо.
Э. а. можно найти по экспериментальным данным несколькими способами. Согласно одному из них, исследуют кинетику реакции при нескольких температурах (о методах см. в ст. Скорость химической реакции) и строят график в координатах In k — 1/T; тангенс угла наклона прямой на этом графике, в соответствии с уравнением Аррениуса, равен Е. Для одностадийных обратимых реакций (см. Обратимые и необратимые реакции) Э. а. реакции в одном из направлений (прямом или обратном) можно вычислить, если известна Э. а. реакции в другом и температурная зависимость константы равновесия (из термодинамических данных). Для более точных расчетов следует учитывать зависимость Э. а. от температуры.
Э. а. сложных реакций представляет собой комбинацию Э. а. элементарных стадий. Иногда, помимо истинной Э. а., определяемой по уравнению Аррениуса, используют понятие "кажущейся" Э. а. Например, если константы скоростей гетерогенно-каталитических реакций определяют по изменению объемных концентраций исходных веществ и продуктов, то кажущаяся Э. а. отличается от истинной на величину тепловых эффектов, сопровождающих процессы адсорбции и десорбции реагирующих веществ на поверхности катализатора. В неравновесных системах, например плазмохимических (см. Плазмохимия), определение Э. а. является очень сложной задачей. В некоторых случаях, однако, возможно формальное применение уравнения Аррениуса.
Э. а. — важнейшее понятие кинетики химической; ее значения включают в специальные справочники и используют в химической технологии для расчета скоростей реакций в различных условиях.
№15
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Многие химические реакции протекают в одном направлении до полного исчерпания реагирующих веществ. Такие реакции называются химически необратимыми. Другие реакции протекают вначале в прямом направлении, а затем в прямом и обратном благодаря взаимодействию продуктов реакции. В результате образуется смесь, содержащая одновременно исходные вещества и продукты реакции. Такие реакции называют химически обратимыми. В результате химически обратимого процесса наступает истинное (устойчивое) химическое равновесие, признаками которого являются:
1) в отсутствии внешних воздействий состояние системы остается неизменным неограниченно долго;
2) любое изменение внешних условий приводит к изменению состояния системы;
3) состояние равновесия не зависит от того, с какой стороны оно достигнуто.
Кроме истинных равновесий очень часто встречаются кажущиеся (ложные, заторможенные) равновесия, когда состояние системы сохраняется во времени очень долго, но небольшое воздействие на систему может привести к сильному изменению ее состояния.
Рассмотрим
обратимую химическую реакцию между
йодом и водородом ![]()
Скорости прямой и обратной реакций определяются соотношениями
![]()
Начиная
с некоторого момента состав реакционной
смеси перестает изменяться, что отвечает
равенству скоростей прямой и обратной
реакции 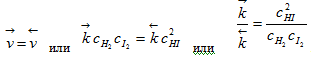
Это состояние реагирующей системы называется химическим равновесием. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, следовательно, химическое равновесие является динамическим равновесием.
Отношение констант скоростей прямой и обратной реакций является также величиной постоянной и носит название константы химического равновесия. Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия.
Для обратимой реакции, записанной в общем виде аА + bB ↔ dD + eE константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом:

через парциальные давления константа равновесия реакции будет выглядеть так:
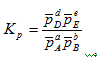
Константа равновесия гетерогенных реакций не включает концентрации твердых веществ.
№17
Смещение химического равновесия. Принцип Ле Шателье. Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия. Направление смещения равновесия определяется принципом Ле Шателье: Любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения.
1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса.
2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа моль газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смешается в сторону увеличения числа моль газообразных веществ, т.е. в сторону увеличения давления.
3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию и наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения.
Связь между константами равновесия и термодинамическими характеристиками системы устанавливается уравнениями изотермы, изобары и изохоры химической реакции. Эти уравнения впервые были выведены Вант-Гоффом (1886г), поэтому в литературе их часто называют его именем, а именно: изотерма, изобара и изохора Вант-Гоффа. Каждое из них имеет несколько разновидностей и используется либо в дифференциальной, либо в интегральной формах. Уравнение изотермы в общем виде связывает энергию Гиббса, константу равновесия и начальные (или текущие), т.е. неравновесные концентрации (активности в случае реальных растворов) или неравновесные парциальные давления (фугитивности в случае реальных газовых смесей) всех компонентов химической реакции. (rr G)р,Т = - RТ ln Кр0 + R Т ln рDn D р F n F рАn А р В n В Которое и называют уравнением изотермы химической реакции в общем виде. По уравнению изотермы вычисляют энергию Гиббса реакции, а также определяют направление и глубину ее самопроизвольного протекания при данных условиях, если известны стандартная константа равновесия для данной температуры и исходный состав произвольно приготовленной реакционной смеси, т.е. неравновесные относительные, например, парциальные давления рi всех компонентов в начальный момент времени. Очевидно, что чем больше абсолютное значение (rr G)р,Т , тем менее равновесна система. -если в реакционной смеси присутствуют или только продукты реакции или только исходные вещества, то (rr G)р,Т ®±¥ для любой реакции; - (rr G)р,Тñ 0 реакция протекает в обратном направлении справа налево до установления равновесия; -(rr G)р,Тá 0 реакция протекает самопроизвольно в прямом направлении; -(rr G)р,Т= 0 отвечает состоянию химического равновесия; -Если величина, стоящая под знаком логарифма во втором слагаемом равна единице (это возможно, например при начальных относительных парциальных давлениях всех компонентов, равных единице, т.е. компоненты находятся в стандартных условиях), то само слагаемое равно нулю, а уравнение изотермы трансформируется:
(rr G)р,Т = - RТ ln Кр0 или rr GТ0 = - RТ ln Кр0 |
и его называют стандартным уравнением изотермы химической реакции или уравнением стандартного сродства. С его помощью можно вычислить Кр0 без экспериментального изучения равновесия. Уравнение изобары химической реакции определяет зависимость константы равновесия Кр0 от температуры и в дифференциальной форме выводится на основании стандартного уравнения изотермы
rr GТ0 = - R ln Кр0 Т |
и дифференциального уравнения энергии Гиббса – Гельмгольца для стандартных условий
rr GТ0 = rr НТ0 + Т d (rr GТ0) d Т |
После преобразований получают уравнение изобары:
d ln Кр0 = rr Н0Т d Т RТ2 |
Анализируя его можно установить, что, чем больше абсолютная величина теплового эффекта и чем ниже температура, тем больше значение производной, следовательно, сильнее сказывается изменение температуры на константе равновесия и в большей степени смещается положение равновесия. Уравнение полезно при вычислении графическим путем тепловых эффектов реакции. Если температурная зависимость константы равновесия выражена в координатах ln Кр0 - 1/ Т. Газофазная реакция осуществляется в закрытой системе, при постоянном объеме (V = соnst). Уравнение изохоры химической реакции в дифференциальной форме:
d ln К с0 = rr U0Т d Т RТ2 |
В интегральной форме:
ln К 0с2 = rr U0Т (Т2-Т1) К 0с1 RТ1 Т2 |
Где rr U0Т - изменение стандартной внутренней энергии реакции; К с0 - безразмерная стандартная константа равновесия, выраженная через относительное равновесные молярные концентрации компонентов.
№20
Модель атома Резерфорда До 1911 г. не было правильных представлений о строении атома. В 1911 г. Резерфорд и его сотрудники исследовали рассеяние -частиц при прохождении через тонкие металлические слои (-частицы испускают радиоактивные элементы. Они представляют собой ядра атомов гелия с зарядом 2е и массой, приблизительно в 4 раза большей, чем масса атома водорода. Скорость их достигает 107 м/с). Было установлено, что при облучении листка золота толщиной 6 мкм значительное отклонение от первоначального направления движения испытывала лишь одна из 8000 -частиц. Результат получился таким же неожиданным для того времени, как если бы при обстреле кирпичами кирпичной стены толщиной в несколько тысяч кирпичей почти все кирпичи проходили бы сквозь стену и лишь некоторые отскакивали бы от стены.
На основании своих исследований Резерфорд предложил ядерную модель атома. Согласно этой модели атом состоит из положительного ядра, имеющего заряд Zе (Z - порядковый номер элемента в таблице Менделеева, е - элементарный заряд), размер 10-5 -10-4 А (1А= 10-10 м) и массу практически равную массе атома. Вокруг ядра по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то вокруг ядра должно вращаться Z электронов, суммарный заряд которых - Zе. Размеры атома определяются размерами
внешних орбит электронов и составляют порядка единиц А.
Масса электронов составляет очень малую долю массы ядра (для водорода 0,054%, для остальных элементов менее 0,03%). Понятие " размер электрона" не удается сформулировать непротиворечиво, хотя ro 10-3 А называют классическим радиусом электрона.
Итак, ядро атома занимает ничтожную часть объема атома и в нем сосредоточена практически вся ( 99,95%) масса атома. Если бы ядра атомов располагались вплотную друг к другу, то земной шар имел бы радиус 200 м а не 6400 км (плотность вещества атомных ядер 1,81017 кг/м3). Поэтому с точки зрения атомистических представлений всякую среду следует рассматривать как вакуум, в который вкраплены атомные ядра и электроны (или по другому - как вакуум, слегка испорченный вкрапленными в него атомными ядрами и электронами).
Результаты опытов по рассеиванию -частиц свидетельствуют в пользу ядерной модели атома. Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Покажем это.
Предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между электроном и ядром сообщает электрону нормальное (центростремительное) ускорение, определяемое из второго закона Ньютона.
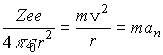 .(1)
.(1)
При r = 1Аиз (1) находим, что аn 1022 м/с2. Согласно классической электродинамике ускоренно движущиеся электроны должны излучать электромагнитные волны (см. параграф 2.4.) и вследствие этого терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него, что противоречит действительности.
Выход из создавшего тупика был найден в 1913 г. Нильсом Бором, который сформулировал 2 постулата, противоречащие классическим представлениям.

Рисунок 6.1.4.
Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов
Квантово-механическая модель атома
В 1924 г. французский физик Луи де Бройль высказал идею о том, что материя обладает как волновыми, так и корпускулярными свойствами. Согласно уравнению де Бройля (одному из основных уравнений квантовой механики),
![]()
т. е. частице с массой m, движущейся со скоростью v соответствует волна длиной λ; h — постоянная Планка.
Длину волны такой частицы называют длиной волны де Бройля. Для любой частицы с массой т и известной скоростью v длину волны де Бройля можно рассчитать. Идея де Бройля была экспериментально подтверждена в 1927 г., когда были обнаружены у электронов как волновые, так и корпускулярные свойства. В 1927 г. немецким ученым В. Гейзенбергом был предложен принцип неопределенности, согласно которому для микрочастиц невозможно одновременно точно определить и координату частицы X, и составляющую рх импульса вдоль оси х. Математически принцип неопределенности записывают следующими уравнениями:
ΔxΔpx ≥ h;
ΔxΔpy ≥ h;
ΔxΔpz ≥ h.
Отсюда следует, что при точном определении координаты х микрочастицы исчезает информация о ее импульсе Δpx, так как при х=0 величина Δpx→∞. Если удастся снизить погрешность Δp,то будет велика погрешность Δх. Источник этих погрешностей заключен не в приборах, а в самой природе вещей.
Поскольку постоянная Планка очень мала, то ограничения, накладываемые принципом неопределенности, существенны только в масштабах атомных размеров. Согласно принципу неопределенности, невозможно утверждать, что электрон, имеющий определенную скорость, находится в данной точке пространства, здесь можно использовать лишь вероятностное описание.
Для описания свойств электрона используют волновую функцию, которую обозначают буквой Ψ (пси). Квадрат ее модуля |Ψ|2, вычисленный для определенного момента времени и определенной точки пространства, пропорционален вероятности обнаружить частицу в этой точке в указанное время. Величину |Ψ|2 называют плотностью вероятности. Наглядное представление о распределении электронной плотности атома дает функция радиального распределения. Такая функция служит мерой вероятности нахождения электрона в сферическом слое между расстояниями r и (r+dr) от ядра. Объем, лежащий между двумя сферами, имеющими радиусы r и (r+dr), равен 4Πr2dr, а вероятность нахождения электрона в этом элементарном объеме может быть представлена графически в виде зависимостей функции радиального распределения. На рис. 1 представлена функция вероятности для основного энергетического состояния электрона в атоме водорода. Плотность вероятности |Ψ|2 достигает максимального значения на некотором конечном расстоянии от ядра. При этом наиболее вероятное значение r для электрона атома водорода равно радиусу орбиты a0 соответствующей основному состоянию электрона в модели Бора. Различная плотность вероятности дает представление об электроне, как бы размазанном вокруг ядра в виде так называемого электронного облака (рис. 2).
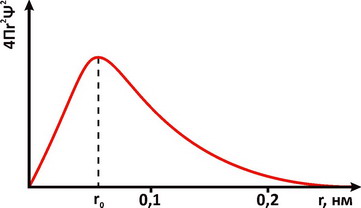
Рис. 1. Радиальное распределение вероятности пребывания электрона для основного энергетического состояния атома водорода
Рис. 2. Электронное s-облако (l - 0)
Чем больше величина |Ψ|2, тем больше вероятность нахождения электрона в данной области атомного пространства.
В квантовой механике вместо термина «орбита» используют термин «орбиталь», которым называют волновую функцию электрона. Соответственно орбиталь характеризует и энергию и форму пространственного распределения электронного облака. Расчеты в квантовой механике проводят с помощью предложенного в 1926 г. австрийским ученым Э. Шредингером уравнения, которое является математическим описанием электронного строения атома в трехмерном-пространстве.
В простейшем случае уравнение Шредингера может быть записано в виде
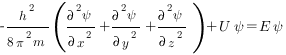
где h — постоянная Планка; m — масса частицы; U — потенциальная энергия; Е — полная энергия; х, у, z — координаты; Ψ — волновая функция.
Решая уравнение Шредингера, находят волновую функцию Ψ=f(x, y, z). Решение уравнения Шредингера возможно лишь при определенных значениях полной энергии Е. Определив вероятностную функцию можно оценить величину |Ψ|2dV — вероятность нахождения электрона в объеме пространства dV, окружающего атомное ядро. Решение уравнения Шредингера представляет сложную математическую задачу.
№22
Уравнение
Шрёдингера Волновое
уравнение было предложено в 1926 г. немецким
физиком Э. Шрёдингером
(1887-1961) для описания состояния электрона
в атоме водорода. Он объединил
математические выражения для колебательных
процессов и уравнение де Бройля и получил
следующее линейное дифференциальное
однородное уравнение:
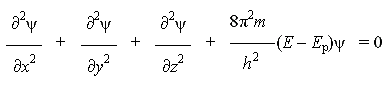
где ψ - волновая функция (аналог амплитуды для волнового движения в классической механике), которая характеризует движение электрона в пространстве как волнообразное возмущение; x, y, z - координаты, m - масса покоя электрона, h - постоянная Планка, E - полная энергия электрона, Ep - потенциальная энергия электрона.
Решениями уравнения Шрёдингера являются волновые функции. Для одноэлектронной системы (атома водорода) выражение для потенциальной энергии электрона имеет простой вид:
Ep = −e2 / r,
где e - заряд электрона, r - расстояние от электрона до ядра. В этом случае уравнение Шрёдингера имеет точное решение.

Чтобы решить волновое уравнение, надо разделить его переменные. Для этого заменяют декартовы координаты x, y, z на сферические r, θ, φ. Тогда волновую функцию можно представить в виде произведения трех функций, каждая из которых содержит только одну переменную:
ψ(x,y,z) = R(r) Θ(θ) Φ(φ)
Функцию R(r) называют радиальной составляющей волновой функции, а Θ(θ) Φ(φ) - ее угловыми составляющими.
В ходе решения волнового уравнения вводятся целые числа - так называемые квантовые числа (главное n, орбитальное l и магнитное ml). Функция R(r) зависит от n и l, функция Θ(θ) - от l и ml, функция Φ(φ) - от ml.
Геометрическим образом одноэлектронной волновой функции является атомная орбиталь. Она представляет собой область пространства вокруг ядра атома, в которой высока вероятность обнаружения электрона (обычно выбирают значение вероятности 90-95%). Это слово происходит от латинского "орбита" (путь, колея), но имеет другой смысл, не совпадающий с понятием траектории (пути) электрона вокруг атома, предложенным Н. Бором для планетарной модели атома. Контуры атомной орбитали - это графическое отображение волновой функции, полученной при решении волнового уравнения для одного эл
Волнова́я фу́нкция (функция состояния, пси-функция, амплитуда вероятности) — комплексная функция, используемая в квантовой механике для вероятностного описания состояния квантовомеханической системы. В широком смысле — то же самое, что и вектор состояния.
Вариант названия «амплитуда вероятности» связан со статистической интерпретацией волновой функции: вероятность нахождения частицы (или физической системы) в данном состоянии равна квадрату абсолютного значения амплитуды вероятности этого состояния.
Физический смысл квадрата модуля волновой функции
Волновая функция
![]()
зависит от координат (или обобщённых координат) системы и формируется таким образом, чтобы квадрат её модуля
![]()
представлял собой плотность вероятности (для дискретных спектров — просто вероятность) обнаружить систему в положении, описываемом координатами
![]() .
.
Набор координат, которые выступают в роли аргументов функции, представляет собой полный набор физических величин, которые можно измерить в системе. В квантовой механике возможно выбрать несколько полных наборов величин, поэтому волновая функция одного и того же состояния может быть записана от разных аргументов. Выбранный для записи волновой функции полный набор определяет представление волновой функции. Так, возможны координатное представление, импульсное представление, в квантовой теории поля используется вторичное квантование и представление чисел заполнения или представление Фока и др.
Если волновая функция, например, электрона в атоме, задана в координатном представлении, то квадрат модуля волновой функции представляет собой плотность вероятности обнаружить электрон в той или иной точке пространства. Если эта же волновая функция задана в импульсном представлении, то квадрат её модуля представляет собой плотность вероятности обнаружить тот или иной импульс.
Для
волновых функций справедлив принцип
суперпозиции,
заключающийся в том, что если система
может пребывать в состояниях, описываемых
волновыми функциями
![]() и
и
![]() ,
то она может пребывать и в состоянии,
описываемом волновой функцией
,
то она может пребывать и в состоянии,
описываемом волновой функцией
![]()
при
любых комплексных
![]() и
и
![]() .
См. также Квантовая
суперпозиция.
.
См. также Квантовая
суперпозиция.
№24
Квантовые числа
Следствием решения уравнения Шредингера для атома водорода являются три квантовых числа, характеризующих поведение электрона в атоме. Эти же квантовые числа однозначно характеризуют состояние электронов любого атома периодической системы элементов.
Главное квантовое число n определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Поэтому можно сказать, что главное квантовое число n определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до ∞. При значении главного квантового числа, равного единице (n=1), электрон находится на первом энергетическом уровне, расположенном на минимально возможном расстоянии от ядра. Полная энергия такого электрона наименьшая.
Электрон, находящийся на наиболее удаленном от ядра энергетическом уровне, обладает максимальной энергией. Поэтому при переходе электрона с более удаленного энергетического уровня на более близкий выделяются порции (кванты) энергии. Энергетические уровни обозначают прописными буквами согласно схеме:
Значение n.........1 2 3 4 5
Обозначение......K L M N Q
Орбитальное квантовое число l. Согласно квантово-механиче-ским расчетам, электронные облака отличаются не только размерами, но и формой. Форму электронного облака характеризует орбитальное или азимутальное квантовое число. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т. е. ее расщепление на энергетические подуровни. Каждой форме электронного облака соответствует определенное значение механического момента движения электрона μ, определяемого орбитальным квантовым числом:
![]() .
.
Орбитальное квантовое число может иметь значения от 0 до n-1, всего n значений. Энергетические подуровни обозначают буквами:
Значение l..........0 1 2 3 4 5
Обозначение......5 р d f g h
При значении главного квантового числа, равного единице (n=1), орбитальное квантовое число имеет только одно значение, равное нулю (l=0). Таким значением l характеризуются электронные облака, имеющие шаровую симметрию. Электроны, орбитальное квантовое число которых равно нулю, называются s-электронами.
На первом энергетическом уровне могут находиться только s-электроны, его условная запись 1s. При значении главного квантового числа, равном двум (n=2), орбитальное квантовое число имеет два значения: l=0 и l=1. Орбитальному числу, равному единице (l=1), соответствует гантелевидная форма электронного облака (форма объемной восьмерки) (рис. 1.) Электроны, орбитальное квантовое число которых равно единице, называются р-электронами.
На втором энергетическом уровне могут находиться s- и р-электроны, которые образуют два подуровня: 2s и 2р. При значении главного квантового числа, равного трем (n=3), орбитальное квантовое число имеет три значения: l=0, l=1, l=2. Орбитальному квантовому числу, равному двум (l=2), соответствует более сложная форма электронных облаков (рис. 2). Электроны, орбитальное квантовое число которых равно двум, называются d-электронами.
На третьем энергетическом уровне могут находиться s-, р-и d-электроны, которые образуют три подуровня: 3s, Зр и 3d. При значении главного квантового числа, равного четырем (n=4), орбитальное квантовое число имеет четыре значения: l=0, l= 1, l=2 и l=3. Орбитальному числу, равному трем (l=3), соответствует еще более сложная форма облаков. Электроны, орбитальное квантовое число которых равно трем, называются f-электронами.
На четвертом энергетическом уровне могут находиться s-, р-, d- и f-электроны, которые образуют четыре подуровня; 4s, 4р, 4d и 4f.

Рис. 1. Электронные р-облака (l= 1): 2pz-орбиталь; 2px-орбиталь; 2py-орбиталь
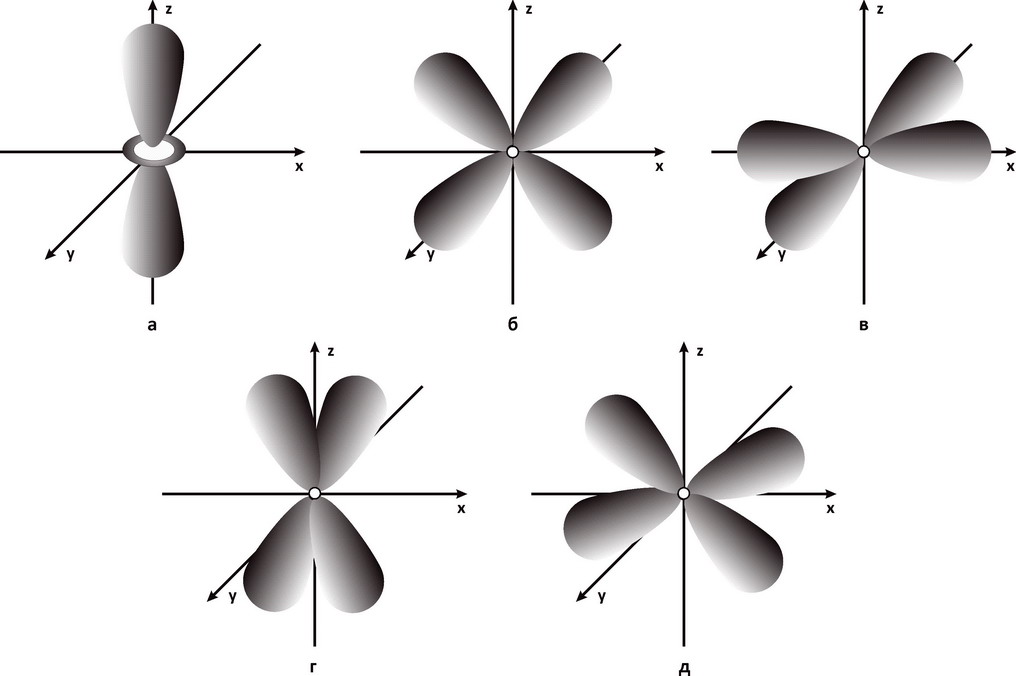
Рис. 2. Электронные d-облака (l= 2): а - 3dz2-орбиталь; б - 3dxz-орбиталь; в - 3dx2y2-орбиталь; г - 3dyz-орбиталь; д - 3dху-орбиталь
Магнитное квантовое число ml. Из решения уравнения Шредингера следует, что электронные облака ориентированы в пространстве. Пространственная ориентация электронных облаков характеризуется магнитным квантовым числом. Внешнее магнитное или электрическое поле изменяет пространственную ориентацию электронных облаков, поэтому при воздействии магнитного или электрического поля происходит расщепление энергетических подуровней электронов. В магнитном и электрическом полях наблюдается расщепление атомных спектральных линий. Магнитное квантовое число принимает любое целое числовое значение от +l до -l, включая 0. Таким образом, число возможных значений магнитного квантового числа равно 2l+1. При значении орбитального квантового числа, равного нулю (l=0), магнитное квантовое число имеет только одно значение, равное нулю (ml=0). При значении орбитального квантового числа, равном единице (l=1), магнитное квантовое число имеет три значения: ml=1, ml=0 и ml =-1. Три значения магнитного числа характеризуют три состояния р-электронов, что соответствует ориентации р-облаков в пространстве в трех взаимно перпендикулярных плоскостях по осям координат х, у и z (см. рис. 1). ри значении орбитального квантового числа, равном двум (l=2), магнитное квантовое число имеет пять значений: ml=2, ml=1, ml=0, ml=-2, ml=-1. Пять значений магнитного квантового числа соответствуют пяти пространственным положениям d-электронных облаков (рис. 2). Орбитальному квантовому числу, равному трем (l=3), соответствует семь значений магнитного числа и семь пространственных положений f-облаков.
№26
Атомные
орбитали (АО).
На основе представлений о квантовых
числах можно уточнить определение
электронной орбитали в атоме. Совокупность
положений электрона в атоме, характеризуемых
определенными значениями квантовых
чисел n, l и ml,
называют атомной орбиталью (АО). Условно
АО обозначают в виде клетки (энергетической
ячейки):
![]() .
Число АО равно единице на s-энергетических
подуровнях
,
трем — на р-подуровнях
,
пяти — на d-подуровнях
и
семи — на f-подуровнях
.
.
Число АО равно единице на s-энергетических
подуровнях
,
трем — на р-подуровнях
,
пяти — на d-подуровнях
и
семи — на f-подуровнях
.
Три р-орбитали (рх, рy, pz) перпендикулярны друг другу и направлены вдоль трех осей координат: х, у и z. Три d-орбитали (dxz, dyz, dxy) имеют диагональное расположение между осями х, y и z, две остальные (dx2y2, dz2) направлены вдоль осей координат.
Изучение атомных спектров показало, что три квантовых числа n, l и ml не полностью характеризуют поведение электронов в атоме.
Спиновое квантовое число ms. Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментом импульса, характеризующим его веретенообразное вращение вокруг собственной оси. Это свойство электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число ms, которое может принимать значения ms=+½ и ms=-½ . Положительное и отрицательное значения спина связаны с его направлением. Поскольку спин — величина векторная, его условно обозначают стрелкой, направленной вверх или вниз: ↓ или ↑.
Электроны, имеющие одинаковое направление спина, т. е. либо ms=+½, либо ms=-½, называются параллельными, при противоположных направлениях спинов — антипараллельными. Итак, состояние электрона в атоме полностью характеризуется четырьмя квантовыми числами: n, l, ml и ms.
Энергетический уровень — это совокупность орбиталей, которые имеют одинаковые значения главного квантового числа. Число энергетических уровней атома равно номеру периода, в котором он расположен. Например,калий(К) -элемент четвертого периода, имеет 4 энергетических уровня (n = 4). Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f и т. д. Например, n = 2,1 = 0,1. Значит, на 2 уровне есть подуровень s (1 = 0) и подуровень р (1 = 1).
Многоэлектронные атомы.
Для атомов, содержащих более одного валентного электрона, уравнение Шрёдингера может быть решено лишь приближенно. В приближении центрального поля предполагается, что каждый электрон движется в центрально-симметричном поле, создаваемом ядром и другими электронами. В этом случае состояние электрона полностью определяется квантовыми числами п, l, ml и ms (ms – проекция спина на фиксированную ось). Электроны в многоэлектронном атоме образуют оболочки, энергии которых растут по мере увеличения квантового числа п. Оболочки с n = 1, 2, 3... обозначаются буквами K, L, M ... и т.д. Согласно принципу Паули, в каждом квантовом состоянии не может находиться более одного электрона, т.е. никакие два электрона не могут иметь одинаковый набор квантовых чисел п, l, ml и ms. Это приводит к тому, что оболочки в многоэлектронном атоме заполняются в строго определенном порядке и каждой оболочке соответствует строго определенное число электронов. Электрон с квантовыми числами п и l обозначается сочетанием пs, если l = 0, сочетанием пр, если l = 1, и т. д. Электроны последовательно заполняют оболочки с наименьшей возможной энергией. В первую очередь двумя 1s электронами заполняется K-оболочка, имеющая минимальную энергию; ее конфигурация обозначается 1s2. Следующей заполняется L-оболочка: сначала двумя 2s электронами, затем шестью 2р электронами (конфигурация замкнутой оболочки 2s22р6). По мере роста порядкового номера элемента заполняются все более далекие от ядра оболочки. Заполненные оболочки имеют сферически симметричное распределение заряда, нулевой орбитальный момент и прочно связанные электроны. Внешние, или валентные, электроны связаны гораздо слабее; они определяют физические, химические и спектральные свойства атома. Структура периодической системы элементов хорошо объясняется порядком заполнения оболочек атомов, находящихся в основных состояниях.
В приближении центрального поля принимается, что все квантовые состояния, принадлежащие данной конфигурации, имеют одинаковую энергию. В действительности эти состояния расщепляются двумя основными возмущениями: спин-орбитальным и остаточным кулоновским взаимодействиями. Эти взаимодействия по-разному связывают спиновые и орбитальные моменты отдельных электронов внешней оболочки. В том случае, когда преобладает остаточное кулоновское взаимодействие, имеет место LS тип связи, а если преобладает спин-орбитальное взаимодействие, то осуществляется jj тип связи.
В
случае LS-связи
орбитальные моменты внешних электронов
образуют полный орбитальный момент
![]() ,
а спиновые моменты – полный спиновый
момент
,
а спиновые моменты – полный спиновый
момент
![]() .
Сложение
и
дает
полный момент
.
Сложение
и
дает
полный момент
![]() атома.
В случае jj-связи
орбитальный
атома.
В случае jj-связи
орбитальный
![]() и
спиновый
и
спиновый
![]() моменты
электрона с номером i,
складываясь, образуют полный момент
электрона
моменты
электрона с номером i,
складываясь, образуют полный момент
электрона
![]() ,
а при сложении всех векторов
получается
полный угловой момент атома
.
Общее число квантовых состояний для
обоих типов связи, естественно, одно и
то же.
,
а при сложении всех векторов
получается
полный угловой момент атома
.
Общее число квантовых состояний для
обоих типов связи, естественно, одно и
то же.
В многоэлектронных атомах правила отбора для разрешенных переходов зависят от типа связи. Помимо этого, существует правило отбора по четности: в разрешенных электрических дипольных переходах четность квантового состояния должна изменяться. (Четность – это квантовое число, означающее четность (+1) или нечетность (–1) волновой функции при отражении от начала координат.) Правило отбора по четности является основным требованием для электрического дипольного перехода в атоме или молекуле.
№28
ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ
При заполнении атомных орбиталей соблюдаются следующие принципы.
.1. ПРИНЦИП НАИМЕНЬШЕЙ ЭНЕРГИИ
Сначала заполняются орбитали с меньшей энергией. (Речь идет об электронных конфигурациях в основном состоянии). Этот принцип целиком и полностью соответствует одному из принципов самоорганизации материи (принцип минимума). Из принципа минимальной энергии следует, что в электронных оболочках природа придерживается стратегии минимума энергии.
Поскольку энергия в электронных оболочках принимает дискретный характер и учитывая, что электронные оболочки существуют не сами по себе, эту стратегию электронных оболочек, с точки зрения теории игр, можно записать следующим образом
![]()
где
![]() -
гарантированный выигрыш, равный его
наименьшему значению из некоторого
набора значений целевой функции,
соответствующей принятой электронными
оболочками стратегии
-
гарантированный выигрыш, равный его
наименьшему значению из некоторого
набора значений целевой функции,
соответствующей принятой электронными
оболочками стратегии
![]() ,
,
т. е. гарантированный «выигрыш» в двойственной системе «электрон+протон» достигается в том случае, если электронные оболочки выберут себе «нишу», в которой энергия двойственных им протонных оболочек из всех возможных дискретных значений принимает минимальное значение.
2. ПРИНЦИП ПАУЛИ
В атоме состояния любых двух электронов должны различаться хотя бы одним из четырех чисел n, l, ms, ml. Следовательно, на одной атомной орбитали, характеризующейся тремя квантовыми числами n, l, m, может находиться или один электрон с произвольным значением ms, или пара электронов с различными значениями ms: +1/2 и _ 1/2, т. е. с противоположными или антипараллельными спинами. Принцип Паули является квантовомеханическим законом и его нарушение невозможно. Этот принцип является следствием проявления закономерности о двойственности систем, их оболочек и подоболочек.
3. ПРАВИЛО ХУНДА
На атомных орбиталях электроны располагаются так, чтобы сохранилось наибольшее число электронов с параллельными спинами. Такая электронная конфигурация будет соответствовать наименьшей энергии.
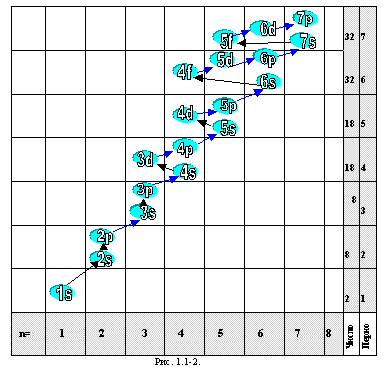
4. ПРАВИЛО КЛЕЧКОВСКОГО
При увеличении заряда ядра атома заполнение атомных орбиталей происходит последовательно таким образом, что вначале заполняются орбитали с меньшим значением суммы главного и орбитального квантовых чисел (п+ l). При одинаковых значениях суммы (п+l) сначала заполняются орбитали с меньшим значением главного квантового числа п. Известно, что электронным уровнем в атоме условно называется совокупность электронов с одинаковым значением главного квантового числа, а электронным подуровнем _ совокупность электронов, имеющих, при одинаковом значении главного квантового числа, одинаковые значения орбитального квантового числа. Однако в действительности электронные оболочки не представляют собой "слоеный пирог". Электроны верхнего уровня могут проникать вглубь атома, и наоборот. В общем виде эту последовательность заполнения орбиталей электронами можно изобразить в виде следующей схемы (рис. 1.1-2.). Последовательность заполнения орбиталей в атомах подчиняется правилу Клечковского (СССР, 1951 г.). На рис. 1.1-2 орбитали, расположенные на диагонали, направленной слева вверх направо, имеют одинаковую сумму (n+l) и заполняются в порядке возрастания n. Заметим, что правило Клечковского, объясняя принципы формирования электронных оболочек, ничего не говорит о природе этих принципов. О природе формирования этих правил будет сказано ниже (см. 3.7.4).
№30
Периодический закон Менделеева фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств всех известных в то время элементов и величин их атомных весов. Термин "периодический закон" Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку П. з.: "... свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса" ("Периодический закон. [Основные статьи]", 1958, с. 111). Графическим (табличным) выражением П. з. явилась разработанная Менделеевым периодическая система элементов. Физический смысл П. з. был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома (см. Атом). Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе П. з. лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация П. з.- кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z (см. Атомная физика).Какого-либо общего математического выражения П. з. не существует. П. з. имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря П. з. многие научные поиски (например, в области изучения строения вещества - в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер. П. з.- яркое проявление действия общих законов диалектики, в частности закона перехода количества в качество.
Электронная структура атомов и периодическая система элементов
При l=0, т.е. на s-подуровне *, имеется всего одна орбиталь *, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:
![]()
В атоме гелия, порядковый номер которого в периодической системе * (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:
![]()
У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
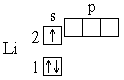
У следующего за гелием элемента лития (Z=3) третий электрон уже не может разместиться на орбитали K-слоя: это противоречило бы принципу Паули *. Поэтому он занимает s-состояние второго энергетического уровня (L-слой, n=2). Его электронная структура записывается формулой 1s22s1, что соответствует схеме:
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
![]()
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
![]()
Анализ атомного спектра показывает, что правильна последняя схема. Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z=7):
![]()
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
O 1s22s22p4 F 1s22s22p5 Ne 1s22s22p6
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементами (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущность периодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает из первого правила Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит от орбиталей с меньшим значением суммы главного * и орбитального * квантовых чисел (n+l) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n+l=4) должен заполняться раньше, чем 3d (n+l=5). Для атома скандия возникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+l для них одинакова и равна 5. В подобных случаях порядок заполнения определяется вторым правилом Клечковского, согласно которому при одинаковых значениях суммы (n+l) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от Sc до Zn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующих благородных газов – неона и аргона – атом криптона характеризуется структурой внешнего электронного слоя ns2np6.
Аналогично формируется пятый период.
В шестом периоде после заполнения 6s-подуровня начинается заполнение 4f-подуровня, и следуют атомы f-элементов. В связи с тем, что у них внешним является шестой уровень, а электроны последовательно занимают 4-й уровень, лежащий гораздо ближе к ядру, то химические свойства всех этих f-элементов близки к лантану, поэтому их часто называют лантаноидами (в 7-м периоде f-элементы называются актиноидами). После 4f заполняется 5d и, наконец, 6p-подуровень, заполнением которого заканчивается построение шестого периода. Седьмой период не завершен, т.к. элементы с большим зарядом ядра оказываются очень неустойчивыми (легко протекают ядерные реакции).
Порядок заполнения подуровней в соответствии с правилами Клечковского можно записать в виде последовательности: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p. Однако для некоторых элементов эта последовательность нарушается, т.е. из правил Клечковского имеются исключения. У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди имеет вид: Cu 1s2 2s2 2p6 3s2 3p6 3d10 4s1, т.е. один из двух 4s-электронов “проваливается” на 3d-подуровень. Особо следует отметить палладий, у которого “проваливаются” два электрона: Pd 1s2 2s2 2p6 3s2 3p6 4s2 4p6 4d10 5s0. Второй тип исключений из правила Клечковского состоит в том, что перед заполнением 4f-подуровня один электрон располагается на 5d-подуровне: La 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f0 5s2 5p6 5d1 6s2. У следующего элемента (церия) 5d-подуровень освобождается, и оба электрона располагаются на 4f-подуровне: Ce 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f2 5s2 5p6 5d0 6s2. Аналогично, в 7-м периоде у актиния последний из электронов располагается на 6d-подуровне (а не на 5f, как должно быть по правилам Клечковского).
Структура периодической системы элементов Д.И. Менделеева. Периодическая система состоит из периодов и групп. Порядковый номер элемента в периодической системе равен заряду ядра, или количеству протонов в нем, а также количеству электронов в оболочке нейтрального атома.
Период – последовательный ряд элементов, атомы которых различаются числом электронов в наружном слое. Каждый период начинается типичным металлом и завершается благородным газом. Номер периода совпадает со значением главного квантового числа * внешнего электронного уровня.
Принадлежность элементов к группам и деление их на подгруппы зависит от структуры двух внешних слоев. В соответствии с количеством электронов в этих слоях элементы периодической системы разделены на 8 групп. Номер группы совпадает с числом валентных электронов элемента. Валентными являются в первую очередь ns- и np-электроны (n – номер внешнего электронного слоя), а затем (n–1)d-электроны. Для примера рассмотрим электронные формулы хлора и марганца.
Cl 1s22s22p63s23p5 Mn 1s22s22p63s23p63d54s2
Здесь подчеркнуты валентные электроны, количество которых в обоих случаях равно 7. В соответствии с этим Cl и Mn находятся в VII группе периодической системы. В каждой группе главную подгруппу образуют атомы s- и p-элементов, а побочную – атомы d- и f-элементов.
№32
А́томные ра́диусы, характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах.
Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом (ион) считается несжимаемым шаром. Используя планетарную модель атома, его представляют как ядро, вокруг которого по орбиталям вращаются электроны. Последовательность элементов в Периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы (ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантово-механических представлений.
Размеры ионных радиусов подчиняются следующим закономерностям:
1. Внутри одного вертикального ряда периодической системы радиусы ионов с одинаковым зарядом увеличиваются с возрастанием атомного номера, поскольку растет число электронных оболочек, а значит, и размер атома.
2. Для одного и того же элемента ионный радиус возрастает с увеличением отрицательного заряда и уменьшается с увеличением положительного заряда. Радиус аниона больше радиуса катиона, поскольку у аниона имеется избыток электронов, а у катиона – недостаток. Например, у Fe, Fe2+, Fe3+ эффективный радиус равен 0,126, 0,080 и 0,067 нм соответственно, у Si4-, Si, Si4+ эффективный радиус равен 0,198, 0,118 и 0,040 нм.
3. Размеры атомов и ионов следуют периодичности системы Менделеева; исключения составляют элементы от № 57 (лантан) до №71 (лютеций), где радиусы атомов не увеличиваются, а равномерно уменьшаются (так называемое лантаноидное сжатие), и элементы от № 89 (актиний) и дальше (так называемое актиноидное сжатие).
Атомный радиус химического элемента зависит от координационного числа. Увеличение координационного числа всегда сопровождается увеличением межатомных расстояний. При этом относительная разность значений атомных радиусов, соответствующих двум разным координационным числам, не зависит от типа химической связи (при условии, что тип связи в структурах со сравниваемыми координационными числами одинаков). Изменение атомных радиусов с изменением координационного числа существенно сказывается на величине объемных изменений при полиморфных превращениях. Например, при охлаждении железа, его превращение из модификации с гранецентрированной кубической решеткой в модификацию с объемно-центрированной кубической решеткой имеющее место при 906 оС, должно сопровождаться увеличением объема на 9%, в действительности увеличение объема составляет 0,8%. Это связано с тем, что за счет изменения координационного числа от 12 до 8 атомный радиус железа уменьшается на 3%. Т. е., изменение атомных радиусов при полиморфных превращениях в значительной степени компенсируют те объемные изменения, которые должны были бы произойти, если бы при этом не менялся атомный радиус. Атомные радиусы элементов можно сопоставлять только при одинаковом координационном числе.
Атомные (ионные) радиусы зависят также от типа химической связи.
В кристаллах с металлической связью атомный радиус определяется как половина межатомного расстояния между ближайшими атомами. В случае твердых растворов металлические атомные радиусы меняются сложным образом.
Под ковалентными радиусами элементов с ковалентной связью понимают половину межатомного расстояния между ближайшими атомами, соединенными единичной ковалентной связью. Особенностью ковалентных радиусов является их постоянство в разных ковалентных структурах с одинаковыми координационными числами. Так, расстояния в одинарных связях С-С в алмазе и насыщенных углеводородах одинаковы и равны 0,154 нм.
Ионные радиусы в веществах с ионной связью не могут быть определены как полусумма расстояний между ближайшими ионами. Как правило, размеры катионов и анионов резко различаются. Кроме того, симметрия ионов отличается от сферической. Существует несколько подходов к оценке величины ионных радиусов. На основании этих подходов оценивают ионные радиусы элементов, а затем из экспериментально определенных межатомных расстояний определяют ионные радиусы других элементов.
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Кроме того, ван-дер-ваальсовыми атомными радиусами считают половину межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой химической связью, т.е. принадлежащими разным молекулам (например, в молекулярных кристаллах).
При использовании в расчетах и построениях величин атомных (ионных) радиусов их значения следует брать из таблиц, построенных по одной системе.
Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от атомного (порядкового) номера.
До открытия Д. И. Менделеева в науке уже были предприняты попытки классифицировать химические элементы по определенным признакам. Предшественники Д. И. Менделеева, отмечая сходство некоторых элементов, объединили их в отдельные группы или классы. Например, разделение элементов на два класса — металлы и неметаллы — оказалось неточным, потому что есть химические элементы с двойственными свойствами — как металлов, так и неметаллов. Важным этапом в работе по созданию классификации химических элементов было объединение сходных элементов в естественные семейства, например щелочные металлы, галогены. Однако все ученые, пытаясь классифицировать химические элементы, искали сходство между элементами одного семейства, но не могли себе представить, что все элементы тесно связаны друг с другом. Гениальное подтверждение того, что все химические элементы взаимосвязаны, сделал выдающийся русский химик Д. И. Менделеев, который сравнил их на основе двух свойств: атомной массы и валентности, т. е. способности образовывать известные формы соединений (оксиды, водородные соединения и др.). В 1869 г. он впервые сформулировал периодический закон: Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Это позже стало известно, что у атома есть ядро, которое имеет определенный заряд и массу. Причем чем больше заряд ядра, тем больше в нем содержится протонов и нейтронов. Это в конечном счете определяет взаимосвязь заряда атома и его массы. Чем больше заряд, тем, как правило, больше масса атома. Необходимо было обладать большой научной интуицией, чтобы, не зная состав атомного ядра, взять за основу систематизации элементов массу их атомов. Расположив известные элементы по мере увеличения массы их атомов, ученый обнаружил повторяемость свойств элементов, образующих одну большую последовательность. Данные о строении атома подтвердили и объяснили периодическое изменение свойств химических элементов и теперь периодический закон формулируют так: Свойства простых веществ, а также формы, и свойства их соединений находятся в периодиче ской зависимости от зарядов ядер атомов. Периодическое изменение свойств химических элементов с точки зрения строения атомов можно объяснить так. Возрастание положительного заряда атомных ядер приводит к возрастанию числа электронов в атоме. Число электронов равно заряду ядра атома. Электроны же располагаются в атоме не как угодно, а по электронным слоям. Каждый электронный слой имеет определенное число электронов. По мере заполнения одного слоя начинает заполняться следующий. А поскольку от числа электронов на внешнем слое в основном зависят свойства элементов, то и свойства периодически повторяются. В качестве примера можно рассмотреть накопление электронов на внешнем электронном слое атомов второго и третьего периодов. Каждый из периодов начинается с элементов, атомы которых на внешнем слое имеют один валентный электрон (Li, Na). Вследствие легкой отдачи этих электронов элементы проявляют сходные свойства и называются щелочными металлами. В конце этих периодов находятся галогены, имеющие семь электронов на внешнем слое атомов, и инертные газы, у которых внешний слой завершен и содержит восемь электронов. Таким образом, в каждом периоде с возрастанием заряда ядра металлические свойства элементов постепенно ослабевают, усиливаются неметаллические. Накопление восьми электронов на внешнем слое (инертные газы) и появление еще одного электрона у следующего атома приводит к резкому скачку в свойствах элементов и началу нового периода. На основе периодического закона были система тизированы элементы, или, говоря иначе, построена периодическая система химических элементов. Гра фическое изображение этого закона называется периодической таблицей. В таблице каждый химический элемент имеет атомный номер, который определяется числом протонов в ядре атома, т. е. атомный номер численно равен заряду ядра. Таким образом, основной признак, который определяет химический элемент, — это заряд его ядра. Массу атома в основном определяют протоны и нейтроны, составляющие ядро. Периодом называется ряд элементов, расположенных в порядке возрастания атомных масс, начинающийся со щелочного металла (за исключением первого периода; он начинается с водорода) и заканчивающийся инертным газом. В первый период входят только два элемента, во второй и третий — по восемь (эти периоды называются малыми). Четвертый период образован восемнадцатью элементами, а пятый и шестой — еще большим числом элементов. Чтобы определить, какая подгруппа — главная, а какая — побочная, важно помнить, что в состав главных подгрупп входят элементы как малых, так и больших периодов. Побочные подгруппы образованы только элементами больших периодов. Например, в состав главной подгруппы II группы входят элементы второго и третьего периодов — бериллий Be и магний Mg. Побочная подгруппа начинается с элемента четвертого (большого) периода — цинка Zn. И еще одно отличие: главная подгруппа, как правило, состоит из большего числа элементов, чем побочная (в VIII группе наоборот). В малых периодах, как было отмечено выше, по мере увеличения атомного номера элемента наблюдается закономерное увеличение числа электронов, находящихся на внешнем электронном слое атомов элементов. Как следствие этого от щелочного металла к галогену уменьшаются металлические свойства элементов и увеличиваются неметаллические свойства. Эта же закономерность проявляется и в свойствах веществ, образованных этими элементами. Так, например, оксид лития проявляет основные свойства, оксид бериллия — амфотерные. Высшие оксиды остальных элементов являются кислотными (кислородное соединение фтора является не оксидом, а фторидом). В главной подгруппе по мере увеличения атомного номера элемента наблюдается усиление металлических свойств элемента и уменьшение неметаллических. Это можно объяснить следующим образом. У элементов V группы на внешнем электронном слое по пять электронов. Однако внешние электроны у атома висмута находятся дальше от ядра и поэтому слабее удерживаются около него. Поэтому атомы висмута могут отдавать электроны, иначе говоря, проявлять металлические свойства, что не характерно для азота. Такая же закономерность в свойствах элементов и их соединений наблюдается в любой группе. Так, IV группа начинается с двух неметаллов — углерода С и кремния Si, далее следует германий Ge с промежуточными свойствами, и заканчивается группа очовом Sn и свинцом РЬ — металлами. Изменяются в группах и свойства соединений: оксид углерода (IV) — кислотный оксид, а оксид свинца обладает основными свойствами. Периодический закон позволил систематизировать свойства химических элементов и их соединений. При создании периодической системы Д. И. Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и описал их свойства.
Рассмотрим основные закономерности изменения свойств в периодах.
1. Возрастает электроотрицательность элемента, т.е. уменьшается способность атомов терять электроны и увеличивается способность присоединять их. Это связано с увеличением заряда ядра, вследствие чего внешние электроны, находящиеся на одном уровне, все сильнее притягиваются ядром. В результате в начале периода находятся типичные электроположительные элементы (металлы), а в конце периода, перед инертными газами – типичные электроотрицательные элементы (неметаллы).
2. Увеличивается максимальная положительная степень окисления, равная числу электронов на внешнем уровне, т.е. номеру группы, за исключением кислорода и фтора. Не для всех элементов соединения, соответствующие максимальной степени окисления, равной номеру группы, оказываются устойчивыми. Так, только недавно получены соединения брома (Vll); для инертных газов производные, в которых степень окисления их равна Vlll, пока получены только для ксенона и криптона, причем у последнего они очень непрочные.
3. Для электроотрицательных элементов убывает по абсолютной величине отрицательная степень окисления, равная восьми минус номер группы.
4. Ослабевают основные свойства оксидов и гидроксидов элементов и одновременно усиливаются их кислотные свойства.
В главных подгруппах с увеличением заряда ядра свойства элементов, а также соответствующих им простых веществ и соединений изменяются следующим образом.
1. Уменьшается электроотрицательность элемента, соответственно усиливаются металлические свойства и ослабевают неметаллические. Например, в V группе азот – типичный неметалл, фосфор – неметалл, у которого одно из аллотропных видоизменений обладает значительной электропроводностью (черный фосфор), мышьяк и сурьма – элементы, занимающие промежуточное положение между типичными металлами и типичными неметаллами, и, наконец, висмут – металл.
2. Уменьшается прочность соединений, в которых элементы данной подгруппы имеют высшую степень окисления. Так, для бора и алюминия характерны исключительно производные, в которых эти элементы имеют степень окисления +3; в случае же таллия даже растворение металла в азотной кислоте приводит к образованию соединений таллия (l). SiO2 – единственный устойчивый при обычных условиях оксид кремния, и окислительные свойства для него не характерны (не отмечается тенденции к отдаче части кислорода с понижением степени окисления); напротив, PbO2 термически неустойчив и является сильным окислителем. Фосфаты – вполне устойчивые соединения, для которых не характерны окислительные свойства, в то время как висмутаты (производные висмута в степени окисления +5) малоустойчивы и являются сильными окислителями.
3. Уменьшается устойчивость соединений, в которых элемент проявляет отрицательную степень окисления. Так, фосфин PH3 – значительно менее устойчивое соединение, нежели аммиак. аналоги фосфина – арсин AsH3, стибин SbH3 и висмутин BiH3 – еще менее устойчивы.
4. Усиливаются основные свойства оксидов и гидроксидов. (Следует помнить, что кислотно-основные свойства оксида или гидроксида зависят еще и от степени окисления элемента. Поэтому сравнивать следует соединения с одинаковыми степенями окисления элементов-аналогов).
Рассматривая изменение свойств элементов в подгруппах, нетрудно заметить, что всегда особыми оказываются элементы второго периода – как в виде простых веществ, так и в виде соединений. Например, в ряду галогенов соединения фтора довольно сильно отличаются от соединений его аналогов: фторид серебра довольно хорошо растворим в воде, в то время как хлорид, бромид и иодид серебра практически нерастворимы; напротив, фторид кальция практически нерастворим в воде, а хлорид, бромид и иодид кальция хорошо растворимы; в водном растворе фтороводород образует значительно более слабую кислоту, чем остальные галогеноводороды. Металлические бериллий и литий обнаруживают меньшую химическую активность по отношению к воде и кислороду, чем их аналоги.
Отличие элементов второго периода от их аналогов связано со строением электронных оболочек атомов. У атомов элементов второго периода мало внутренних электронов. Когда, например, у лития один единственный 2s – электрон на внешнем уровне будет использован для образования связи, на атоме лития останется только два 1s – электрона. В случае же натрия в образовании связи участвуют 3s-электрон, и на атоме Na остается на восемь внутренних электронов больше, чем на атоме Li. Отсюда различие в размерах соответствующих ионов, в энергетике кристаллических решеток и растворов с их участием.
4. Периодический закон Д.И. Менделеева. Основные энергетические характеристики атома – энергия ионизации и сродства к электрону. Электроотрицательность. Закономерности их изменения по периодам и группам периодической таблицы.
Периодичность свойств химических элементов и их соединений
а) Размеры атомов и ионов. Вследствие волновой природы электрона * атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов, но также и от вида химической связи между ними.
Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
|
Li |
Be |
B |
C |
N |
O |
F |
r, нм |
0,155 |
0,113 |
0,091 |
0,077 |
0,071 |
0,066 |
0,064 |
Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах сверху вниз атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
|
r, нм |
|
r, нм |
Li |
0,155 |
N |
0,071 |
Na |
0,189 |
P |
0,130 |
K |
0,236 |
As |
0,148 |
Rb |
0,248 |
Sb |
0,161 |
Cs |
0,268 |
Bi |
0,182 |
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус положительного иона (катиона) всегда меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус соответствующего электронейтрального атома. Например:
|
r, нм |
|
r, нм |
K0 |
0,236 |
Cl0 |
0,099 |
K+ |
0,133 |
Cl– |
0,181 |
Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона:
|
Cr0 |
Cr2+ |
Cr3+ |
r, нм |
0,127 |
0,083 |
0,064 |
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
|
r, нм |
|
r, нм |
Li+ |
0,068 |
F– |
0,133 |
Na+ |
0,098 |
Cl– |
0,181 |
K+ |
0,133 |
Br– |
0,196 |
Rb+ |
0,149 |
I– |
0,220 |
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
б) Энергия ионизации и сродство к электрону. В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации (потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона:
X – e X+
Энергия ионизации измеряется в кДж/моль или в электронвольтах (эВ). Отрыв второго электрона происходит труднее, чем первого, т.к. второй электрон отрывается не от нейтрального атома, а от положительного иона:
X+ – e X2+
Поэтому второй потенциал ионизации I2 больше, чем первый (I2>I1). Очевидно, что удаление каждого следующего электрона будет требовать больших энергетических затрат, чем удаление предыдущего. Для характеристики свойств элементов обычно принимают во внимание энергию отрыва первого электрона.
В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
|
Li |
Na |
K |
Rb |
Cs |
I, эВ |
6,39 |
5,14 |
4,34 |
4,18 |
3,89 |
Это связано с большей удаленностью валентных электронов от ядра и, следовательно, с их более легким отрывом по мере увеличения количества электронных слоев. Величина потенциала ионизации может служить мерой “металличности” элемента: чем меньше потенциал ионизации, тем легче удалить электрон из атома, тем сильнее выражены металлические свойства.
В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают:
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
I, эВ |
5,39 |
9,32 |
8,30 |
11,26 |
14,53 |
13,61 |
17,42 |
21,56 |
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину:
![]()
Это свидетельствует о повышенной энергетической устойчивости электронных конфигураций с полностью или ровно наполовину занятыми подуровнями.
Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядра, от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома, удерживающее электроны, притягивает также и свободный электрон, если он окажется вблизи атома. Правда, этот электрон испытывает отталкивание со стороны электронов атома. Для многих атомов энергия притяжения дополнительного электрона к ядру превышает энергию его отталкивания от электронных оболочек. Эти атомы могут присоединять электрон, образуя устойчивый однозарядный анион. Энергию отрыва электрона от отрицательного однозарядного иона в процессе X– – e X0 называют сродством атома к электрону (A), измеряемым в кДж/моль или эВ . При присоединении двух и более электронов к атому отталкивание преобладает над притяжением – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O2–, S2–, N3– и т.п.) в свободном состоянии существовать не могут.
Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов.
в) Электроотрицательность. Эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны. Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или эВ ) равна сумме энергии ионизации и сродства к электрону: АЭО=I+A. На практике часто применяется величина относительной электроотрицательности, равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль):
![]()
Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности некоторых элементов.
|
Li |
Be |
B |
C |
N |
O |
F |
ОЭО |
1,0 |
1,5 |
2,0 |
2,5 |
3,1 |
3,5 |
4,0 |
|
Na |
K |
Rb |
Cs |
ОЭО |
0,9 |
0,8 |
0,8 |
0,7 |
|
Cl |
Br |
I |
ОЭО |
3,0 |
2,8 |
2,6 |
Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, с F) он отдает электрон, а при взаимодействии с другими (например, с Rb) – приобретает электрон.
г) Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону.
д) Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
Na+ |
Mg2+ |
Al3+ |
Si4+ |
P5+ |
S6+ |
Cl7+ |
||||
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
||||
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
||||
основные
|
амфотерный |
слабо кислотный |
средне кислотный |
сильно кислотные
|
||||||
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются:
B3+ |
H3BO3 |
слабая кислота |
Al3+ Ga3+ In3+ |
Al(OH)3 Ga(OH)3 In(OH)3 |
амфотер- ные гидрок- сиды |
Tl3+ |
Tl(OH)3 |
более выражены основные свойства |
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду H2SO4, H2SeO4, H2TeO4.
№34
4. Периодический закон Д.И. Менделеева. Основные энергетические характеристики атома – энергия ионизации и сродства к электрону. Электроотрицательность. Закономерности их изменения по периодам и группам периодической таблицы.
Утверждение атомно-молекулярной теории на рубеже 18-19 в сопровождалось бурным ростом числа известных химических элементов. К 1830 г их число достигло 55. существование такого количества элементов, разнообразных по своим свойствам требовало их упорядочения и систематизации. Многие ученые занимались поиском закономерностей и даже открыли явление периодичности свойств (Мейер), но они не смогли объединить все элементы в единую периодическую систему, т.к. в их системах многие элементы не находили себе места. Периодический закон был открыт Менделеевым в 1869 г и сформулирован следующим образом: свойства простых тел, а также форма и свойства их соединений находятся в периодической зависимости от атомного веса элементов. Сейчас основываясь на теории строения атома периодический закон формулируется: свойства химических элементов, а также форма и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. графическим изображением периодического закона является таблица Периодической системы элементов. В таблице элементы располагаются в порядке возрастания заряда ядра их атомов. Число электронов, находящихся на внешнем уровне в атомах элементов, расположенных в порядке увеличения порядкового номера периодически повторяются, а поэтому периодически изменяются и свойства (физические и химические) элементов и их соединений. По числу заполненных энергетических уровней элементы делят на семь периодов каждый период начинается со щелочного металла и заканчивается (инертным) газом. Внешний слой которого полностью заполнен электронами (их не более 8), а на первом уровне – 2. Внешние электронные оболочки у многих элементов сходны (Li, К, Nа..) (Ве, Мg, Са..) (F, Сl, Вr, I..). Каждая из этих групп оказывается в определенной главной подгруппе. У них заполняются s или р-подуровни внешнего слоя. Максимальное число электронов на этих подуровнях 2+6=8. Всего 8 главных подгрупп и 8 побочных подгрупп . В периодах слева направо радиусы атомов меняются незначительно. С увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне. Первые три периода содержат только s и р элементы. Четвертый и последующие периоды включают в свой состав также элементы, у которых происходит заполнение d и f подуровней соответствующих внутренних энергетических уровней. При этом f элементы объединяются в семейства, называемые лантаноидами (4 f-элементы) и актиноидами 5 f-элементы. В вертикальных колонках, называемых группами, объединены элементы, имеющие сходное электронное строение внешнего энергетического уровня при различных значениях главного квантового числа и поэтому проявляют сходные химические свойства. Для химии особый интерес представляет энергетическое состояние электронов внешних уровней, так как именно они ответственны за образование химических связей. Энергия ионизации Е1 – минимальная энергия, которую требуется затратить на то, чтобы удалить данный электрон с атомной орбитали невозбужденного атома на бесконечно большое расстояние от ядра без сообщения ему кинетической энергии. Энергия ионизации соответствует следующему процессу: Э + ЕI → Э+ + е, где ЕI - кДж / моль. Энергия ионизации количественно характеризует способность атома удерживать электроны, что является важной характеристикой его химической активности. Энергии ионизации возрастает в периоде по мере увеличения порядкового номера элемента. Наименьшее ее значение имеют щелочные металлы, находящиеся в начале периода. Наибольшее значение энергии ионизации характерно для инертных газов, находящихся в конце периода. В группе элементов энергия ионизации уменьшается с повышением порядкового номера элемента. Это обусловлено увеличением размеров атомов и экранированием внешних электронов внутренними. Сродство к электрону атома ЕА – энергия, которая выделяется (или затрачивается) при присоединении к нейтральному атому электрона с образованием отрицательного иона: Э + е → Э- + ЕА где ЕА - кДж / моль. Сродство к электрону считают положительным, если присоединение электрона сопровождается выделением энергии (ЕА> 0). Если для присоединения электрона нужно затратить энергию, то сродство к электрону считается отрицательным (ЕА<0). Сродство к электрону зависит от электронной структуры атома. Наибольшим сродством к электрону обладают элементы подгрупп 7А (галогены) у большинства металлов и благородных газов сродство к электрону невелико или даже отрицательно. Наименьшее значение сродства к электрону у атомов с заполненными и наполовину заполненными s и р-подуровнями. В подгруппах сверху вниз сродство к электрону атомов уменьшается, но не всегда монотонно. Вследствие экспериментальных трудностей значение сродства к электрону известны не для всех атомов. Понятие электроотрицательности элементов ввел американский физикохимик Полинг. По определению Полинга электроотрицательность – это способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании химической связи. Электроотрицательность зависит от типа соединений, валентного состояния элемента. Поэтому такая характеристика имеет условный характер. Однако ее использование полезно для качественного объяснения типа химических связей и свойств соединений. В периоде электроотрицательность возрастает с увеличением порядкового номера элемента (слева
№36
ВАЛЕНТНОСТЬ (лат. valentia – сила) способность атома присоединять или замещать определенное число других атомов или групп атомов.
Метод
валентных связей
Валентных
связей метод (метод валентных схем),
метод приближенного решения электронного
уравнения Шрёдингера для многоэлектронных
молекулярных систем. Основан на
представлениях о двухцентровых химических
связях между атомами в молекуле,
образуемых двумя электронами. Эти
представления являются обобщением на
многоатомные молекулы приближения
Гайтлера - Лондона, позволившего впервые
с помощью квантовомех. методов объяснить
хим. связь в молекуле Н2.
Осн. физ.
идея В. с. м. состоит в том, что волновая
ф-ция молекулы выражается через волновые
ф-ции составляющих ее атомов. Образование
хим. связи рассматривается как результат
спаривания спинов своб. электронов
атомов. Тем самым В. с. м. дает обоснование
одному из осн. положений теории
валентности: валентность нейтрального
атома равна числу своб. электронов в
его валентной оболочке. Каждому валентному
штриху, соединяющему атомы А и В в
структурной ф-ле молекулы, отвечает
двухэлектронная ф-ция валентной связи
ХАВ(1,2), к-рая представляется в виде
произведения двух волновых ф-ций:
пространственной Ф(1,2), симметричной
относительно перестановки координат
электронов, и спиновой![]() (1,2),
антисимметричной относительно такой
перестановки и описывающей систему
двух электронов с противоположными
спинами; цифры 1 и 2 в этих обозначениях
указывают пространств. координаты или
спиновые переменные первого и второго
электронов либо те и другие одновременно.
Следовательно,
(1,2),
антисимметричной относительно такой
перестановки и описывающей систему
двух электронов с противоположными
спинами; цифры 1 и 2 в этих обозначениях
указывают пространств. координаты или
спиновые переменные первого и второго
электронов либо те и другие одновременно.
Следовательно,
![]() Для
простейшей молекулы Н2 ф-цию Ф(1,2) строят
из 1s-орбиталей атомов Н, обозначаемых
для разных ядер как
Для
простейшей молекулы Н2 ф-цию Ф(1,2) строят
из 1s-орбиталей атомов Н, обозначаемых
для разных ядер как![]() и
и![]() ,
а ф-цию
,
а ф-цию![]() (1,2)
- из одноэлектронных спиновых
ф-ций
(1,2)
- из одноэлектронных спиновых
ф-ций![]() и
и![]() (спин-функций),
описывающих состояния электронов с
противоположно направленными спинами:
(спин-функций),
описывающих состояния электронов с
противоположно направленными спинами:
 Энергия
молекулы
Энергия
молекулы![]() ,
рассчитанная с такой двухэлектронной
волновой ф-циеи Х(1,2), равна:
,
рассчитанная с такой двухэлектронной
волновой ф-циеи Х(1,2), равна:
![]() где
ЕH-энергия атома Н,
где
ЕH-энергия атома Н,![]() -интеграл перекрывания орбиталей (dV-
элемент объема в пространстве координат
одного электрона), I и К -т. наз. кулоновский
и обменный интегралы соответственно.
Кулоновский интеграл учитывает вклад
в энергию связи, обусловленный
электростатич. взаимод. неискаженных
электронных облаков атомов между собой
и с ядром соседнего атома, обменный -
вклад, обусловленный деформацией
электронного облака при образовании
связи и перемещением его в пространство
между ядрами (> 90% энергии связи); см.
также Молекулярные интегралы.
Для
более сложных молекул многоэлектронную
волновую ф-цию представляют в виде
антисимметризированного в соответствии
с принципом Паули произведения всех
двухэлектронных ф-ций типа ХАВ(1,2) и
ф-ций, описывающих состояние электронов
внутр. оболочек, неподеленных электронных
пар и неспаренных электронов, не занятых
в двухцентровых связях. Отвечающее этой
ф-ции распределение "валентных"
штрихов, соединяющих атомы в молекуле,
наз. валентной схемой. Такой подход наз.
приближением идеального спаривания
или приближением локализованных
электронных пар. Электроны соотносят
отдельным атомам и в соответствии с
осн. идеей приближения Гайтлера - Лондона
их состояния описывают атомными
орбиталями. Согласно вариационному
принципу (см. Вариационный метод),
приближенную волновую ф-цию выбирают
так, чтобы она давала миним. электронную
энергию системы или, соответственно,
наиб. значение энергии связи. Это условие,
вообще говоря, достигается при наиб.
перекрывании орбиталей, принадлежащих
одной связи. Тем самым В. с. м. дает
обоснование критерия макс. перекрывания
орбиталей в теории направленных
валентностей. Лучшему перекрыванию
орбиталей, отвечающих данной валентной
связи, способствует гибридизация атомных
орбиталей, т.е. участие в связи не "чистых"
s-, p-или d-орбиталей, а их линейных
комбинаций, локализованных вдоль
направлений хим. связей, образуемых
данным атомом.
Внутриатомные
вклады в энергию молекулы, аналогичные
ЕН, обычно превышают энергию своб. атомов
на величину, называемую энергией
промотирования. Такое превышение
обусловлено электронной перестройкой
атома при переходе его в валентное
состояние, т.е. в состояние, требуемое
для образования хим. связей, а именно:
переходом электронов на энергетически
менее выгодные атомные орбитали (напр.,
с 2s на 2р) при распаривании электронов,
переходом от наиб. выгодных орбиталей
в своб. атоме к менее выгодным гибридным
орбиталям. Образование хим. связи
объясняется тем, что выигрыш в энергии
связи компенсирует затраты энергии на
промотирование атомов.
Дальнейшее
уточнение описания молекулярных систем
в рамках В. с. м. связано с использованием
линейных комбинаций волновых ф-ций
неск. валентных схем. Такой подход обычно
и наз. методом валентных схем. Коэффициенты
в линейной комбинации ф-ций, отвечающих
в приближении идеального спаривания
разл. валентным схемам, возможным для
данной молекулы, определяют вариационным
методом. К валентным схемам относятся
все схемы ковалентных (т. наз. кекулевских)
структур с максимально возможным числом
валентных связей между соседними
атомами, т. наз. дьюаровских структур с
"длинными" связями, в к-рых формально
спарены электроны, принадлежащие
несоседним атомам, а также структур
ионного типа, в к-рых электрон формально
перенесен от одного атома к другому. На
этом основании В. с. м. нередко рассматривают
как мат. обоснование теории резонанса.
Один из простых способов построения
всех валентных схем дается правилами
Румера: каждой однократно занятой
орбитали ставят в соответствие точку
на нек-рой окружности, каждому спариванию
электронов - стрелку, соединяющую две
такие точки. Полученную диаграмму наз.
диаграммой Румера. При построении полной
волновой ф-ции молекулы учитывают все
диаграммы Румера с непересекающимися
стрелками. Диаграммы Румера дают удобный
графич. метод вычисления матричных
элементов гамильтониана на ф-циях
валентных схем через кулоновские,
обменные и др. интегралы. В полуэмпирич.
вариантах В. с. м. кулоновские и обменные
интегралы рассматривают как параметры,
определяемые из спектроскопич. и
термохим. данных, в неэмпирич. вариантах
все молекулярные интегралы точно
рассчитывают (см. Полуэмпирические
методы, Неэмпирические методы).
Последоват. увеличение числа
базисных атомных орбиталей и включение
в расчет все большего числа валентных
схем и электронных конфигураций позволяют
получать практически точное неэмпирич.
решение ур-ния Шрёдингера.
Достоинства
В. с. м.- наглядность качеств. описания
молекул с локализованными связями,
непосредств. аналогия между валентными
схемами и структурными ф-лами, возможность
объяснения многих эмпирич. аддитивных
закономерностей в химии. Однако этому
методу часто предпочитают более простые
по своей структуре молекулярных орбиталей
методы.
-интеграл перекрывания орбиталей (dV-
элемент объема в пространстве координат
одного электрона), I и К -т. наз. кулоновский
и обменный интегралы соответственно.
Кулоновский интеграл учитывает вклад
в энергию связи, обусловленный
электростатич. взаимод. неискаженных
электронных облаков атомов между собой
и с ядром соседнего атома, обменный -
вклад, обусловленный деформацией
электронного облака при образовании
связи и перемещением его в пространство
между ядрами (> 90% энергии связи); см.
также Молекулярные интегралы.
Для
более сложных молекул многоэлектронную
волновую ф-цию представляют в виде
антисимметризированного в соответствии
с принципом Паули произведения всех
двухэлектронных ф-ций типа ХАВ(1,2) и
ф-ций, описывающих состояние электронов
внутр. оболочек, неподеленных электронных
пар и неспаренных электронов, не занятых
в двухцентровых связях. Отвечающее этой
ф-ции распределение "валентных"
штрихов, соединяющих атомы в молекуле,
наз. валентной схемой. Такой подход наз.
приближением идеального спаривания
или приближением локализованных
электронных пар. Электроны соотносят
отдельным атомам и в соответствии с
осн. идеей приближения Гайтлера - Лондона
их состояния описывают атомными
орбиталями. Согласно вариационному
принципу (см. Вариационный метод),
приближенную волновую ф-цию выбирают
так, чтобы она давала миним. электронную
энергию системы или, соответственно,
наиб. значение энергии связи. Это условие,
вообще говоря, достигается при наиб.
перекрывании орбиталей, принадлежащих
одной связи. Тем самым В. с. м. дает
обоснование критерия макс. перекрывания
орбиталей в теории направленных
валентностей. Лучшему перекрыванию
орбиталей, отвечающих данной валентной
связи, способствует гибридизация атомных
орбиталей, т.е. участие в связи не "чистых"
s-, p-или d-орбиталей, а их линейных
комбинаций, локализованных вдоль
направлений хим. связей, образуемых
данным атомом.
Внутриатомные
вклады в энергию молекулы, аналогичные
ЕН, обычно превышают энергию своб. атомов
на величину, называемую энергией
промотирования. Такое превышение
обусловлено электронной перестройкой
атома при переходе его в валентное
состояние, т.е. в состояние, требуемое
для образования хим. связей, а именно:
переходом электронов на энергетически
менее выгодные атомные орбитали (напр.,
с 2s на 2р) при распаривании электронов,
переходом от наиб. выгодных орбиталей
в своб. атоме к менее выгодным гибридным
орбиталям. Образование хим. связи
объясняется тем, что выигрыш в энергии
связи компенсирует затраты энергии на
промотирование атомов.
Дальнейшее
уточнение описания молекулярных систем
в рамках В. с. м. связано с использованием
линейных комбинаций волновых ф-ций
неск. валентных схем. Такой подход обычно
и наз. методом валентных схем. Коэффициенты
в линейной комбинации ф-ций, отвечающих
в приближении идеального спаривания
разл. валентным схемам, возможным для
данной молекулы, определяют вариационным
методом. К валентным схемам относятся
все схемы ковалентных (т. наз. кекулевских)
структур с максимально возможным числом
валентных связей между соседними
атомами, т. наз. дьюаровских структур с
"длинными" связями, в к-рых формально
спарены электроны, принадлежащие
несоседним атомам, а также структур
ионного типа, в к-рых электрон формально
перенесен от одного атома к другому. На
этом основании В. с. м. нередко рассматривают
как мат. обоснование теории резонанса.
Один из простых способов построения
всех валентных схем дается правилами
Румера: каждой однократно занятой
орбитали ставят в соответствие точку
на нек-рой окружности, каждому спариванию
электронов - стрелку, соединяющую две
такие точки. Полученную диаграмму наз.
диаграммой Румера. При построении полной
волновой ф-ции молекулы учитывают все
диаграммы Румера с непересекающимися
стрелками. Диаграммы Румера дают удобный
графич. метод вычисления матричных
элементов гамильтониана на ф-циях
валентных схем через кулоновские,
обменные и др. интегралы. В полуэмпирич.
вариантах В. с. м. кулоновские и обменные
интегралы рассматривают как параметры,
определяемые из спектроскопич. и
термохим. данных, в неэмпирич. вариантах
все молекулярные интегралы точно
рассчитывают (см. Полуэмпирические
методы, Неэмпирические методы).
Последоват. увеличение числа
базисных атомных орбиталей и включение
в расчет все большего числа валентных
схем и электронных конфигураций позволяют
получать практически точное неэмпирич.
решение ур-ния Шрёдингера.
Достоинства
В. с. м.- наглядность качеств. описания
молекул с локализованными связями,
непосредств. аналогия между валентными
схемами и структурными ф-лами, возможность
объяснения многих эмпирич. аддитивных
закономерностей в химии. Однако этому
методу часто предпочитают более простые
по своей структуре молекулярных орбиталей
методы.
№37
Ковалентная связь. Метод валентных связей
Образование ковалентной связи можно рассматривать в рамках двух методов квантовой химии: метода валентных связей и метода молекулярных орбиталей.
В 1916 г. американский ученый Льюис высказал предположение о том, что химическая связь * образуется за счет обобществления двух электронов. При этом электронная оболочка атома стремится по строению к электронной оболочке благородного газа. В дальнейшем эти предположения послужили основой для развития метода валентных связей. В 1927 г. Гайтлером и Лондоном был выполнен теоретический расчет энергии двух атомов водорода в зависимости от расстояния между ними. Оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины * взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах на энергетической кривой имеется минимум, т.е. образуется устойчивая система – молекула водорода Н2 (рисунок 3.4).
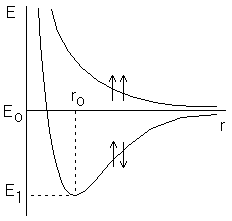
Рисунок 3.4 – Зависимость энергии от расстояния между атомами водорода при однонаправленных и противоположно направленных спинах.
Межъядерное расстояние r0, соответствующее минимуму, называется длиной связи, а энергия связи равна глубине потенциальной ямы E0–E1, где Е0 – энергия двух невзаимодействующих атомов, находящихся на бесконечном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. Такая химическая связь называется ковалентной.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Примеры построения валентных схем:
![]()
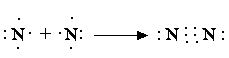
В валентных схемах наиболее наглядно воплощены представления Льюиса об образовании химической связи путем обобществления электронов с формированием электронной оболочки благородного газа: для водорода – из двух электронов (оболочка He), для азота – из восьми электронов (оболочка Ne).
