
- •1. Тепловые эффекты химических реакций. Экзотермические и эндотермические реакции. Теплоты сгорания и образования.
- •Шпаргалки (шпора) по Химии.
- •2. Закон Гесса. Следствия из закона Гесса.
- •Теплота растворения.
- •Энтропия и её изменения при химических процессах и фазовых периодах.
- •Кинетика. Понятие о скорости химических реакций. Гомогенные и гетерогенные системы.
- •Факторы, влияющие на скорость химической реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс в гомогенной и гетерогенной системах.
- •Влияние температуры на скорость реакции. Энергия активации.
- •Катализ. Теория промежуточных соединений
- •Химическое равновесие. Константа химического равновесия.
- •Смещение химического равновесия при изменении концентрации веществ и температуры. Принцип Ле Шателье.
- •Общие понятия о дисперсных системах и растворах. Классификация дисперсных систем.
- •12. Образование растворов. Классификация растворов.
- •Растворы неэлектролитов. 2 закон Рауля.
- •Явление осмоса. Осмотическое давление.
- •16. Основы электролитической диссоциации. Константа диссоциации.
- •17. Растворы электролитов. Степень диссоциации и её зависимость от концентрации растворённого вещества (закон разбавления Оствальда) и температуры.
- •18. Способы выражения концентрации.
- •2 Ответ
- •20. Ионное произведение воды, pH растворов.
- •2 Ответ
- •21. Гидролиз солей.
- •22. Степень гидролиза. Влияние условий на степень полноты гидролиза: природа веществ, температура и концентрация веществ.
- •24. Адсорбция на поверхности раствор-газ. Уравнение Гиббса
- •25. Адсорбция газов и растворенных веществ твердыми сорбентами. Уравнение Френдлиха и Ленгмюра.
- •В некоторых случаях применяется уравнение Ленгмюра вида:
- •2. Уравнение изотермы адсорбции теории бэт
- •В некоторых случаях применяется уравнение Ленгмюра вида:
- •2. Уравнение изотермы адсорбции теории бэт
2. Закон Гесса. Следствия из закона Гесса.
В основе термохимических расчетов лежит закон, открытый русским ученым Г. И. Гессом в 1840 г. Закон гласит: тепловой эффект реакции зависит от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода (из начального состояния в конечное).
Или иначе: тепловое эффект реакции равен алгебраической сумме тепловых эффектов всех его промежуточных стадий:
ΔН = ΔН1 + ΔН2.
Рассмотрим пример получения диоксида углерода СО2 из графита, которую можно представить в виде ряда последовательных реакций, каждая из которых сопровождается своим тепловым эффектом (изменением энтальпии):
С(графит) + 1/2О2(г) = СО(г) |
|
ΔН1 I стадия. |
СО(г)+1/2О2(г)= СО2(г) |
|
ΔН2 II стадия. |
Или суммарно:
С(графит) + О2(г) = СО2(г)![]() ΔН.
ΔН.
Представим в виде схемы:
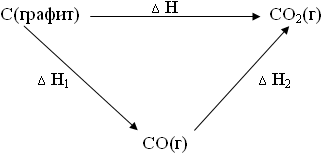
Очевидно:
ΔН = ΔН1 + ΔН2 или ΔН1 + ΔН2 + (–ΔН) = 0.
Это обозначает, что если все три процесса удовлетворяют требованию Тисх.= Тконечн. и Рисх. = Рконечн., то не зависимо от того, сгорает графит сразу в СО2 или сначала в СО, а затем СО в СО2, тепловой эффект будет одним и тем же.
Следствия из закона Гесса:
Если в результате последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций будет равна нулю.
Тепловой эффект реакций (ΔНх.р.) равен сумме теплот образования (или ΔНобр.) конечных веществ (ΔНконеч. в-в) за вычетом суммы теплот образования исходных веществ (ΔНисх. в-в):
ΔНх.р. = Σ ΔНпрод. р-ции – Σ ΔНисх. в-в.
Теплота растворения.
Растворы - это однофазные системы переменного состава, состоящие из нескольких компонентов, один из которых является растворителем, а другие - растворенными веществами. То, что растворы однофазные системы, роднит их с химическими соединениями, а то, что они являются системами переменного состава, сближает их с механическими смесями. Поэтому и считают, что растворы имеют двойственную природу: с одной стороны, они сходны с химическими соединениями, а с другой — с механическими смесями.
Растворение - это физико-химический процесс. При физическом явлении разрушается кристаллическая решетка и происходит диффузия молекул растворенного вещества. При химическом явлении в процессе растворения молекулы растворенного вещества реагируют с молекулами растворителя.
Процесс растворения сопровождается выделением или поглощением теплоты. Эту теплоту, отнесенную к одному молю вещества, называют тепловым эффектом растворения, Qp.
Общий тепловой эффект растворения зависит от тепловых эффектов:
а) разрушения кристаллической решетки (процесс всегда идет с затратой энергии — Q1);
б) диффузии растворенного вещества в растворителе (затрата энергии - Q2);
в) гидратации (выделение теплоты, +Q3, так как гидраты образуются за счет возникновения непрочной химической связи, что всегда сопровождается выделением энергии).
Общий тепловой эффект растворения Qp будет равен сумме названных тепловых эффектов: Qp = (-Q1) + (- Q2) + (+Q3); если Q1> Q3> то растворение идет с поглощением теплоты, то есть процесс эндотермический, если Q1< Q3, то растворение идет с выделением теплоты, то есть процесс экзотермический. Например, растворение NaCl, KN03, NH4CNS идет с поглощением теплоты, растворение NaOH, H2S04 — с выделением теплоты.
Задача. Почему при растворении в воде хлорида натрия температура раствора понижается, а при растворении серной кислоты — повышается?
Ответ. При растворении хлорида натрия идет разрушение кристаллической решетки, что сопровождается затратой энергии. На процесс диффузии затрачивается незначительное количество энергии. Гидратация ионов всегда сопровождается выделением энергии. Следовательно, если в процессе растворения понижается температура, то энергия, необходимая для разрушения кристаллической решетки, оказывается большей, чем энергия, выделяющаяся при гидратации, и в целом раствор охлаждается.
Тепловой эффект растворения серной кислоты состоит, главным образом, из теплоты гидратации ионов, поэтому раствор разогревается.
Растворимость вещества — это его способность распределяться в среде растворителя. Растворимость (или коэффициент растворимости) определяется максимальным количеством граммов вещества, которое может раствориться в 100 граммах растворителя при данной температуре.
Растворимость большинства твердых веществ увеличивается с нагреванием. Есть исключения, то есть такие вещества, , растворимость которых с увеличением температуры мало меняется (NaCl) или даже падает (Са(ОН)2).
Растворимость газов в воде падает с нагреванием и увеличивается с повышением давления.
Растворимость веществ связана с природой растворенного вещества. Полярные и ионные соединения, как правило, хорошо растворяются в полярных растворителях, а неполярные соединения - в неполярных растворителях. Так, хлороводород и аммиак хорошо растворяются в воде, тогда как водород, хлор, азот растворяются в воде значительно хуже.
