
13. Изменение свободной энергии при изотермическом расширении и сжатии
Свобо́дная
эне́ргия [F]— термодинамический потенциал,
убыль которого в квазистатическом
изотермическом процессе равна работе,
совершённой системой над внешними
телами.
В обратимых изотермических
процессах свободная энергия характеризует
способность системы совершать работу.
Работа в таких процессах совершается
за счет убыли свободной энергии .
 При
изотермическом расширении, когда работа
положительна, то свободная энергия
убывает, и наоборот при сжатии работа
отрицательна, а свободная энергия
возрастает, за счет внешних сил, сжимающих
тело. Система не может совершить работу,
превышающую ее свободную энергию.
В
механике энергия тела равна сумме
потенциальной и кинетической энергий.
Оба этих вида энергий макроскопических
тел могут быть полностью преобразованы
в механическую работу. Внутренняя
энергия молекулярной системы, в
интересующем нас случае, не может быть
целиком превращена в работу. Посмотрим,
чем отличаются свободная энергия и
внутренняя . При изотермическом расширении
идеального газа от объема до объема
работа одного моля
При
изотермическом расширении, когда работа
положительна, то свободная энергия
убывает, и наоборот при сжатии работа
отрицательна, а свободная энергия
возрастает, за счет внешних сил, сжимающих
тело. Система не может совершить работу,
превышающую ее свободную энергию.
В
механике энергия тела равна сумме
потенциальной и кинетической энергий.
Оба этих вида энергий макроскопических
тел могут быть полностью преобразованы
в механическую работу. Внутренняя
энергия молекулярной системы, в
интересующем нас случае, не может быть
целиком превращена в работу. Посмотрим,
чем отличаются свободная энергия и
внутренняя . При изотермическом расширении
идеального газа от объема до объема
работа одного моля
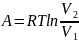 Правая
часть представляет собой убыль свободной
энергии , и она тем больше, чем больше
отношение объемов, т.е. чем сильнее
сжатие газ. А, напомним, внутренняя
энергия идеального газа не зависит от
объема.
В изотермическом процессе
сжатый газ совершает работу за счет
подводимого тепла, но мы говорим о
свободной энергии газа, т.к. работу
совершает газ.
В общем случае,
когда процесс протекает необратимо,
совершаемая работа меньше чем в обратимом
процессе, т.е. меньше чем изменение
свободной энергии.
Правая
часть представляет собой убыль свободной
энергии , и она тем больше, чем больше
отношение объемов, т.е. чем сильнее
сжатие газ. А, напомним, внутренняя
энергия идеального газа не зависит от
объема.
В изотермическом процессе
сжатый газ совершает работу за счет
подводимого тепла, но мы говорим о
свободной энергии газа, т.к. работу
совершает газ.
В общем случае,
когда процесс протекает необратимо,
совершаемая работа меньше чем в обратимом
процессе, т.е. меньше чем изменение
свободной энергии.
TdS>δQ, δA< -dF Возможны так же случаи, когда изменение свободной энергии не сопровождается совершением работы, например, расширение газа в пустоту. Работ не совершается, внутренняя энергия не изменяется, а способность совершать работу падает. Это так, потому что процесс расширения газа в пустоту необратим полностью, хотя и изотермический. Свободная энергия , так же как и внутренняя энергия является функцией состояния системы. А это вытекает из того, что при обратимом изотермическом процессе, при переходе из состояния 1 в состояние 2 и обратно в 1, работа ΔA=0 следовательно, в таком переходе работа не зависит от пути, а только от начального и конечного состояния системы. Рассмотрим I начало для изотермического процесса TdS=dU+δA, T-const, dTS-dU=δA,
δA=-(dU-dTS)=-d(TS-U)=-dF Мы нашли выражение для функции свободной энергии F=U-TS, U=F+TS Внутренняя энергия системы состоит из суммы свободной и связанной энергий системы. Свободную энергию можно рассматривать как потенциальную энергию системы, находящуюся при постоянных температуре и давлении и . Поэтому условием равновесия
ТД системы будет условие минимума свободной энергии.
42. Общие сведения о катализе.
Катализ состоит в том, что скорости хим реакции могут существенно изменятся при введения в систему относительных и больших веществ, катализаторов. Различают гомогенный катализатор при котором катализатор находится в одной фазе с реагирующими веществами.
Гетерогенный, реакция проходит на поверхности катализатора.
В присутствии катализатор создает возможность проведения новых элементарных реакций, при которых реакция протекает с большой или меньшей скоростью. В гомогенном катализе такое ускорение обусловлено образованием промежуточных соединений.
В реакции SO2+1/2 O2 =SO3 катализатором является окись азота.
NO+1/2 O2 = NO2
NO2+SO2 =NO+SO3
Для катализатора характерна специфичность, способность взаимодействовать на определении реакции. При пропускании паров этилового спирта над Cu и Ni идет разложение, => выделяется Н2, при t=300oC. Глинозем при соотв обработке, сильно собирает воду, явл хорошим катализатором, для реакции d-деградации. В присутствии глинозема реакция терм распада спирта идет по другому пути.
С2Н5ОН =Н2О +С2Н4
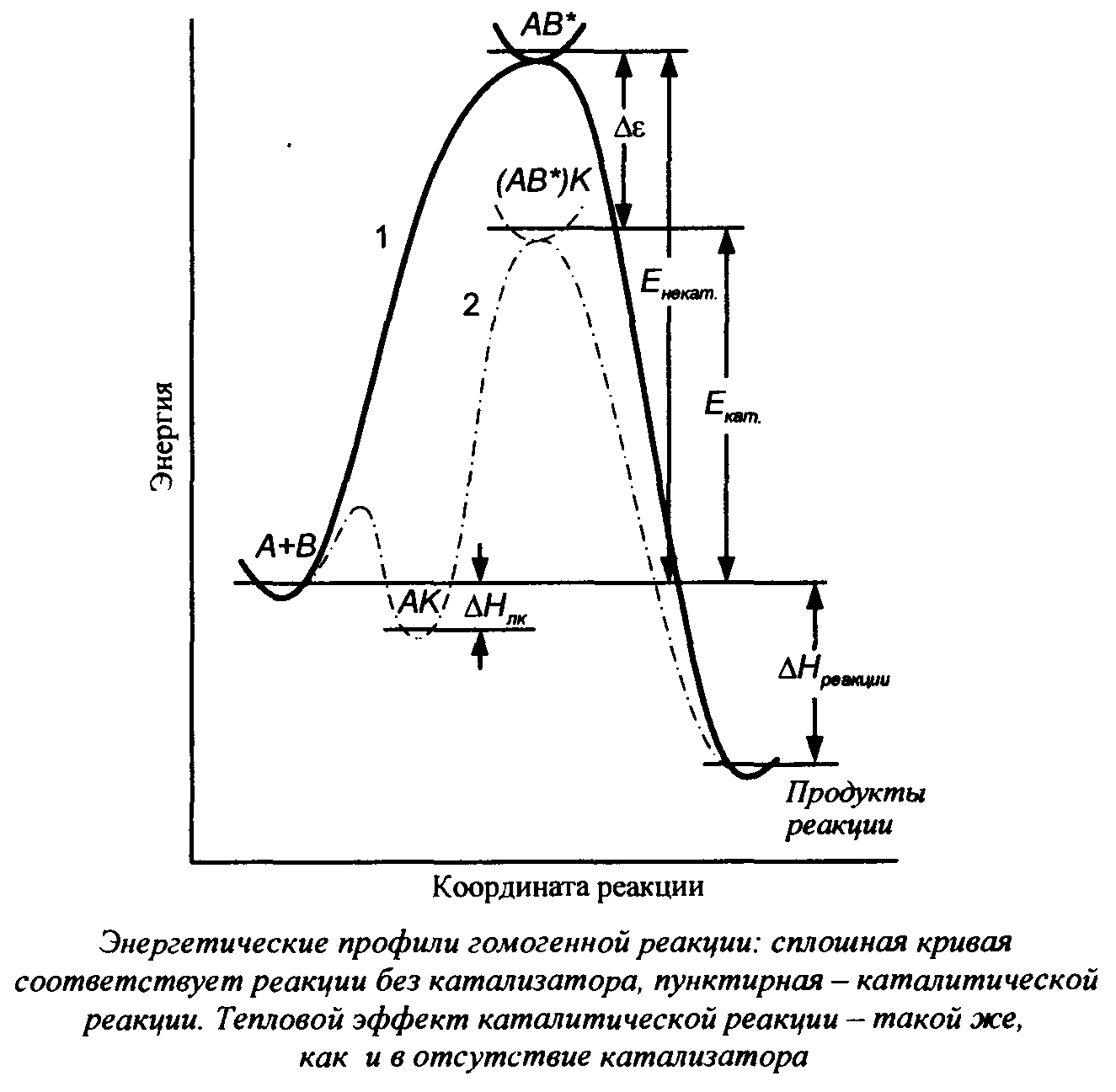
ΔЕ=Е-Ек
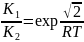
ΔE=40кДж/моль, при Т=300К
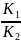 =9*106
=9*106
В применение катал не может изменить состояние равновесия, а лишь ускоряет (замедляет) скорость с которой происходит это состояние. Равновесию отвечают min свободной энергии, т.к. мы не смещаем равновесие, то он в один устанавливает и прямой и обратный реакции.
При гетерогенном катализе часто изменяются физ свойства катализа, в частности свойства поверхности. Кроме того свойства тв катал могут ухудшаться из-за отравления их поверхности вследствие абсорбции посторонних веществ, так и в результате протекания самой реакции. В ряде случаев смесь катализаторов оказывает больше, чем каждый в отдельности. Иногда добавление малого кол-ва в-ва проводит к значительному увеличению катал активности- промотеры.
В другом случае добавление в-в замедляет протекание определенной реакции, например окисление растворов сульфита натрия замедляется в присутствии ряда органических веществ.
