
- •1.Факторы, влияющие на растворимость газов. В предельно разбавленных растворах растворимость газов пропорциональна их парциальному давлению над раствором -з-н Генри).
- •2.Зависимость растворимости газа от температуры.
- •Соударения молекул газа с поверхностью жидкости
- •3.Факторы,влияющие на растворимость газов в жидкостях
- •Природа растворённого газа и растворителя
- •Давление газа
- •Присутствие др. Вещ-в ( особенно электролитов)
- •4.Типы растворов жидкостей в жидкостях, причины их разнообразия.
- •5.Идеальные растворы. Построение их диаграммы «давление – состав», температура кипения – состав.
- •6.Вывод зависимости давления насыщенного пара смеси от состава жидкой и паровой фаз.
- •7. Реальные р-ры жидкостей неограниченно растворимые друг в друге. Причины отклонения давления паров над раствором от з-на Рауля.
- •8.Диаграммы давление –состав и температура – состав для реaльных растворов
- •9.Первый з-н Канавалова
- •10.Методы разделения смесей. Ректификация.
- •11. Диаграмма состояния р-ров ,образующих азеотропы.2й з-н Коновалова.
- •Термодинамическое док-во II з-на Кановалова
- •12.Диаграмма «давление – состав» и «температура – состав» Жидкости, ограниченно растворимых друг в друге.
- •13.Диаграммы “Давление-состав” и “температура-состав” для жидкостей, взаимно нерастворимых друг в друге.
- •15. Трехкомпанентные системы. Графическое представление. Определение методами Розебома и Гиббса.
- •19.Проводимость в газах, жидкостях и твердых телах. Электропроводность удельная и эквивалентная. Основные полож-я теории сильных эл-тов. Термодтнамика р-ров сильных эл-тов.
- •20. Скорость движ-ния иона,абсолютная ск-сть движ-я иона,подвижность.
- •21. Вывод уравнения, связывающего эквивалентную электропроводность с подвижностями ионов.
- •23.Влияние различных факторов на электропроводность для р-ров сильных электролитов.
- •25. Ионная сила р-ра. Ионный радиус, ионная атмосфера. Электрофоретическое и релаксационное торможение. Эффект Вина,понятие дисперсии электропроводности.
- •26. Активности и коэффициенты активности электролитов. Вычисление средних коэффициентов активности ионов.
- •27. Кондуктометрическое титрование как метод определения точки эквивалентности при титровании, изменения состава растворов для расчета степени диссоциации, констант диссоциации.
- •28. Понятие об электродвижущих силах, полуэлементе, элементе. Термодинамический вывод уравнения для определения электродного потенциала, уравнение Нернста.
- •29. Термодинамика гальванических элементов.
- •30. Водородный скачок потенциала. Стандартные электродные потенциалы.
- •31. Виды гальванических элементов. Электроды 1-го и 2-го рода. Обратимые, необратимые цепи. Знаки эдс-элементов. Вычисление эдс обратимого гальванического элемента.
- •32. Окислительно-восстановительные электроды или редокс-элементы.
- •33. Химические цепи. Уравнение для расчета эдс.
- •34. Концентрационные цепи. Уравнение для расчета эдс
- •35. Диффузионный скачок потенциала.
- •Потенциометрическое титрование. Электрохимические методы определения рН растворов.
- •Основные понятия химической кинетики: молекулярность, скорость реакции (начальная, истинная и средняя), константа скорости.
- •Вывести уравнение Аррениуса. Энергия активации. Предэкспоненциальный множитель. Методы их определения.
- •39. Порядок реакции по реагенту и методы его экспериментального определения. Лимитирующая стадия химического процесса.
- •Вывод интегрального кинетического уравнения для необратимой и обратимой реакции первого порядка.
- •Вывод интегрального кинетического уравнения для необратимой реакции второго порядка.
- •Вывести уравнение кинетики для параллельных реакций.
- •Вывести уравнение кинетики для гомогенной необратимой последовательной реакции первого порядка
- •Вывести уравнение скорости процесса в потоке, режим идеального вытеснения в стационарных условиях.
- •45. Кинетика гомогенных реакций первого порядка, протекающих в условиях идеального перемешивания.
- •Теория активных соударений и расчет скорости по числу соударений.
- •47. Теория переходного состояния и вывод основного уравнения.
- •50.Кинетика р-ий с неразветвленными цепями.
- •51.Вывод кинетических уравнений цепных р-ий в стационарном приближении
- •52.Пределы воспламенения и взрыва. Механизмы вопламенения.
- •53. Связь кинетики и макрокинетики при протекании экзотермических реакций (теория теплового взрыва)
- •Теория теплового взрыва была разработана в работах Зельдовича и Франк-Каменецкого. Кратко рассмотрим анализ теплового режима в случае сильно экзотермической реакции.
- •Где cp и r означают молярную теплоемкость и плотность газообразной смеси. Окончательное выражение для критической температуры t* имеет вид
- •55.Особенности кинетики р-ий в р-рах. Влияние природы р-рителя на скорость процесса, ур-ие Бренстеда.
- •56. Влияние ионной силы и давления на кинетику реакций в растворе.
- •Если в бимолекулярной реакции реагенты а и в представляют собой ионы с зарядами zА и zВ, и заряд ак z* в линейном приближении равен сумме
- •Тогда из выражения (5.7) можно выразить влияние ионой силы j на константу скорости реакции в растворе:
- •Или для водных растворов
- •58.Общий и специфич. Кислотно-основ.Катализ.
- •59.Катализ комплексами переходных металлов и ферментатив.Катализ.
- •63.Температурная зависимость наблюдаемой скорости реакции
- •70.Топохимические реакции.
-
Теория активных соударений и расчет скорости по числу соударений.
В теории АС реагирующие частицы упрощенно считаются упругими шарами. Поскольку для протекания реакции необходимо столкновение 2 частиц (1й ПК), суммарная энергия которых ≥ Еа (2й ПК), для расчета скорости реакции необходимо рассчитать число столкновений (z) в единицу времени, в единице реакционного пространства и найти долю активных соударений (ε). Произведение zε будет представлять собой расчетную скорость реакции. Активными считаются соударения, в которых система частиц имеет энергию Е≥Еа.
В качестве реакционного пространства выберем т. н. цилиндр соударений с диаметром (δAB), равным полусумме диаметров молекул А и В, и высотой, равной длине свободного пробега (l0) между двумя столкновениями. Очевидно, что l0 равна произведению средней скорости движения молекул (ω) на время между двумя столкновениями Δt.
l0=ωΔt



 А
А
В
Рис. 13. Цилиндр соударений молекул A и B
Выразим скорость движения молекул согласно кинетической теории газов
ω = [8RTμ/π] 0,5 (3.1)
где μ = (Ма + Мв)/Ма•Мв – функция молекулярных масс реагентов. Тогда число столкновений молекул А и В в единицу времени Δt, в единичном цилиндре определяется выражением:
z0 = 5,01•δAB2 [RTμ] 0,5 (3.2)
Величина z0 при единичных концентрациях А и В имеет порядок 1011 (М•с)-1. Полное число соударений в единицу времени в единице реакционного пространства равно Z = z0•nAnB, где nA и nB число молекул реагентов в указанном пространстве. Для расчета числа соударений молекул А с молекулами В и перехода к концентрации надо умножить Z на число Авогадро NA.
Доля активных соударений определяется функцией распределения молекул по энергии Максвелла-Больцмана, согласно которой
ε =![]() = exp(-Ea/RT) (3.3)
= exp(-Ea/RT) (3.3)
Заметим, что доля активных соударений растет с температурой существенно быстрее, чем кинетическая энергия частиц. Например, при увеличении температуры от 1000 до 2000К средняя кинетическая энергия частиц увеличивается в 2 раза, а доля молекул с энергией Е≥ 80 кДж/моль возрастает приблизительно в 150 раз.
Таким образом, перемножая уравнения 2 и 3, получим расчетное выражение скорости реакции по теории АС:
r = 5,01CACBNA δAB2 [RTμ] 0,5·exp(-Ea/RT) (3.4)
При сопоставлении (3.4) с уравнением кинетики видно, что величина константы скорости по теории АС имеет вид:
k = 5,01NA δAB2 [RTμ]0,5·exp(-Ea/RT), (3.5)
где А = 5,01NA δAB2 [RTμ] 0,5
Теория АС позволяет рассчитать только величину k, а Еа определяют экспериментально. Из уравнения 5 видно, что предэкспоненциальный множитель слабо зависит от температуры (как Т1/2). Поэтому экспериментальная величина Ен, найденная по уравнению Аррениуса, будет отличаться от истинной Еа на величину, которую можно найти из (3.5) после логарифмирования:
ln k = lnA + ½ ln T -Ea/RT (3.6)
и дифференцирования этого выражения:
d(ln k) = 1/(2T) -Ea/RT2 = (Ea + ½ RT)/RT2 (3.7)
Следовательно, найденная Ен будет отличаться от истинной Еа на ½ RT. Ввиду малости этой поправки (составляет 1-1,5 кДж/моль в интервале 300-400К и 4,2 при 1000К) ею обычно пренебрегают.
А+В
![]() С
С
К – константа скорости.
Для молекул разного сорта общее число бимолекулярных столкновений определяется по уравнению:
![]() ,
где
,
где
rAB – диаметр, равный сумме двух радиусов rA и rВ молекул А и В
n’A, n’B – число активных молекул газа в 1 см3
МА, МВ – молекулярные массы А и В
Величина средней арифметической скорости w определяется по формуле
![]()
Число активных молекул А и В может быть рассчитано по закону Больцмана
![]()
![]()
Число активных столкновений в 1 см3 в единице времени будет равно
![]() (5)
(5)
Суммарная энергия будет равна
Е = Е1 + Е2 (6)
Подставим (6) в (5)
![]()
Зная что
-(∂Ca/∂τ)v = ZAB/Ni
Ni = NA/22400
Ni – число молекул в 1 см3
![]() -число
молекул в 22400 см3
-число
молекул в 22400 см3
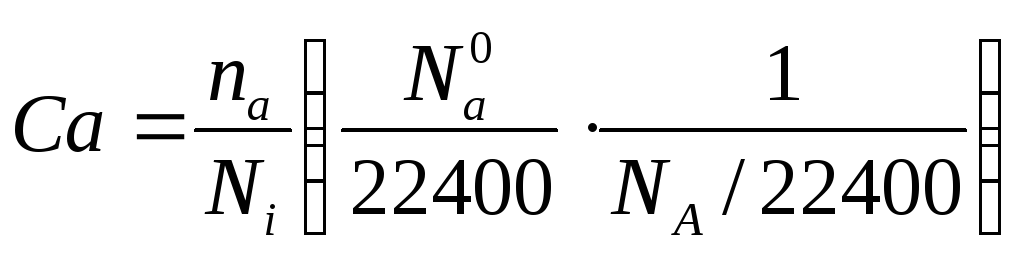
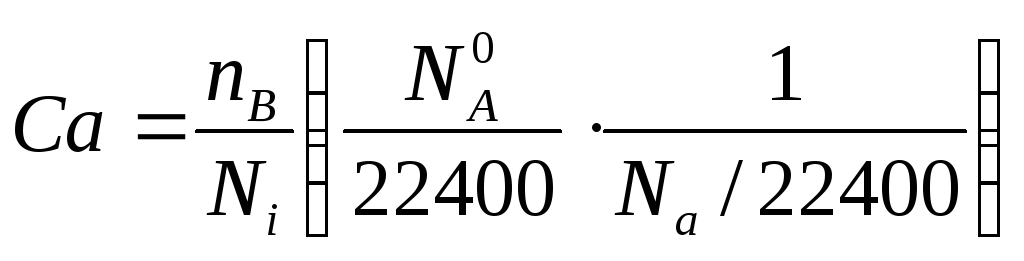
Согласно основному постулату кинетики
-(∂Ca/∂τ)v = KCaCB или -(∂Ca/∂τ)v = K∙nanB/(Ni)2 (*)
Подставим (*) в (8)
 находим
К: К = К0e-E/RT,
находим
К: К = К0e-E/RT,
Где K0=![]()
