
- •Содержание
- •1 Аналитический обзор 11
- •2 Методическая часть 29
- •3. Экспериментальная часть 37
- •4 Обсуждение результатов эксперимента 44
- •Условные обозначения
- •Введение
- •1 Аналитический обзор
- •1.1 Регулярные мультимолекулярные структуры
- •1.2 Хроматография
- •1.2.1 Металл-аффинная хроматография – сочетание принципов лигандообменной и аффинной хроматографии
- •1.3 Методы характеризации сорбентов
- •1.3.1 Удельная поверхность
- •1.3.2 Емкость сорбента, влажность
- •1.3.3 Электрокинетический потенциал
- •1.4 Maldi масс-спектрометрия
- •1.5 Идентификация белков – метод pmf
- •1.6 Тандемная масс-спектрометрия (мс-мс) и идентификация пептиов по фрагментным масс-спектрам
- •1.7 Идентификация пост-трансляционных модификаций
- •1.8 Аддукты зомана с сывороточным альбумином
- •2 Методическая часть
- •2.1 Используемые материалы:
- •2.2 Методики получения сорбента и исследования
- •2.2.1 Получение рмм (FeIii) сорбента
- •2.2.2 Определение удельной поверхности сорбента
- •2.2.3 Определение сорбционной емкости сорбента
- •2.2.3.1 Проведение металл-аффинного анализа
- •2.2.3.2 Определение влажности рмм Fe(III) сорбента
- •2.2.3.3 Определение влажности коммерческого сорбента
- •2.2.4 Анализ фосфорилированных пептидов казеина молока коровы
- •2.2.4.1 Выделение суммарного белка из обезжиренного сухого молока
- •2.2.4.2 Гидролиз суммарного белка молока коровы в присутствии трипсина
- •2.2.5 Анализ фосфонилированных пептидов сывороточного альбумина человека
- •2.2.5.1 Гидролиз сывороточного альбумина человека в присутствии пепсина
- •2.2.6 Масс-спектрометрический анализ
- •2.2.6.1 Масс-спектрометрический анализ методом maldi-tof и maldi-tof-tof
- •2.2.6.2 Обработка данных масс-спектрометрического анализа
- •3. Экспериментальная часть
- •3.1. Получение рмм Fe(III) сорбента
- •3.2 Определение удельной поверхности
- •3.3 Определение электрокинетического потенциала и размера частиц.
- •3.4 Определение сорбционной емкости сорбента
- •3.4.1Проведение металл-аффинного анализа
- •3.4.2 Определение содержание пептида в проскоке и контрольном образце
- •3.4.3 Определение влажности коммерческого сорбента и рммс Fe(III)
- •3.5 Анализ фосфорилированных пептидов казеина молока коровы
- •3.5.1 Приготовление микроколонки с сорбентом
- •3.5.2 Металл-аффинная хроматография на коммерческом сорбенте
- •3.5.3 Металл-аффинная хроматография на рммс Fe(III)
- •3.6 Анализ фосфонилированных пептидов сывороточного альбумина человека
- •3.6.1 Приготовление металл-аффинной колонки
- •3.6.2 Выбор элюэнта
- •3.6.3 Металл-аффинная хроматография на коммерческом сорбенте
- •3.6.4 Металл-аффинная хроматография на рммс Fe(III)
- •3.7 Масс-спектрометрический анализ
- •3.7.1 Проведение масс-спектрометрического анализа
- •4 Обсуждение результатов эксперимента
- •4.1 Охарактеризация сорбента
- •4.1.1. Получение рмм сорбента, содержащего ионы железа (III) и приготовление хроматографических колонок.
- •4.1.2 Определение удельной поверхности
- •4.1.3 Определение емкости сорбента
- •4.1.4 Микроэлектрофоретические исследования.
- •4.1.4.1 Определение электрокинетического потенциала
- •4.1.4.2 Расчет удельной поверхности рмм сорбента
- •4.2 Исследование возможности специфичного выделения фосфорилированных пептидов из биологического образца методом металл-аффинной хроматографии с использованием рммс(Fe III)
- •4.3 Разработка метода металл-аффинного выделения прямых ковалентных аддуктов зомана с сывороточным альбумином с помощью рмм сорбентов Fe(III) для последующего масс-спектрометрического анализа
- •4.3.1 Поиск и идентификация аддуктов сывороточного альбумина человека с зоманом
- •4.3.2 Выделение фосфонилированных пептидов сывороточного альбумина человека с использованием рммс (Fe III)
- •4.3.2 Масс-спектрометрическая идентификация сайтов связывания зомана с альбумином при взаимодействии с белками in vitro
- •Выводы по работе:
- •Список использованных источников.
- •Приложение а Технико-экономическая оценка научно-исследовательской работы Обоснование договорной цены на разработку
- •Расчет затрат на научно-исследовательскую разработку
- •Расчет затрат на сырье, материалы, реактивы, покупные изделия и полуфабрикаты
- •Расчет затрат на энергоресурсы
- •Расчет затрат на приборы, оборудование для научно-экспериментальных работ и суммы амортизационных отчислений
- •Расчет затрат на оплату труда с обязательными начислениями
- •Прочие затраты Расчет суммы расходов по использованию вычислительной техники.
- •Затраты на выполнение специальных анализов.
- •Расчет суммы накладных расходов
- •Расчет сметы затрат на разработку
- •Приложение б Охрана труда и окружающей среды
- •1 Опасные и вредные производственные факторы
- •2 Пожарная безопасность
- •3 Обеспечение санитарно-гигиенических условий
- •4 Вентиляция
- •5 Аптечка и ее содержание
- •6 Освещение помещения
- •7 Безопасность выполнения работы в лаборатории
- •8 Анализ технологических операций
- •9 Меры первой помощи
- •Охрана окружающей среды
- •Приложение в
- •Приложение г Масс-спектры смеси триптических пептидов казеина, элюированных с колонки с сорбентом, содержащим ионы железа.
1.7 Идентификация пост-трансляционных модификаций
Часть пептидов, содержащихся в подготовленной для МС-анализа пробе, так или иначе, модифицированы, соответственно, модификации можно разделить на две группы:
-
Пост-трансляционные модификации, являющиеся следствием присоединения каких-либо функциональных групп. Например, фосфорилирование, ацетилирование и т. п.
-
Модификации, возникшие в процессе пробоподготовки.
Эти модификации представляют наибольший интерес, поскольку именно они связаны с жизненным циклом клетки. Методами масс-спектрометрии легко детектируют модификации первого типа. (МС-МС)-анализ зачастую позволяет выявить место присоединения фосфатного остатка - аминокислоту в последовательности пептида. Современным методом хроматографического разделения и получения образца, обогащенного фосфорилированными пептидами, является металл-аффинная хроматография.
Каждая из модификаций проявляется в масс-спектрах за счет характерного изменения массы аминокислотного остатка. Во фрагментных спектрах это выглядит как смещение серий пиков на определенную величину, соответствующую массе присоединенной функциональной группы. Именно по этой разнице и, в некоторых случаях, по нейтральным потерям, определяется точная локализация модификации.
1.8 Аддукты зомана с сывороточным альбумином
Альбумин – основной белок плазмы крови, его доля составляет (55- 65)% от всех белков плазмы. Структура и аминокислотная последовательность альбумина хорошо изучены. Так альбумин человека (HSA) имеет в своем составе 585 аминокислот и каждому аминокислотному остатку присвоен свой номер в последовательности. Альбумин поддерживает коллоидно-осмотическое давление плазмы, является транспортным белком и депо для большего количества неполярных молекул и лекарственных веществ, а так же служит эндогенным источником аминокислот. В основе транспортной функции альбумина лежит его способность давать комплексы с различными соединениями, в частности с билирубином, антибиотиками, гормонами, жирными кислотами, барбитуратами и многими другими веществами, а также с отдельными ионами кальция. Кроме того, в состав сывороточного альбумина входит достаточно аминокислот, содержащих гидроксигруппы, что делает его вероятной мишенью присоединения ФОС, в число которых входит зоман (условное название GD). Зоман - производное метилфосфоновой кислоты, боевое отравляющее вещество, проявляющее нервнопаралитическое действие по отношению к животным.
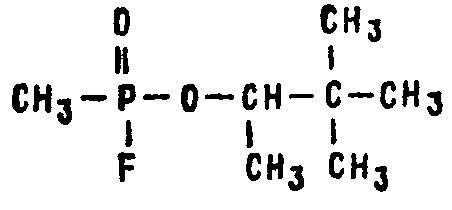
Рисунок 1.8.1 - Пинаколиловый эфир метилфторфосфоновой кислоты (зоман)
С помощью метода масс-спектрометрии было выявлено, что сывороточный альбумин человека способен ковалентно связываться, образуя прямые аддукты, со многими ФОС: параоксоном [3], VX, DFP (диизопропилфторфосфат), зарином, зоманом (рисунок 1.8.2), табуном, CPO (хлорпирифос оксон), ФП-биотином и дихлофосом [23,24]. Было установлено, что наиболее прочные аддукты с ФОС образует аминокислота тирозин-411 (Y-411), которая находится на поверхности белка, при этом остаток ФОС не гидролизируется со временем [25].
Рисунок 1.8.2 - Механизм присоединения зомана к тирозину.
Следует отметить, что альбумин достаточно удобен для масс-спектрометрического анализа, поскольку он содержит достаточное количество аминокислотных остатков лизина и аргинина (а именно по этим сайтам происходит разрыв пептидных связей при проведении триптического гидролиза), что дает хороший набор триптических пептидов с массами, подходящими для масс-спектрометрического детектирования. Выбор альбумина так же обусловлен его доступностью. Во-первых, коммерческий препарат достаточно дешев, во-вторых, альбумин может быть легко выделен.
Однако, существуют определенные трудности при поиске пептидов, модифицированных фосфорсодержащими соединениями, который может быть осложнен тем, что, во-первых, обычно количество сигналов модифицированных пептидов в спектре меньше, чем немодифицированных, и, во-вторых, интенсивность сигналов модифицированных пептидов значительно ниже.
Образование аддукта с участием Y-411 и GD значительно зависит от применяемых концентраций ФОС. Полное модифицирование на Y-411 было достигнуто при инкубации с четырехкратным молярным избытком зомана. Для сравнения, было установлено, что 40-кратный молярный избыток DFP и дихлофоса полностью модифицировал Y-411 в чистом альбумине [26]. При обработке эквимолярными количествами или при небольшом стехиометрическом недостатке соотношения сигналов GD-меченых пептидов к общей интенсивности пептида имеют значения в диапазоне от 10% и 40%. Самое низкое молярное соотношение HSA/GD, которое позволяло обнаружить аддукт Y-411 - 1/0.02, соответствующие 13 μM GD (2,4 мкг/мл)[27].
В этой связи, требуется тщательная разработка новых подходов и методик обогащения пептидных смесей фосфорсодержащими пептидами с использованием таких методов, как металл-аффинная хроматография, в том числе, разработка новых эффективных и специфичных металл-аффинных сорбентов.
Таким образом, целью работы является:
Разработка нового металл-аффинного сорбента, на основе регулярных мономолекулярных наноструктур, содержащих Fe (III) (РММС (FeIII)) для специфичного выделения фосфорсодержащих пептидов из биологических образцов.
Задачи:
-
Отработать метод получения РММС Fe(III).
-
Провести охарактеризацию полученного сорбента. Определить сорбционную емкость, удельную поверхность и электроповерхностные свойства сорбента.
-
Опробовать РММС (Fe III) в качестве металл-аффинного сорбента для обогащения биологического образца фосфорилированными пептидами на примере суммарного белка молока коровы.
-
Показать возможность использования РММС (Fe III) в качестве металл-аффинного сорбента для прободготовки, в исследовании, посвященном масс-спектрометрическому обнаружению и идентификации аддуктов сывороточного альбумина человека с зоманом.
