
- •Содержание
- •1 Аналитический обзор 11
- •2 Методическая часть 29
- •3. Экспериментальная часть 37
- •4 Обсуждение результатов эксперимента 44
- •Условные обозначения
- •Введение
- •1 Аналитический обзор
- •1.1 Регулярные мультимолекулярные структуры
- •1.2 Хроматография
- •1.2.1 Металл-аффинная хроматография – сочетание принципов лигандообменной и аффинной хроматографии
- •1.3 Методы характеризации сорбентов
- •1.3.1 Удельная поверхность
- •1.3.2 Емкость сорбента, влажность
- •1.3.3 Электрокинетический потенциал
- •1.4 Maldi масс-спектрометрия
- •1.5 Идентификация белков – метод pmf
- •1.6 Тандемная масс-спектрометрия (мс-мс) и идентификация пептиов по фрагментным масс-спектрам
- •1.7 Идентификация пост-трансляционных модификаций
- •1.8 Аддукты зомана с сывороточным альбумином
- •2 Методическая часть
- •2.1 Используемые материалы:
- •2.2 Методики получения сорбента и исследования
- •2.2.1 Получение рмм (FeIii) сорбента
- •2.2.2 Определение удельной поверхности сорбента
- •2.2.3 Определение сорбционной емкости сорбента
- •2.2.3.1 Проведение металл-аффинного анализа
- •2.2.3.2 Определение влажности рмм Fe(III) сорбента
- •2.2.3.3 Определение влажности коммерческого сорбента
- •2.2.4 Анализ фосфорилированных пептидов казеина молока коровы
- •2.2.4.1 Выделение суммарного белка из обезжиренного сухого молока
- •2.2.4.2 Гидролиз суммарного белка молока коровы в присутствии трипсина
- •2.2.5 Анализ фосфонилированных пептидов сывороточного альбумина человека
- •2.2.5.1 Гидролиз сывороточного альбумина человека в присутствии пепсина
- •2.2.6 Масс-спектрометрический анализ
- •2.2.6.1 Масс-спектрометрический анализ методом maldi-tof и maldi-tof-tof
- •2.2.6.2 Обработка данных масс-спектрометрического анализа
- •3. Экспериментальная часть
- •3.1. Получение рмм Fe(III) сорбента
- •3.2 Определение удельной поверхности
- •3.3 Определение электрокинетического потенциала и размера частиц.
- •3.4 Определение сорбционной емкости сорбента
- •3.4.1Проведение металл-аффинного анализа
- •3.4.2 Определение содержание пептида в проскоке и контрольном образце
- •3.4.3 Определение влажности коммерческого сорбента и рммс Fe(III)
- •3.5 Анализ фосфорилированных пептидов казеина молока коровы
- •3.5.1 Приготовление микроколонки с сорбентом
- •3.5.2 Металл-аффинная хроматография на коммерческом сорбенте
- •3.5.3 Металл-аффинная хроматография на рммс Fe(III)
- •3.6 Анализ фосфонилированных пептидов сывороточного альбумина человека
- •3.6.1 Приготовление металл-аффинной колонки
- •3.6.2 Выбор элюэнта
- •3.6.3 Металл-аффинная хроматография на коммерческом сорбенте
- •3.6.4 Металл-аффинная хроматография на рммс Fe(III)
- •3.7 Масс-спектрометрический анализ
- •3.7.1 Проведение масс-спектрометрического анализа
- •4 Обсуждение результатов эксперимента
- •4.1 Охарактеризация сорбента
- •4.1.1. Получение рмм сорбента, содержащего ионы железа (III) и приготовление хроматографических колонок.
- •4.1.2 Определение удельной поверхности
- •4.1.3 Определение емкости сорбента
- •4.1.4 Микроэлектрофоретические исследования.
- •4.1.4.1 Определение электрокинетического потенциала
- •4.1.4.2 Расчет удельной поверхности рмм сорбента
- •4.2 Исследование возможности специфичного выделения фосфорилированных пептидов из биологического образца методом металл-аффинной хроматографии с использованием рммс(Fe III)
- •4.3 Разработка метода металл-аффинного выделения прямых ковалентных аддуктов зомана с сывороточным альбумином с помощью рмм сорбентов Fe(III) для последующего масс-спектрометрического анализа
- •4.3.1 Поиск и идентификация аддуктов сывороточного альбумина человека с зоманом
- •4.3.2 Выделение фосфонилированных пептидов сывороточного альбумина человека с использованием рммс (Fe III)
- •4.3.2 Масс-спектрометрическая идентификация сайтов связывания зомана с альбумином при взаимодействии с белками in vitro
- •Выводы по работе:
- •Список использованных источников.
- •Приложение а Технико-экономическая оценка научно-исследовательской работы Обоснование договорной цены на разработку
- •Расчет затрат на научно-исследовательскую разработку
- •Расчет затрат на сырье, материалы, реактивы, покупные изделия и полуфабрикаты
- •Расчет затрат на энергоресурсы
- •Расчет затрат на приборы, оборудование для научно-экспериментальных работ и суммы амортизационных отчислений
- •Расчет затрат на оплату труда с обязательными начислениями
- •Прочие затраты Расчет суммы расходов по использованию вычислительной техники.
- •Затраты на выполнение специальных анализов.
- •Расчет суммы накладных расходов
- •Расчет сметы затрат на разработку
- •Приложение б Охрана труда и окружающей среды
- •1 Опасные и вредные производственные факторы
- •2 Пожарная безопасность
- •3 Обеспечение санитарно-гигиенических условий
- •4 Вентиляция
- •5 Аптечка и ее содержание
- •6 Освещение помещения
- •7 Безопасность выполнения работы в лаборатории
- •8 Анализ технологических операций
- •9 Меры первой помощи
- •Охрана окружающей среды
- •Приложение в
- •Приложение г Масс-спектры смеси триптических пептидов казеина, элюированных с колонки с сорбентом, содержащим ионы железа.
4.1.4.2 Расчет удельной поверхности рмм сорбента
С помощью прибора Zetaciser NANO ZC были измерены размеры частиц сорбента, их радиус составил 200нм. Это позволяет нам рассчитать значение удельной поверхности.
Масса одной частицы (формула 2):
![]() (2)
(2)
где ρ – плотность стеарата.;
r – радиус частицы, мм.
Для большинства стеаратов плотность лежит в интервале 1.01-1.08 г/мл.
Число частиц в 1 грамме:
![]() (3)
(3)
Площадь поверхности 1 частицы
![]() (4)
(4)
Удельную поверхность находим по формуле (5):
 (5)
(5)
Рассчитанное значение удельной поверхности имеет немного большее значение, чем найденное экспериментально, что можно объяснить тем, что при микроэлектрофоретических исследованиях монослои сорбента были подвергнуты дополнительному диспергированию.
4.2 Исследование возможности специфичного выделения фосфорилированных пептидов из биологического образца методом металл-аффинной хроматографии с использованием рммс(Fe III)
Тестовые смеси для проверки качества сорбента должны быть в постоянном использовании, но коммерческие препараты, представляющие собой очищенные фосфорилированные пептиды, очень дороги. Поэтому качестве собственного стандарта были получены и использованы фосфорилированные пептиды казеина коровы. Ферментативный гидролиз казеина проводился без модификации, так как известно, что казеин не содержит S-S-связей. Масс-спектр триптического гидролизата суммарного белка молока представлен на рисунке 4.2.1
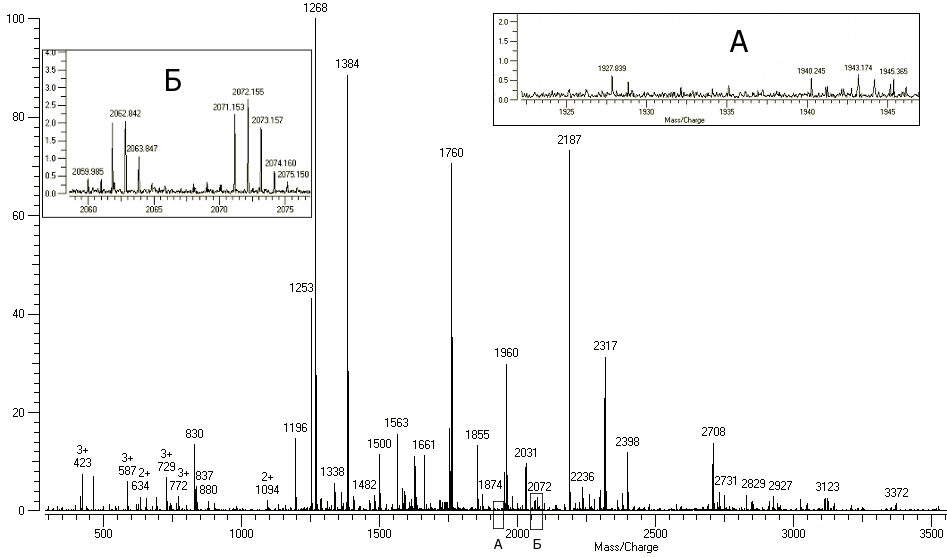
А – диапазон масс 1920-1950 Да, Б – диапазон масс 2055-2080 Да (MALDI-ICR)
Рисунок 4.2.1 Масс-спектр гидролизата суммарного белка молока коровы до обогащения
Для идентификации белков была использована программа MS-Fit. Результаты идентификации представлены в таблице 4.2.1.
Таблица 4.2.1 Идентификация суммарного белка коровьего молока
|
Hit Number |
MOWSE Score |
% Cov |
% TIC |
Mean Err, ppm |
Data Tol, ppm |
Species |
Protein Name |
|
1 |
3.74e+9 |
61.7 |
4.4 |
60.8 |
75.7 |
BOVIN |
Alpha-S1-casein |
|
2 |
950398 |
46.4 |
3.0 |
54.9 |
122 |
BOVIN |
Beta-casein precursor |
|
3 |
719894 |
79.3 |
6.9 |
86.5 |
181 |
BOVIN |
Alpha-S2-casein precursor |
|
4 |
496585 |
46.8 |
2.8 |
59.4 |
101 |
BOVIN |
Kappa-casein precursor |
Следует отметить, что все мажорные компоненты масс-спектра, представленного на рисунке 4.2.1, были отнесены программой к Alpha-S1, Alpha-S2, Beta и Kappa субъединицам казеина быка, и с примерно равной долей вероятности все перечисленные субъединицы казеина быка были идентифицированы (таблица 4.2.1). В качестве примера приведем идентификацию Alpha-S1 субъединицы казеина быка. В таблице 4.2.2 представлены MH+ пептидов, которые программой были отнесены к этой субъединице, и три сигнала были определены как относящиеся к фосфорилированным пептидам.
Таблица 4.2.2 Идентификация Alpha-S1 субъединицы казеина быка
|
m/z Submitted |
MH+ Matched |
Delta, ppm |
Modifications |
Start |
End |
Missed Cleavages |
Sequence |
|
831.3794 |
831.3843 |
-5.88 |
|
99 |
105 |
0 |
(K) EDVPSER(Y) |
|
910.4685 |
910.4741 |
-6.16 |
|
140 |
147 |
0 |
(K) EGIHAQQK(E) |
|
1267.6113 |
1267.7045 |
-73.5 |
|
106 |
115 |
0 |
(R) YLGYLEQLLR(L) |
|
1267.6972 |
1267.7045 |
-5.76 |
|
106 |
115 |
0 |
(R) YLGYLEQLLR(L) |
|
1337.6820 |
1337.6808 |
0.894 |
|
95 |
105 |
1 |
(K) HIQKEDVPSER(Y) |
|
1384.7407 |
1384.7300 |
7.74 |
|
38 |
49 |
0 |
(R) FFVAPFPEVFGK(E) |
|
1506.7863 |
1506.7846 |
1.16 |
|
135 |
147 |
1 |
(R) LHSMKEGIHAQQK(E) |
|
1660.7945 |
1660.7942 |
0.185 |
1Phospho |
121 |
134 |
0 |
(K)VPQLEIVPNSAEER(L) |
|
1760.0144 |
1759.9450 |
39.5 |
|
23 |
37 |
0 |
(K) HQGLPQEVLNENLLR(F) |
|
1759.9389 |
1759.9450 |
-3.44 |
|
23 |
37 |
0 |
(K) HQGLPQEVLNENLLR(F) |
|
1767.9052 |
1767.7589 |
82.8 |
|
58 |
73 |
0 |
(K) DIGSESTEDQAMEDIK(Q) |
|
1871.9890 |
1871.9862 |
1.52 |
|
119 |
134 |
1 |
(K) YKVPQLEIVPNSAEER(L) |
|
1927.7027 |
1927.6916 |
5.77 |
2Phospho |
58 |
73 |
0 |
(K)DIGSESTEDQAMEDIK(Q) |
|
1951.9551 |
1951.9525 |
1.34 |
1Phospho |
119 |
134 |
1 |
(K)YKVPQLEIVPNSAEER(L) |
|
2080.0107 |
2080.0709 |
-29.0 |
|
99 |
115 |
1 |
(K) EDVPSERYLGYLEQLLR(L) |
|
2169.1536 |
2169.3668 |
-98.3 |
|
3 |
22 |
1 |
(K) LLILTCLVAVALARPKHPIK(H) |
|
2235.2457 |
2235.2357 |
4.49 |
|
19 |
37 |
1 |
(K) HPIKHQGLPQEVLNENLLR(F) |
|
2316.1452 |
2316.1369 |
3.58 |
|
148 |
166 |
0 |
(K) EPMIGVNQELAYFYPELFR(Q) |
|
3207.5981 |
3207.5932 |
1.53 |
|
140 |
166 |
1 |
(K) EGIHAQQKEPMIGVNQELAYFYPELFR(Q) |
Кроме того, по результатам обработки, пептиды, отнесенные к Alpha-S1-казеину перекрывают 61.7% аминокислотной последовательности белка, что является очень хорошим результатом.
Аналогичная ситуация наблюдалась и при идентификации остальных субъединиц казеина быка. В то же время, сигналы, отнесенные к фосфорилированным пептидам, являются минорными компонентами спектра, что обусловливает необходимость обогащения образца.
Для проведения процедуры обогащения приготовили микроколонку с сорбентом (рисунок 4.1.1.1) по методике, описанной в п.3.5.1.
Результаты обогащения представлены на спектрах (рис. 4.2.2 а,б; рисунок 4.2.3б вынесен в Приложение Г). Как и в случае идентификации, в качестве примера приведем определение фосфорилированных пептидов, отнесенных к Alpha-S1-казеину. Программой MS-Fit три сигнала были определены, как фосфорилированные пептиды Alpha-S1-казеина, а именно: 1660.7945 Да, 1927.7027 Да и 1951.9551 Да. Причем, пептид с MH+ 1927.7027 Да должен содержать 2 остатка фосфорной кислоты. Действительно, на рисунке 3.2.3.а показаны все три упомянутых сигнала, а также продукты деградации этих пептидов в результате столкновений ионов в накопительной ячейке масс-спектрометра Varian, результатом которого является последовательное отщепление фосфорной кислоты.


Рисунок 4.2.2.а. Масс-спектр смеси пептидов, элюированных с колонки с РММС Fe(III). Область масс 1250-2150 Да (MALDI-ICR).
Таким образом, в результате проведенных экспериментов было показано, что при обогащении биологических проб фосфорилированными пептидами использование сорбента, содержащего ионы Fe3+, приводит к успешным результатам, поэтому этот сорбент мы использовали в дальнейшей работе.
Стоит отметить, что аналогичный анализ с применением коммерческого аналога показал идентичные результаты.
