Соединения серы
Водородные соединения
Сероводород- бесцветный очень ядовитый газ с неприятным запахом. Молекула имеет угловую форму (угол 92,1°), которая определяется расположением в пространстве двух σ-связывающих р-орбиталей серы. Способность образовывать водородные связи у Н2Ѕ выражена слабо, поэтому в обычных условиях сероводород является газом (tпл = - 83,6°C, tкип = - 60,8°C). Молекула Н2Ѕ полярная, но растворимость сероводорода в воде невелика 2,58 мл в 100 мл воды (при 20 °C и давлении 1 атм.). При комнатной температуре насыщенный раствор имеет концентрацию ≈ 0,1 моль/л. Водный раствор сероводорода является слабой кислотой:
Н2Ѕ = Н+ + НЅ-
НЅ- = Н+ + Ѕ2-
Сероводород – хороший восстановитель, на воздухе горит с образованием диоксида серы:
2Н2Ѕ + 3О2 = 2ЅО2 + 2Н2О + 529 кДж
при недостатке кислорода получается сера:
2Н2Ѕ + О2 = 2Ѕ(кр) + 2Н2О(ж)+ 532 кДж
Сероводород легко окисляется диоксидом свинца:
4Н2Ѕ + 3РbО2 = 2ЅО2 + 4Н2О + 3PbS
и даже диоксидом серы:
2Н2Ѕ + ЅО2 = 3Ѕ + 2Н2О
Эта реакция имеет важное значение в кругообороте серы в природе и процессах образования месторождений элементарной серы.
В водном растворе сероводород ведёт себя как мягкий восстановитель при этом образуются, как правило, элементарная сера и сульфат-ион. Глубина окисления сероводорода и продукты реакции определяются количеством и природой окислителя:
Н2Ѕ + Сl2 = Ѕ + 2НСl
Н2Ѕ + 4Вr2 + 4Н2О = Н2ЅО4 + 8НВr
Н2Ѕ + I2 = Ѕ + 2НI
В ряде случаев при окислении Н2Ѕ могут получаться сернистая кислота, тиосульфаты или политионаты.
Следует отметить, что водные растворы сероводорода за счет ионов водорода могут окислять металлы, образующие сульфиды:
Н2Ѕ + 2Ag = Ag2S↓ + Н2
Соли сероводородной кислоты – сульфиды – можно разделить на несколько групп:
-
растворимые в воде, в растворах подвергаются гидролизу
Ѕ2- + Н2О = ОН- + НЅ-
-
нерастворимые в воде, но растворимые в разбавленных кислотах (MnS, ZnS, FeS)
ZnS + 2HCl = ZnCl2 + Н2Ѕ
-
растворимые в кислотах-окислителях (Ag2S, Bi2S3, PdS)
Ag2S + 4НNO3 = 2NO2 + Ag2NO3 + Ѕ + 2Н2О
-
растворимые в растворах сульфидов щелочных металлов (SnS2, Sb2S3, Sb2S5)
SnS2 + Nа2Ѕ = Nа2SnS3
Сульфиды металлов проявляют основные, амфотерные и кислотные свойства. С неметаллами сера также образует сульфиды, которые имеют кислотный характер. Они разлагаются водой, а с основными сульфидами образуют тиосоли:
СЅ2 + Н2О = Н2Ѕ + СО2
СЅ2 + Na2S = Na2СS3
Растворимые сульфиды бериллия, алюминия и хрома (+3), связи в которых имеют ковалентный характер, водой полностью гидролизуются:
Al2Ѕ3 + 6Н2О = 3Н2Ѕ + 2Al(ОН)3
Сульфиды проявляют восстановительные свойства. Сероводород получают разложением сульфидов железа или кальция соляной кислотой:
СаЅ + 2НСl = Н2Ѕ + СаCl2
или синтезом из элементов (особо чистый сероводород)
Н2 + Ѕ = Н2Ѕ
При взаимодействии горячих растворов сульфидов с серой образуются полисульфиды (персульфиды), которые можно рассматривать как производные полисероводорода Н2Ѕх:
Nа2Ѕ + (х – 1)Ѕ = Na2Ѕх (х = 2 – 23)
Персульфиды встречаются в природе, например, минерал пирит представляет дисульфид железа (II).
При подкислении кислотой полисульфиды разлагаются с выделением серы и сероводорода:
Na2Ѕх + 2НСl = 2NaСl + Н2Ѕ +(х – 1)Ѕ (t >–5°С)
Однако, при температуре –20°С полисульфиды разлагаются с образованием полисероводородов (сульфанов):
Na2Ѕх + 2НСl = 2NaСl + Н2Ѕх
Полисульфиды водорода (персульфиды водорода, сульфаны) Н2Ѕх – желтые жидкости (температура плавления от -90 до - 50 °С), похожие на оливковое масло, с удушливым запахом. С увеличением содержания серы окраска персульфанов меняется с желтой (Н2Ѕ) до красной (Н2Ѕ9). Все сульфаны имеют цепочечное строение. При нагревании цепочки разрываются, и из высших сульфанов образуются низшие (Н2Ѕ2 и Н2Ѕ3). Вода медленно разлагает сульфаны с выделением сероводорода.
Простейший сульфан - дисульфид водорода – аналог пероксида водорода, а его соли – дисульфиды – подобны пероксидам. Дисульфиды проявляют восстановительные и окислительные свойства, вступают в реакции диспропорционирования:
Na2S2 + SnS = Na2SnS3;
Na2S2 + Cl2 = 2S + 2NaCl;
Na2S2 + 2HCl = S + H2S + 2NaCl.
Кислородные соединения
Для серы известно несколько неустойчивых низших оксидов S2O, S2O2, SO, S8O. Так монооксид серы был получен в 1933 г. при тихом разряде в смеси газов
SO2 + S(газ) = 2SO.
Диоксид серы SO2 – бесцветный газ (ρ = 1,539 г/л при 0 °C) с удушливым запахом (tкип = – 10 °C, tпл = –73 °C). Жидкий диоксид серы растворяет жиры, серу. Молекула диоксида серы имеет угловое строение, является полярной и имеет высокую реакционную способность. Диоксид серы хорошо растворяется в воде – 40 л в 1 л воды при 20 °C и давлении в 1 атм, образуя гидрат SO2·nН2О и частично молекулы Н2SO3.
Получают SO2 сжиганием серы или обжигом сульфидов, чаще всего FeS2:
S + O2 = SO2
2NiS + 3O2 = 2NiO + 2SO2
FeS2 + 11O2 = 8SO2 + 2Fe2O3
В лаборатории получают действием кислот на сульфит натрия:
Na2SO3 + H2SO4 = SO2 + Na2SO4 + H2O
Или взаимодействием меди с концентрированной серной кислотой:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O.
Диоксид серы является кислотным оксидом и в реакции с растворами щелочей образует средние и кислые соли:
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + NaOH = NaHSO3
Для диоксида серы характерна окислительно-восстановительная двойственность, однако восстановительные свойства выражены сильнее. Особенно легко SO2 окисляется в присутствии воды. Так, SO2 обесцвечивает растворы перманганата калия и йода:
5SO2 + 2H2O + KMnO4 = H2SO4 + 2MnSO4 + 2KHSO4
На свету в присутствии активированного угля диоксидом серы окисляется хлором:
SO2 + Cl2 = SO2Cl2()
Сернистая кислота H2SO3. Водный раствор SO2 имеет кислую реакцию и называется сернистой кислотой, однако в индивидуальном виде Н2SO3 не выделена.
При добавлении к раствору щёлочи возможно образование кислых и средних солей – гидросульфитов и сульфитов:
H2SO3 + KOH = KHSO3 + H2O
KHSO3 + KOH = K2SO3 + H2O
Сернистая кислота и её соли проявляют окислительно-восстановительную двойственность с преобладанием восстановительных свойств.
Триоксид серы SO3 – это жидкое или твёрдое вещество при комнатной температуре. Молекулы SO3 существуют только в газовой фазе и имеют форму равностороннего треугольника. При конденсации паров образуется жидкость, состоящая в основном из триммеров (SO3)3, образованных тетраэдрами (SO4). Твердый SO3 существует в нескольких полиморфных модификациях. Триоксид серы имеет очень высокую реакционную способность и проявляет сильные окислительные свойства:
В лаборатории получают термическим разложением дисульфатов или дисерной кислоты, а впромышленности – каталитическим окислением SO2. SO3 применяется в производстве серной кислоты, при производстве безводных сульфатов, хлоросерной и фторосерной кислот.
Серная кислота H2SO4 – один из важнейших продуктов химической промышленности; мировое производство достигает 130 млн. тонн в год. Это тяжелая вязкая жидкость неограниченно смешивающаяся с водой с выделением большого количества теплоты. На практике используется 96 %-й раствор и растворы с более низкой концентрацией. Получают контактным способом, реже башенным (нитрозным)
Серный ангидрид SO3 содержит серу в степени окисления +6, атом серы находится в состоянии sp2 гибридизации, молекула имеет форму равностороннего треугольника. Серный ангидрид имеет несколько модификаций, отличающихся степенью полимеризации молекул, например a-SO3 является тримером, а b-SO3 - полимер.
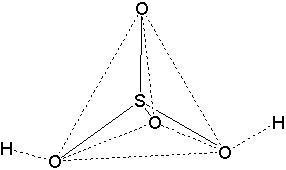
В основе строения молекулы серной кислоты лежит тетраэдр, в центре которого находится атом серы, а в вершинах - атомы кислорода: