
- •Раздел 1. Термохимия
- •1.1. Примеры задач с решениями
- •1.2. Вопросы для самоподготовки
- •Раздел 2. Энтропия и энергия Гиббса
- •2.1. Примеры задач с решениями
- •2.2. Вопросы для самоподготовки
- •Раздел 3. Химическая кинетика
- •3.1. Примеры задач с решениями
- •3.2. Вопросы для самоподготовки
- •Раздел 4. Химическое равновесие
- •Вопросы для самоподготовки
- •Раздел 5. Способы выражения концентрации растворов
- •Раздел 6. Коллигативные свойства растворов
- •Раздел 7. Ионное произведение воды. Водородный показатель
2.2. Вопросы для самоподготовки
-
Не проводя вычислений, обоснуйте, как изменяется энтропия системы в ходе реакций
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г);
2NO (г) + O2 (г) = 2NO2 (г);
C (т) + H2O (г) = CO (г) + H2 (г).
-
Рассчитайте по справочным данным значение DS0 реакции
С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г).
|
Вещество |
|
|
С2H4(г) O2(г) CO2(г) H2O(г) |
219,4 205,0 213,2 188,7 |
-
Рассчитайте значение G0 по справочным данным и оцените возможность самопроизвольного прохождения в стандартных условиях реакции
MgCO3(т) = MgO(т) + CO2(г).
|
Вещество |
G0обр, кДж/моль |
|
MgCO3(т) MgO(т) СО2(г) |
-1028 - 569 - 395 |
-
Рассчитайте значение
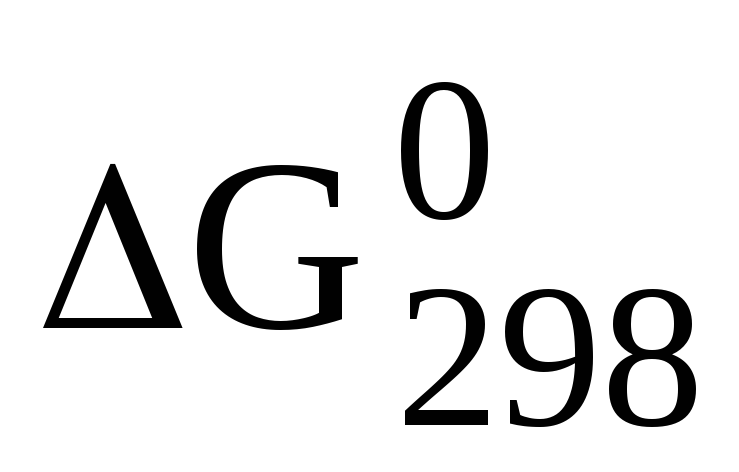 реакции
реакции
CCl4(г) + 4HCl (г) = СH4(г) + 4Cl2(г) ,
если
известны значения
![]() = +434 кДж/моль и
= +434 кДж/моль и ![]() = - 117 Дж/(моль.К).
Оцените термодинамическую возможность
данной реакции в стандартных условиях.
= - 117 Дж/(моль.К).
Оцените термодинамическую возможность
данной реакции в стандартных условиях.
Раздел 3. Химическая кинетика
3.1. Примеры задач с решениями
-
Задача 1. Для реакции
2NO(г) + Cl2(г) = 2NOCl(г)
экспериментальное кинетическое уравнение совпадает с математическим выражением закона действующих масс. Определите, во сколько раз увеличится скорость реакции при увеличении концентрации оксида азота (II) в три раза.
Решение
Кинетическим уравнением называют математическую зависимость скорости реакции от концентрации. Согласно закону действующих масс, скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам. Кинетическое уравнение данной реакции
![]() .
.
Константа
скорости реакции k,
входящая в кинетическое уравнение, не
зависит от концентрации веществ.
Обозначим скорость реакции в системе
исходного состава
![]() .
Скорость реакции при повышении
концентрации оксида азота в три раза
.
Скорость реакции при повышении
концентрации оксида азота в три раза
![]()
Ответ: в 9 раз.
-
Задача 2. Рассчитайте, во сколько раз возрастает скорость реакции при повышении температуры от 20 до 50 0С ( = 3).
Решение
Согласно правилу Вант-Гоффа
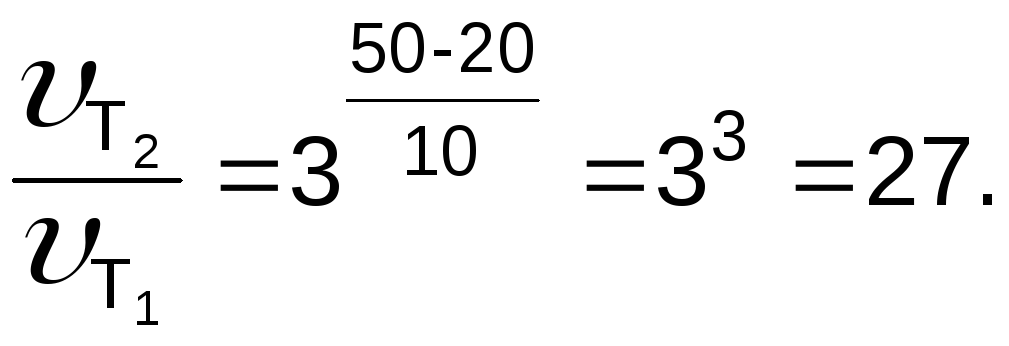
Ответ: в 27 раз.
-
Задача 3. Рассчитайте, во сколько раз увеличится продолжительность некоторой реакции при понижении температуры на 40 градусов ( = 2).
Решение
Продолжительность
и скорость реакции – обратно
пропорциональные величины. Обозначим
![]() и
и
![]() продолжительность
реакции при температуре Т2
и Т1
соответственно (Т2
<
Т1).
продолжительность
реакции при температуре Т2
и Т1
соответственно (Т2
<
Т1).
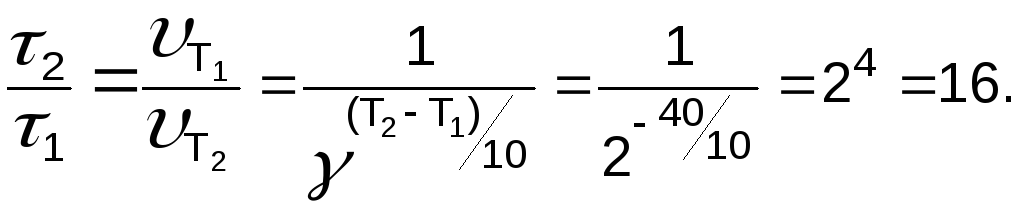
Ответ: в 16 раз.
3.2. Вопросы для самоподготовки
-
Запишите кинетическое уравнение элементарной реакции
2NO(г) + О2(г) = 2NO2(г)
и поясните смысл величин, входящих в кинетическое уравнение. Рассчитайте, как изменится скорость реакции при уменьшении концентрации NO в 2 раза.
-
Кинетическое уравнение реакции
4H2(г) + 2NO2(г) = 4H2O(г) + N2(г)
имеет
вид
![]() .
Рассчитайте, во сколько раз увеличится
скорость реакции при увеличении давления
в 2 раза.
.
Рассчитайте, во сколько раз увеличится
скорость реакции при увеличении давления
в 2 раза.
