
- •Лекция 1 Магнитное поле Введение
- •Постоянные магниты
- •Магнитное действие тока
- •Индукция магнитного поля
- •Картины силовых линий
- •Домашнее задание
- •Леция 2 Действие магнитного поля на проводник с током
- •Частные случаи:
- •Действие магнитного поля на движущийся заряд
- •Вывод формулы для модуля силы Лоренца
- •Работа силы Лоренца
- •Движение заряженной частицы в магнитном поле
- •Период обращения частицы в магнитном поле
- •Частица влетает в магнитное поле под углом к силовым линиям
- •Частица влетает в магнитное поле параллельно силовым линиям
- •Домашнее задание
- •Лекция 3 Магнитные свойства вещества
- •Домашнее задание:
- •Электромагнетизм Магнитный поток
- •Явление электромагнитной индукции
- •3. Контур выдвигается из поля
- •Домашнее задание
- •Лекция 4 Направление индукционного тока.
- •Закон электромагнитной индукции (закон Фарадея)
- •Эдс индукции движущегося проводника
- •Самоиндукция. Индуктивность
- •Закон Фарадея для самоиндукции
- •Энергия магнитного поля
- •Переменный ток Лекция 5 Введение. Немного математики
- •Производные
- •Вращение рамки в однородном магнитном поле
- •Произвольная начальная фаза – рамка расположена под произвольным углом к силовым линиям.
- •Что такое фаза гармонических колебаний?
- •Элементы цепи переменного тока
- •Резистор в цепи постоянного тока
- •Резистор в цепи переменного тока
- •Мощность на резисторе в цепи переменного тока
- •Лекция 6 Конденсатор в цепи переменного тока
- •Емкостное сопротивление
- •Катушка индуктивности в цепи переменного тока
- •Мощность в цепи переменного тока
- •Лекция 7 Полная цепь переменного тока
- •Свободные и вынужденные колебания
- •Резонанс в электрической цепи
- •Трансформаторы
- •Принцип работы
- •Холостой ход (разомкнутая вторичная обмотка)
- •Нагруженный трансформатор (замкнутая вторичная обмотка)
- •Вопрос 1 Можно ли включать трансформатор в цепь постоянного тока? Почему?
- •Вопрос 2. Сколько может быть у трансформатора первичных обмоток? вторичных?
- •Метод векторных диаграмм. Закон Ома для цепи переменного тока
- •Передача электроэнергии
- •Свободные электромагнитные колебания
- •Превращения энергии в колебательном контуре
- •Лекция 8 электромагнитные волны Идеи теории Максвелла
- •Свойства электромагнитных волн
- •Излучение и прием электромагнитных волн.
- •Принципы радиосвязи
- •Шкала электромагнитных волн
- •Волновая оптика
- •Дифракция света. Дифракционная решетка.
- •Особенность обозначений:
- •Падение смешанного излучения на дифракционную решетку
- •Лекция 9 Геометрическая оптика. Законы геометрической оптики Законы отражения и преломления света. Показатель преломления.
- •Законы преломления света:
- •Полное внутреннее отражение
- •Ход лучей в призме
- •Построение изображения в плоском зеркале
- •Обозначения на схемах:
- •Ход лучей в линзах
- •Построение изображений в линзах
- •Формула линзы
- •Лекция 10 Элементы специальной теории относительности Введение
- •Постулаты сто
- •Относительность промежутков времени:
- •Относительность расстояний
- •Относительность одновременности
- •Принцип соответствия
- •Элементы релятивистской динамики
- •Квантовая физика Квантовая гипотеза Планка:
- •Свойства фотонов:
- •Фотоэффект
- •Законы Столетова для фотоэффекта
- •Спектр атома водорода
- •Излучение Солнца
- •Строение атома
- •Опыты Резерфорда
- •Неустойчивость атома Резерфорда
- •Постулаты Бора
- •Объяснение закономерностей линейчатых спектров
- •Объяснение спектра атома водорода
- •Лекция 12 Физика атомного ядра Элементарные частицы
- •Специальные единицы в ядерной физике
- •Методы наблюдения и регистрации элементарных частиц (домашнее задание: темы для докладов))
- •Протонно-нейтронная модель атомного ядра
- •Изотопы
- •Ядерные силы
- •Дефект масс атомного ядра
- •Энергия связи атомного ядра
- •Устойчивые и неустойчивые ядра
- •Удельная энергия связи
- •Радиоактивность
- •Закон радиоактивного распада
- •Деление атомных ядер
- •Сравнение энергетического выхода реакций горения органического топлива и реакций ядерного деления
- •Ядерные реакции
- •Реакции ядерного синтеза
- •Цепная реакция. Критическая масса
- •Ядерные реакторы
Неустойчивость атома Резерфорда
Атом должен непрерывно излучать электромагнитные волны
В результате за короткое время (~10-8 секунды) электрон должен потерять энергию и упасть на ядро
Вывод:
Устойчивые атомы, в точности соответствующие модели Резерфорда, не существуют
Существование устойчивых состояний атома показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Постулаты Бора
Постулат 1. Атомная система может находиться только в некоторых особых, или стационарных, состояниях
Каждому состоянию соответствует определенная энергия Еn, n - номер состояния.
Находясь в стационарном состоянии, атом не излучает энергию.
Атом водорода имеет один электрон на орбите.
Для такого атома номер энергетического уровня -это номер орбиты, на которой может
располагаться электрон.
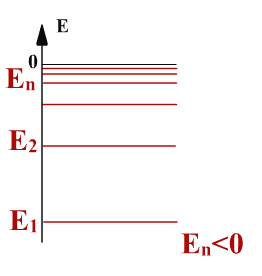
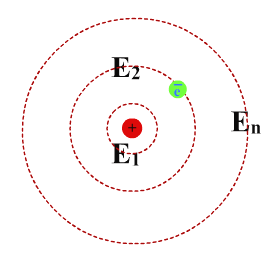
Первое состояние имеет наименьшую энергию и называется основным.
Все остальные, более высокие уровни энергии, называются возбужденными.
В основном состоянии атом может находиться сколь угодно долго.
Для каждого возбужденного состояния есть свое определенное время жизни.
Энергия n уровня En связана с энергией основного уровня E1
En = E1/n2
Здесь Е1 – энергия основного (первого )уровня, равная для атома водорода –13,6 эВ.
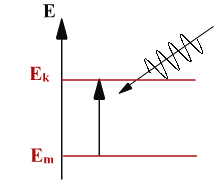
Постулат 2.
При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух стационарных состояниях:
hν = Еk - Еn
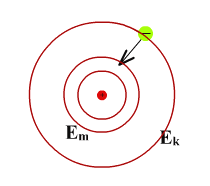
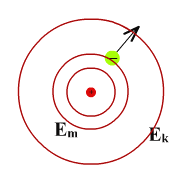
Объяснение закономерностей линейчатых спектров
И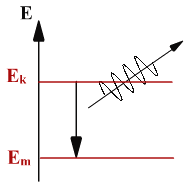
 злучение
фотона
злучение
фотона
Поглощение фотона
Объяснение спектра атома водорода
Используя связь En = E1/n2 , из второго постулата Бора легко получается обобщенная формула Ридберга для спектра атома водорода.
hν = Еk - Еn
Ek = E1/k2
En = E1/n2
hν = E1/k2 - E1/n2 = E1 (1/k2 - 1/n2)
ν = (E1/h) (1/k2 - 1/n2)
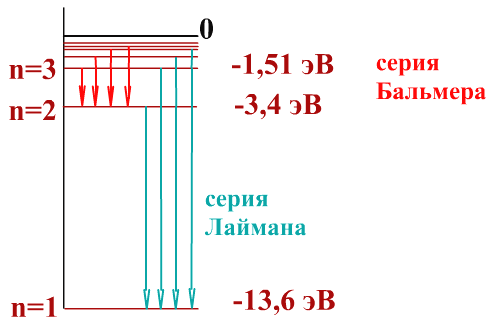
Для атома водорода энергия первого уровня равна приблизительно —13,6 эВ.
Серии линий в спектре атома водорода образуются при переходах атома:
на первый энергетический уровень – серия Лаймана
на второй энергетический уровень – серия Бальмера
на третий энергетический уровень – серия Пашена
Домашнее задание
На рисунке представлена энергетическая диаграмма атома водорода. Стрелками указаны переходы с излучением или поглощением фотонов.
1. При каком переходе происходит излучение фотона с наибольшей энергией?
При каком переходе происходит поглощение фотона с наибольшей частотой?
При каком переходе происходит излучение фотона с наибольшей длиной волны?
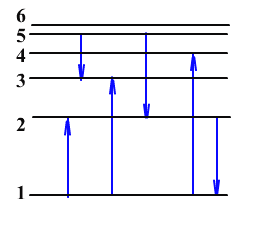
2. Определите отношение энергий атома в первом и третьем энергетическом состояниях
3. Определите отношение энергий фотонов, излученных при переходе с первого уровня на второй и с первого уровня на четвертый.
